胆碱能抗炎通路对失血性休克/容量复苏大鼠急性肺损伤的影响*
宋晓阳,黎笔熙,陶 军,周 翔,秦明哲,谭 焱,殷桂林
(广州军区武汉总医院,湖北武汉430070)
胆碱能抗炎通路对失血性休克/容量复苏大鼠急性肺损伤的影响*
宋晓阳,黎笔熙,陶军,周翔,秦明哲,谭焱,殷桂林
(广州军区武汉总医院,湖北武汉430070)
摘要:目的探讨胆碱能抗炎通路(CAP)对失血性休克/容量复苏(HS/R)诱发的急性肺损伤(ALI)的影响。方法成年SPF级雄性SD大鼠20只,随机分为迷走神经刺激组(VS组)、迷走神经离断组(VO组)、对照组(SC组)和假手术组(SS组)4组,每组5只。VS组、VO组和SC组通过动脉放血/容量复苏建立失血性休克诱导的ALI模型,容量复苏前VS组电刺激右侧迷走神经15 min,VO组离断右侧迷走神经干,SC组不做特殊处理,SS组不制作ALI模型。分别于放血前(T0)、MAP降至目标值5 min后(T1)、开始复苏前(T2)、复苏至预定血压5 min(T3)、30 min(T4)、90 min(T5)和150 min(T6)等7个时间点测定血浆白介素-6(IL-6)和肿瘤坏死因子-α(TNF-α)水平;于T0、T2和T6抽取动脉血测定氧合指数(OI);T6处死大鼠后观察肺组织结构病理改变,并测定肺组织核转录因子-κB(NF-κB)含量。结果T1至T6时段VS组、VO组和SC组IL-6和TNF-α浓度升高,高于SS组(P<0.05);T3至T6时段SC组IL-6和TNF-α浓度高于VS组(P<0.05),低于VO组(P<0.05)。T6时VS组、VO组和SC组OI均下降,3组均低于SS组(P<0.05);VO组和SC组OI比较差异无统计学意义(P>0.05),两组均低于VS组(P<0.05)。VS组、VO组和SC组肺组织NF-κB含量增加,高于SS组(P<0.05),VS组、VO组和SC组间NF-κB含量比较差异有统计学意义,SC组高于VS组(P<0.05)、低于VO组(P<0.05)。VS组、VO组和SC组肺损伤评分升高,高于SS组(P<0.05),VS组、VO组和SC组间评分比较差异有统计学意义,SC组高于VS组(P<0.05),低于VO组(P<0.05)。结论CAP对HS/R大鼠ALI具有一定的保护效应,其机制与NF-κB信号通路调控IL-6和TNF-α等炎症介质的释放有关。
关键词:失血性休克;容量复苏;肺损伤;胆碱能抗炎通路;炎症因子
急性肺损伤(acute lung injury,ALI)是严重创伤和失血性休克/复苏最为常见的并发症[1]。研究发现,迷走神经可以将整合后的中枢抗炎信息和免疫调节信息传递至外周组织和器官,从而介导内环境稳态的调节,发挥抗炎效应,TRACEY等[2]将该调节机体炎症反应能力的神经通路称为胆碱能抗炎通路(cholinergic antiinflammatory pathway,CAP)。研究证实CAP对内毒素引起的脓毒血症和ALI具有良好的抗炎效应和器官保护作用,但鲜有关于CAP对因失血性休克/容量复苏(hemorrhagic shock/resuscitation,HS/R)引起的ALI影响的文献报道。本研究试图探讨迷走神经介导的CAP对HS/R诱发的ALI的影响。
1材料与方法
1.1 实验动物与分组
成年SPF级雄性SD大鼠20只,体重300~400g,由武汉大学动物实验中心提供[No:42000500001649;大鼠用途:科学研究;许可证号:SCXK(鄂)2008-0004]。所有大鼠按照随机数字表随机分为迷走神经刺激组(VS组)、迷走神经离断组(VO组)、对照组(SC组)和假手术组(SS组),每组5只。实验方案上报医院实验动物伦理委员会批准。
1.2 模型制作
参照笔者前期的实验制作动物模型[3]。实验前大鼠在清洁动物房饲养2周,常规饲料及饮水,昼夜交替12 h。术前禁食12 h,自由饮水。采用6%水合氯醛5 ml/kg腹腔注射麻醉,麻醉起效后将大鼠固定于洁净操作台,沿颈部正中线切开皮肤,分离气管行气管切开术并置入14 G导管,保留自主呼吸。分离左侧颈内动脉并置入22 G动脉套管针,连接换能器监测平均动脉血压(mean arterial pressure,MAP)和心率。钝性分离右侧迷走神经后,游离出长约1.0 cm的迷走神经干与铂电极连接并用丝线固定备用。左侧腹股沟区沿血管走行方向切开皮肤,分离股静脉并置入22 G套管针备药物注射和输血输液之用。实验过程中每隔1.5 h腹腔内注射6%水合氯醛0.1 ml维持麻醉,并以5 ml/(kg·h)的速度经股静脉持续输注生理盐水补充手术野第三间隙液体丢失和呼吸道不显失水,以1.0 ml/h的速度经颈动脉持续输注生理盐水防止动脉导管堵塞。VS组、VO组和SC组预注0.2 ml ACD血液保存液的2 ml注射器经大鼠颈内动脉插管以每3 min抽取2 ml血液的速度放血制作休克模型,控制MAP降至35~40 mmHg (1 mmHg=0.133 kPa)。大鼠血容量按照56 ml/kg计算[4],失血量控制在大鼠预计血容量的45%~50%。所抽取的血液注入无菌EP管内保存于冰箱内,温度控制在4℃。维持MAP 35~40 mmHg持续60 min后进行容量复苏。开始容量复苏前VS组大鼠通过铂电极连接神经刺激仪(美国Nicolet公司)以1.0 mA、0.1 ms、1 Hz的电流刺激右侧迷走神经15 min,VO组离断右侧迷走神经干,保持远心端与刺激电极相连;VO和SC组大鼠不行迷走神经电刺激。VS组、VO组和SC组容量复苏时用前期采集的自体血液+生理盐水进行容量复苏,先输注自体血5ml,剩余的自体血按生理盐水∶血液以2∶1的比例混合后按需输注,MAP复苏至>90%基础水平后维持稳定[5],连续观察2.5 h,自体血输注完毕不能满足需要者适量输注生理盐水。SS组不制作THS/R诱发ALI模型,不行迷走神经电刺激,其余操作与另外3组相同。
1.3 观察指标
分别于放血前(T0)、MAP降至目标值5 min后(T1)、开始复苏前(T2)、复苏至预定血压5 min(T3)、30 min(T4)、90 min(T5)和150 min(T6)7个时间点抽取0.5 ml动脉血以3 000 r/min离心15 min,取上清液用无菌离心管保存于-40℃冰箱备用,集中采用酶联免疫吸附法测定血浆白介素-6(Interleukin-6,IL-6)和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)水平。为消除血液稀释对结果的影响,以T0时的红细胞压积(Hematocrit,Hct)水平为基础值,后续各点均按照公式校正实测数据:校正值=实测值× Hct基础值/Hct取样时。于T6时处死大鼠后获取肺组织标本,ELISA法测定肺组织核转录因子-κB (nuclear transcription factor-κB,NF-κB)含量。分别于T0、T2和T6时检测动脉血气并计算氧合指数(oxygenation index,OI),OI=动脉血氧分压/吸入氧浓度(PaO2/FiO2)(FiO2=0.21)。每次采血后补充同容量的生理盐水;取右肺下叶组织,用4%多聚甲醛固定液固定,经石蜡包埋、切片、染色等处理后,在200倍光镜下观察肺组织病理变化。肺损伤程度的判定参照文献[6-7]的方法,由病理专业人员根据肺间质水肿、炎症细胞浸润、肺泡出血3个特征性病理改变程度计分,其中无明显病变计0分,病变范围<25% 计1分,病变范围25%~50%计2分,病变范围>50% 计3分。每张切片从12点钟方向开始顺时针方向观察10个非重复的视野,计算10个视野平均分做为该部位的病理评分,最后累计各项病理变化的计分做为肺组织病变的病理评分,其中:0~3分为轻度损伤、4~6分为中度损伤、7~9分为重度损伤。
1.4 统计学方法
采用SPSS 22.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,多组间比较用单因素方差分析,不同时段不同分组间的比较用重复测量的方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 一般资料
4组大鼠体重比较差异无统计学意义(P>0.05),VS组、VO组和SC组大鼠失血率、生理盐水用量比较,差异无统计学意义(P>0.05)。见表1。
表1 各组大鼠基础资料比较(n=5,±s)

表1 各组大鼠基础资料比较(n=5,±s)
组别 体重/g 血容量/ml失血率/%生理盐水用量/ml VS组 364.0±23.0 20.4±1.3 46.1±6.7 16.8±2.6 VO组 368.0±39.6 20.6±2.2 47.1±7.0 16.2±1.6 SC组 361.0±29.7 20.2±1.7 47.5±6.2 16.4±3.4 SS组 362.0±27.7 21.3±1.5 - -F值 0.051 0.051 0.063 0.066 P值 0.984 0.984 0.939 0.936

附图 4组大鼠肺组织光镜下病理改变(HE×200)
2.2 肺组织病理学变化
光镜下可见VS组肺泡腔缩小,肺泡腔内可见淡红色的水肿液形成透明膜,肺泡间隔增宽,肺间质内可见淋巴细胞及中性粒细胞浸润;VO组病变明显加重,肺泡腔结构破坏,肺泡腔内可见大量红细胞漏出,肺间质内大量炎症细胞浸润;SC组部分肺泡腔结构破坏,肺泡腔内可见红细胞漏出,肺间质可见炎症细胞浸润;SS组肺泡壁结构完整,肺泡腔大小及肺泡间隔正常,肺泡内无明显渗出,肺间质未见明显水肿,未见炎症细胞浸润(见附图)。4组间肺损伤病理评分比较差异有统计学意义(F=190.937,P=0.000),VS组、VO组和SC组评分升高,大于SS组(t=10.855、29.602和23.847,P=0.000),VS组、VO组和SC组评分比较,差异有统计学意义(F=41.583,P=0.000),SC组评分低于VO组(t=-4.676,P=0.002),高于VS组(t=4.981,P=0.001)。见表2。
表2 4组大鼠肺损伤评分比较(n=5,±s)

表2 4组大鼠肺损伤评分比较(n=5,±s)
注:1)与VS组比较,P<0.05;2)与VO组比较,P<0.05;3)与SC组比较,P<0.05
组别 肺损伤评分VS组 5.2±0.8 VO组 8.7±0.41)SC组 7.3±0.51)2)SS组 0.7±0.41)2)3)F值 190.937 P值 0.000
2.3 OI变化
重复测量的方差分析表明,不同时间点OI跟分组变量间存在交互效应(P<0.05),不同时间点间OI比较差异有统计学意义(P<0.05),不同分组间比较差异有统计学意义(P<0.05)。组内比较,各时间点SS组OI无显著变化(P>0.05),T2和T6时VS组、VO组和SC组OI均下降(tVS=-3.461和-4.544,PVS=0.026和0.010;tVO=-12.018和-14.613,PPVO=0.000;tSC=-8.253和-9.843,PSC=0.001)。T0时4组间OI比较差异无统计学意义(P>0.05);T2和T6时4组OI比较差异有统计学意义(F=8.424和61.367,P=0.001和0.000);T2和T6时,VS组、VO组和SC组OI均低于SS组(tVS=-2.842和-4.699,PVS=0.022和0.002;tVO=-6.135和-13.018,PVO=0.000;tSC=-8.390和-12.885,PSC=0.000),T2时VS组、VO组和SC组OI比较差异无统计学意义(F=0.346,P=0.714),T6时3组间OI比较差异有统计学意义(F=23.315,P=0.000),VS组OI高于VO组和SC组(t=5.516和4.939,P=0.000 和0.001)。见表3。
2.4 血浆IL-6和TNF-α浓度变化
重复测量的方差分析表明,不同时间点IL-6和TNF-α浓度跟分组变量间存在交互效应(P<0.05),不同时间点IL-6和TNF-α浓度比较差异有统计学意义(P<0.05),不同分组间IL-6和TNF-α浓度比较差异有统计学意义(P<0.05)。组内比较,各时间点SS组IL-6和TNF-α浓度无显著变化(P>0.05);而VS组、VO组和SC组T1~T6时段IL-6浓度比较,差异有统计学学意义(tVS=6.687、5.924、11.610、9.693、3.520和2.850,PVS=0.003、0.004、0.000、0.024、0.001和0.046;tVO=5.370、22.209、22.680、8.410、29.391 和38.112,PVO=0.006、0.000、0.000、0.001、0.000和0.000;tSC=5.264、15.499、9.235、12.256、19.991和14.580,PSC=0.006、0.000、0.001、0.000、0.000和0.000),各时段IL-6浓度升高。T2~T6时段VS组、VO组和SC组TNF-α浓度比较,差异有统计学学意义(tVS=23.953、20.973、37.061、14.554和13.760,tVO=24.936、64.588、25.630、60.973和20.762,tSC=17.972、14.015、24.138、36.318和26.652,P=0.000),T1~T6时段TNF-α浓度升高。T1~T6时段4组间IL-6浓度比较差异有统计学意义(F=17.810、51.155、63.959、111.718、139.978、和501.138,P=0.000),VS组、VO组和SC组均高于SS组(tVS=7.661、7.846、7.854、9.061、3.960和4.963,PVS=0.000、0.000、0.000、0.000、0.004和0.001;tVO=5.048、16.113、14.946、20.409、16.160和35.217,PVO=0.001、0.000、0.000、0.000、0.000和0.000;tSC=6.208、10.679、8.862、13.720、18.140和19.336,PSC=0.000)。T2~T6时段4组间TNF-α浓度比较差异有统计学意义(F=108.470、139.927、283.934、581.382和174.060,P=0.000),T2~T6时段VS组、VO组和SC组均高于SS组(tVS=14.910、14.472、20.407、14.256和11.183,tVO=14.592、29.335、24.666、37.373和16.806,tSC=12.375、10.597、20.421、27.559和19.165,P=0.000)。T4~T6时段VS组、VO组和SC组IL-6和TNF-α浓度比较,差异有统计学意义(FIL-6=36.907、100.400和488.628,FTNF-α=127.224、336.325和100.004,P=0.000),T4~T6时段SC组IL-6和TNF-α浓度均高于VS组(tIL-6=5.655、10.836和13.167,tTNF-α=8.441、16.761和11.888,P=0.000),低于VO组(tIL-6=-2.659、-5.257和-19.868,PIL-6=0.046、0.000和0.000;tTNF-α=-7.992、-9.058和-6.637,PTNF-α=0.000)。见表4。
2.5 肺组织NF-κB含量变化
VS组、VO组、SC组和SS组大鼠肺组织NF-κB含量分别为(665.2±19.1)、(978.8±17.0)、(890.6± 81.2)和(406.4±17.3)ng/g,4组间比较差异有统计学意义(F=173.502,P=0.000),VS组、VO组和SC组肺组织NF-κB含量高于SS组(t=22.489、55.958和13.037,P=0.000);VS组、SC组和VO组3组间比较差异有统计学意义(F=54.110,P=0.000),SC组NF-κB含量高于VS组(t=6.040,P=0.000),低于VO组(t=-2.378,P=0.045)。
表3 4组大鼠动脉血气OI比较(n=5,mmHg,±s)
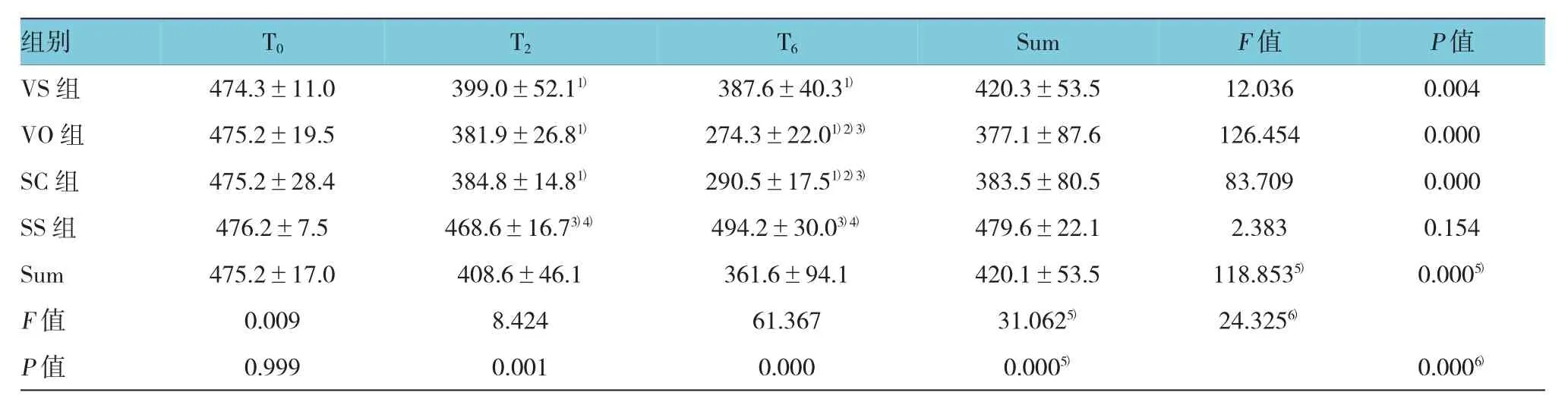
表3 4组大鼠动脉血气OI比较(n=5,mmHg,±s)
注:1)与T0比较,P<0.05;2)与T2比较,P<0.05;3)与VS组比较,P<0.05;4)与VO组和SC组比较,P<0.05;5)主效应的F值和P值;6)交互效应的F值和P值
组别 T0T2T6Sum F值 P值VS组 474.3±11.0 399.0±52.11)387.6±40.31)420.3±53.5 12.036 0.004 VO组 475.2±19.5 381.9±26.81)274.3±22.01)2)3)377.1±87.6 126.454 0.000 SC组 475.2±28.4 384.8±14.81)290.5±17.51)2)3)383.5±80.5 83.709 0.000 SS组 476.2±7.5 468.6±16.73)4)494.2±30.03)4)479.6±22.1 2.383 0.154 Sum 475.2±17.0 408.6±46.1 361.6±94.1 420.1±53.5 118.8535)0.0005)F值 0.009 8.424 61.367 31.0625)24.3256)P值 0.999 0.001 0.000 0.0005)0.0006)
表4 4组大鼠血浆IL-6和TNF-α浓度变化趋势(n=5,ng/L,±s)

表4 4组大鼠血浆IL-6和TNF-α浓度变化趋势(n=5,ng/L,±s)
注:1)与T0比较,P<0.05;2)与T1比较,P<0.05;3)与T2比较,P<0.05;4)与T3比较,P<0.05;5)与T4比较,P<0.05;6)与VS组比较,P<0.05;7)与VO组比较,P<0.05;8)与SC组比较,P<0.05;9)与T5比较,P<0.05;10)主效应的F值和P值;11)交互效应的F值和P值
组别 T0T1T2T3T4T5T6Sum F值 P值IL-6 VS组 5.1±0.1 5.5±0.11)5.7±0.21)5.8±0.11)2)5.8±0.21)2)5.4±0.21)3)4)5.3±0.11)3)4)5)5.5±0.1 19.628 0.000 VO组 5.1±0.1 5.4±0.11)5.8±0.11)2)6.4±0.11)2)5)6)6.7±0.11)2)4)5)6)6.7±0.21)2)3)5)6)6.8±0.11)2)3)4)5)6)6.1±0.4 268.782 0.000 SC组 5.1±0.1 5.5±0.11)5.9±0.21)2)6.3±0.31)2)5)6)6.4±0.21)2)5)6)7)6.2±0.11)2)5)6)7)6.0±0.11)2)3)4)6)7)5.9±0.2 59.295 0.000 SS组 5.1±0.2 5.0±0.16)7)8)5.0±0.16)7)8)5.1±0.26)7)8)5.0±0.16)7)8)5.1±0.16)7)8)5.1±0.16)7)8)5.1±0.1 0.287 0.938 Sum 5.1±0.1 5.4±0.2 5.6±0.4 5.9±0.6 6.0±0.7 5.9±0.7 5.8±0.7 5.3±0.1 136.09810)0.00010)F值 0.060 17.810 79.096 63.959 111.718 133.776 501.138 225.38510)39.59911)P值 0.980 0.000 0.000 0.000 0.000 0.000 0.000 0.00010)0.00011)TNF-α VS组 4.1±0.2 4.4±0.21)6.7±0.21)2)6.9±0.31)2)7.6±0.21)2)3)5)6.5±0.21)2)3)4)6.3±0.21)2)3)5)6.1±1.2 167.157 0.000 VO组 4.2±0.1 4.3±0.21)6.7±0.21)2)9.1±0.21)2)5)6)12.9±0.71)2)3)5)6)11.7±0.41)2)3)5)6)11.2±0.91)2)3)4)5)6)8.6±3.4 331.354 0.000 SC组 4.1±0.2 4.2±0.21)6.5±0.31)2)7.4±0.61)2)3)4)5)6)7)9.7±0.51)2)3)5)6)7)9.6±0.41)2)3)5)6)7)8.5±0.31)2)3)4)5)6)7)9)7.2±2.3 232.665 0.000 SS组 4.2±0.2 4.3±0.3 4.3±0.36)7)8)4.3±0.36)7)8)4.3±0.36)7)8)4.2±0.36)7)8)4.2±0.46)7)8)4.2±0.3 0.695 0.656 Sum 4.2±0.2 4.3±0.2 6.0±1.0 6.9±1.8 8.6±3.3 8.0±3.0 7.6±2.7 6.1±1.2 660.74610)0.00010)F值 0.066 0.813 108.470 139.927 283.934 581.382 174.060 373.86010)133.86511)P值 0.977 0.505 0.000 0.000 0.000 0.000 0.000 0.00010)0.00011)
3 讨论
本研究结果显示,VO组大鼠离断右侧迷走神经后进行容量复苏,肺部组织病变明显加重,肺间质水肿、炎症细胞浸润、肺泡出血,肺组织病理评分高于对照组,血气分析提示OI下降。而电刺激迷走神经兴奋CAP后,肺组织病变明显减轻,通气功能和换气功能显著改善,表明CAP具有一定的肺保护效应,提高CAP的兴奋性可以减轻失血性休克/容量复苏大鼠肺部的组织损伤,CAP神经反射通路受损可加重组织器官的损伤,导致组织结构和器官功能的双重损伤加重。
容量复苏前通过电刺激迷走神经提高CAP的兴奋性,可以明显降低体内IL-6和TNF-α等促炎细胞因子的表达水平;而离断单侧迷走神经后进行容量复苏,IL-6和TNF-α促炎细胞因子表达水平则显著上调。表明CAP释放信号可以调控炎症性细胞因子的活性。IL-6和TNF-α是最重要的促炎细胞因子之一,在炎症细胞因子网络系统中具有重要作用[8],可以启动炎症反应的瀑布式级联反应[9]。IL-6和TNF-α在循环和局部组织中的蓄积最直接的影响是促进白细胞的蓄积和血小板的活化,增加微血管的通透性,促进肺泡上皮细胞的凋亡,破坏肺泡上皮细胞的屏障功能,最终导致ALI的发生[10]。
通过刺激迷走神经、提高CAP的兴奋性,肺组织NF-κB含量明显降低;离断迷走神经阻断CAP的信号传导,肺组织内NF-κB含量明显增加,提示CAP在组织器官的保护效应以及对局部组织和全身性的炎症反应的调控作用中,可能存在NF-κB信号转导通路的作用机制。NF-κB是一种核蛋白因子,NF-κB信号通路是细胞因子网络系统最重要的信号转导通路之一,在机体炎症反应中发挥重要的调节作用[11-12]。NF-κB信号通路激活后可以介导一系列的细胞内信号转导机制,减少IL-6和TNF-α等多种促炎细胞因子的释放,从而发挥对局部或全身炎症的抑制作用和器官保护作用。
综上所述,CAP对HS/R大鼠ALI具有一定的保护效应,其机制可能与NF-κB信号通路调控IL-6 和TNF-α等炎症介质的释放有关。
参考文献:
[1]REILLY J P,BELLAMY S,SHASHATY M G,et al. Heterogeneous phenotypes of acute respiratory distress syndrome after major trauma[J]. Ann Am Thorac Soc,2014,11(5): 728-736.
[2]TRACEY K J. Physiology and immunology of the cholinergic antiinflammatory pathway[J]. J Clin Invest,2007,117(2): 289-296.
[3]黎笔熙,陶军,朱水波,等.盐酸戊乙奎醚对失血性休克大鼠急性肺损伤的影响[J].中华实验外科杂志,2014,31(11): 2486-2489.
[4]KLEMCKE H G,JOE B,CALDERON M L,et al. Genetic influences on survival time after severe hemorrhage in inbred rat strains[J]. Physiol Genomics,2011,43(12): 758-765.
[5]XANTHOS T T,BALKAMOU X A,STROUMPOULIS K I,et al. A model of hemorrhagic shock and acute lung injury in landrace-large white swine[J]. Comp Med,2011,61(2): 158-162.
[6]ELIA N,TAPPONNIER M,MATTHAY M A,et al. Functional identification of the alveolar edema reabsorption activity of murine tumor necrosis factor-alpha[J]. Am J Respir Crit Care Med,2003,168(9): 1043-1050.
[7]WERNER J,Z'GRAGGEN K,FERNANDEZ-DEL C C,et al. Specific therapy for local and systemic complications of acute pancreatitis with monoclonal antibodies against ICAM-1[J]. Ann Surg,1999,229(6): 834-842.
[8]TUNCEROGLU H,SHAH A,PORHOMAYON J,et al. Biomarkers of lung injury in critical care medicine: past,present,and future[J]. Immunol Invest,2013,42(3): 247-261.
[9]吴炜景,李理,徐采云,等. NF-κB结合元件缺失对NOX1启动子转录活性的影响[J].中国病理生理杂志,2014,30(10):1306-1729. [10]MONAHAN L J. Acute respiratory distress syndrome[J]. Curr Probl Pediatr Adolesc Health Care,2013,43(10): 278-284.
[11]CHEN H I. Acute lung injury and acute respiratory distress syndrome: experimental and clinical investigations[J]. J Geriatr Cardiol,2011,8(1): 44-54.
[12]WESSLER I,MICHEL-SCHMIDT R,BROCHHAUSEN C,et al. Subcellular distribution of choline acetyltransferase by immunogold electron microscopy in non-neuronal cells: placenta,airways and murine embryonic stem cells[J]. Life Sci,2012,91(21/22): 977-980.
(申海菊编辑)
Effects of cholinergic antiinflammatory pathway on acute lung injury induced by hemorrhagic shock and resuscitation in rats*
Xiao-yang Song,Bi-xi Li,Jun Tao,Xiang Zhou,Ming-zhe Qin,Yan Tan,Gui-lin Yin
(Wuhan General Hospital of Guangzhou Military Command,Wuhan,Hubei 430070,China)
Abstract:Objective To evaluate the contributions of cholinergic antiinflammatory pathway(CAP)on acute lung injury(ALI)induced by hemorrhagic shock and resuscitation(HS/R)in rats. Methods Twenty SFP adult male Sprague-Dawley rats were randomly divided into four groups(5 in each group):vagal-stimulation group (group VS),vagal-transection group(group VO),control group(group SC)and sham-operation group(group SS). In the groups VS,VO and SC,bloodletting was performed in the rats for hemorrhagic shock and maintained for 60 min,then resuscitation was done with autoblood and normal saline. ALI rat models followed hemorrhagic-shock/resuscitation(HS/R)were established in the groups VS,VO and SC. The rats in the group VS received electric stimuli to right vagus nerve for 15 min before the onset of resuscitation,the rats in the group VO received vagotomy of right vagus trunk instead before the onset of resuscitation,and the rats in thegroup SC received no additional treatments. The rats in the group SS experienced no HS/R for ALI. Blood samples were collected via the carotid artery to monitor plasma concentrations of IL-6 and TNF-α before bleeding(T0),5 minutes after MAP reached target value(T1),before resuscitation of shock(T2),5 min(T3),30 min(T4),1.5 h(T5)and 2.5 h(T6)after resuscitation. Arterial blood gas analyses were detected and oxygenation index(OI)was calculated at T0,T2and T6. The lungs were harvested for both measurement of NF-κB level and observation of pathological changes of lungs at T6. Results The plasma IL-6 and TNF-α levels were significant increased in the groups VS,VO and SC from T1to T6(P<0.05)and were higher than the corresponding ones in the group SS(P<0.05). IL-6 and TNF-α levels in the group SC were notably higher than those in the group VS but lower than those in the group VO from T3to T6(P<0.05). At T6,the OI in the groups VS,VO and SC were decreased and obviously lower than that in the group SS(P<0.05),and there was no significant difference in OI between the groups VO and SC(P>0.05);but the values of OI in the groups VO and SC were significantly lower than that in the group VS(P<0.05). The content of lung NF-κB raised in the groups VS and VO and SC and exceeded that in the group SS(P<0.05). There were obvious differences in the content of lung NF-κB among the groups VS,VO and SC(P<0.05);the content of lung NF-κB in the group SC was significantly higher than that in the group VS(P<0.05),but significantly lower than that in the group VO(P<0.05). The histologic scores of lung injury in the groups VS,VO and SC were higher than those in the group SS(P<0.05),and the scores in the group SC were higher than those in the group VS(P<0.05)but lower than those in the group VO(P<0.05). Conclusions The CAP has potential protective effects against ALI induced by HS/R,and its mechanisms are relevant to the regulation of the production of IL-6 and TNF-α by NF-κB signal way in lungs.
Keywords:hemorrhagic shock;resuscitation;lung injury;cholinergic antiinflammatory pathway;inflammatory cytokine
中图分类号:R459.7;R605.97
文献标识码:A
DOI:10.3969/j.issn.1005-8982.2016.11.003
文章编号:1005-8982(2016)011-0012-06
收稿日期:2015-12-09
*基金项目:湖北省卫生计生委科研基金(No:WJ2015MB117);全军“十二五”医学科研资助项目(No:CWS11J019)
[通信作者]殷桂林,E-mail:ying11952@163.com

