红香芋试管球茎膨大过程中主要碳水化合物含量以及淀粉合成相关酶活性的动态研究
臧玉文,蒋芳玲,程雅琪,孔祥宇,吴 震
(南京农业大学 园艺学院,南京 210095)
红香芋试管球茎膨大过程中主要碳水化合物含量以及淀粉合成相关酶活性的动态研究
臧玉文,蒋芳玲,程雅琪,孔祥宇,吴震
(南京农业大学 园艺学院,南京 210095)
摘要:为了探讨芋(Colocasia esculenta (L.) Schott)试管球茎膨大期间糖类物质积累特点,以红香芋无菌试管苗为材料,研究了高浓度蔗糖诱导条件下,红香芋试管球茎形成及膨大过程中主要碳水化合物的变化规律,以及与相关酶活性的关系。结果表明:(1)在红香芋试管球茎膨大过程中,果糖、葡萄糖和总可溶性糖含量均呈先升高后降低的变化趋势,果糖含量在诱导至第27 天时达到最大值,而总可溶性糖和葡萄糖含量均在第34 天达到峰值;蔗糖含量呈现先上升、后下降、再上升的变化趋势,在培养第48 天时积累量达到最大值。(2)红香芋试管球茎总淀粉含量、直链和支链淀粉含量均随培养时间的延长而增加,至膨大后期总淀粉含量达到最大值,淀粉总含量约占干重的76%,并以支链淀粉含量为主。(3)解剖学观察发现,随着试管球茎的形成与膨大,贮藏组织中淀粉粒密度不断增大,至球茎膨大后期,淀粉粒布满薄壁细胞,并且处于比较稳定的水平。(4)诱导培养至第41 天时,试管球茎的ADPG焦磷酸化酶和Q-酶活性均达到最大值,分别为1.22 和2.39 μmol·g-1·min-1。相关性分析发现,从茎基部开始膨大(20 d)至ADPG焦磷酸化酶和Q-酶活性达峰值(41 d)时,ADPG焦磷酸化酶活性与总淀粉含量、Q-酶活性与支链淀粉含量的相关系数分别为0.819和0.738,二者均呈极显著正相关。研究认为,淀粉的积累以及可溶性糖类含量的变化与红香芋试管球茎的膨大发育密切相关,并受到相关酶的调控。
关键词:芋;试管球茎;碳水化合物;ADPG焦磷酸化酶;Q-酶
芋(Colocasiaesculenta(L.) Schott)利用地下球茎进行无性繁殖。球茎属于变态器官,含有丰富的淀粉、蛋白质等储藏物质,其形成与发育由物种自身遗传因子控制,并且在很大程度上受到营养水平、内源激素和生存环境等条件的影响[1]。作为植物变态器官形态建成的主要物质,淀粉和可溶性糖类等为其发育提供重要的物质、能量和营养来源[2]。研究芋试管球茎的膨大过程,探讨主要碳水化合物的积累特点,对调控球茎的生长发育具有重要意义。
营养繁殖器官的形成是一个复杂的生理过程,涉及多种物质的代谢及酶活性变化。前人已对莲藕[3]、唐菖蒲[4]、茭白[5]等多种植物繁殖器官的形成进行了研究,但大多为自然生长条件下的膨大过程,有关植物试管器官发生和发育过程的研究还较少[6-8]。张延龙等[6]研究了卷丹试管鳞茎发育过程中主要糖类含量和相关酶活性的变化情况,发现在试管鳞茎膨大的前期,可溶性糖含量持续上升,进入膨大后期可溶性糖含量下降,淀粉含量上升,而淀粉酶活性总体表现出下降趋势。唐绪飞等[7],发现,在微型薯开始膨大时,没有淀粉的积累,随着诱导时间的延长,淀粉粒数量增加,集中分布在块根的薄壁细胞中。
在离体条件下,芋试管苗形成的球茎可作为芋种质资源离体保存的材料,故试管球茎的诱导也是一种种质资源离体保存的方法。目前,已有学者研究了芋球茎在离体条件下的诱导方法[9-10],但有关试管球茎膨大期间的生理生化变化的研究却鲜有报道。本试验以优良多子芋地方品种红香芋无菌试管苗为材料,利用高糖培养基诱导试管球茎的形成,测定红香芋试管球茎膨大发育过程中总可溶性糖、蔗糖、淀粉等主要碳水化合物的变化特点及淀粉合成相关酶活性的变化,从碳水化合物积累的角度探讨红香芋试管球茎膨大的机理,为芋试管球茎诱导提供理论依据。
1材料和方法
1.1植物材料及其培养
试验在南京农业大学园艺学院组培室进行,供试芋品种为建昌红香芋,是江苏省金坛市的优良地方品种,在园艺学院保存。选择顶芽饱满、未感病的球茎,割取顶芽,剥掉最外层芽鳞片,流水冲洗30 min;在超净工作台上利用75%的乙醇表面消毒30 s,无菌水冲洗2次,然后再用1%的次氯酸钠消毒12 min,期间不断搅拌;再用无菌水冲洗5次,放在无菌滤纸上吸干水分。外植体的消毒过程完成后,切取0.5 cm的茎尖接种在含2 mg·L-16-BA+0.2 mg·L-1NAA+30 g·L-1蔗糖+6.5 g·L-1琼脂的MS培养基上,培养50 d,长成带有2~3片叶的小植株,再转接到含1 mg·L-16-BA+0.1 mg·L-1NAA+30 g·L-1蔗糖+6.5 g·L-1琼脂的MS培养基上进行继代培养。
1.2试验设计和处理
选择继代培养20 d的生长良好、株高约4 cm的试管苗,转接在利于试管球茎形成的培养基中,经前期筛选所得:MS+0.2 mg·L-1TDZ+0.1 mg·L-1NAA+60 g·L-1蔗糖+6.5 g·L-1琼脂,pH 5.8。培养至20 d,红香芋植株基部开始膨大,进行第1次取样。之后每7 d取1次样,剥去试管苗根系、叶片及叶柄等附着物,获得红香芋试管球茎。用于测定酶活性的试管球茎经液氮速冻10 min后,保存在-80 ℃冰箱备用;另外的试管球茎放置烘箱,105 ℃下杀青20 min,然后在60 ℃下烘至恒重,制成干样,用于主要碳水化合物含量的测定;将试管球茎样品制成石蜡切片,以便观察淀粉粒。
1.3测定指标和方法
1.3.1主要碳水化合物含量采用蒽酮硫酸法测定总可溶性糖含量;采用间苯二酚法测定蔗糖和果糖含量;采用葡萄糖氧化酶法测定葡萄糖含量[11];采用蒽酮硫酸法测定淀粉总量[12],采用碘蓝比色法测定直链淀粉含量,支链淀粉含量=淀粉总量-直链淀粉含量[13]。
1.3.2酶活性参照Nakamura等[14-15]的方法测定ADPG-焦磷酸化酶和Q-酶活性。
1.3.3淀粉粒的观察采用PAS(高碘酸-锡夫反应法)染色淀粉粒[6],将芋试管球茎浸入FAA固定,经常规脱水、透明、石蜡包埋、切片、粘片、展片等一系列操作制成石蜡切片,脱蜡复水,蒸馏水洗、0.5%高碘酸水溶液10 min、蒸馏水洗5 min、锡夫试剂25 min、2次漂洗液各2 min、自来水5 min、蒸馏水2 min,后经系列酒精脱水透明再用中性树胶封片。利用Leica-DM2500显微镜观察并拍照。
1.4数据处理与统计分析
所有数据的测定均重复3次,结果取平均值。利用Microsoft Excel 2003和SPSS16.0进行数据处理与分析。
2结果与分析
2.1试管球茎形成过程中可溶性糖含量的变化
在红香芋试管球茎的形成与膨大过程中,总可溶性糖、蔗糖、果糖及葡萄糖含量均有明显的变化(图1)。其中,总可溶性糖、果糖、葡萄糖含量呈现先升高后降低的变化趋势,而蔗糖含量呈现先上升后下降再上升的变化趋势。试管球茎中果糖最高含量出现得较早,在诱导培养至27 d时即达到最大值;到膨大后期(48 d),其含量显著低于膨大始期(20 d)。总可溶性糖和葡萄糖含量在诱导34 d时达到最大值,按干重计算,含糖量分别达到5.19%、1.94%。随着球茎诱导时间的延长,葡萄糖含量显著降低,至诱导培养48 d时,降到最低值(0.58%)。试管球茎膨大前期蔗糖含量持续增加,在诱导34 d时含量达到2.08%,随后下降至1.56%,至膨大后期(48 d)又上升至最高(2.30%)。
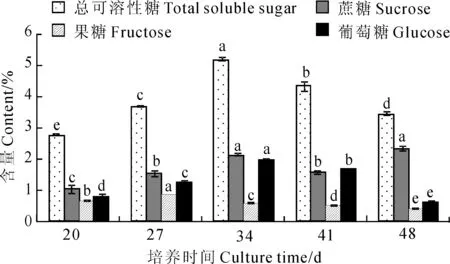
图中不同字母表示在0.05水平上差异显著;下同图1 红香芋试管球茎膨大过程中总可溶性糖、蔗糖、果糖、葡萄糖含量的变化Different letters in the figure meant significant difference at 0.05 level among culture time; The same as belowFig.1 Changes of total soluble sugar, sucrose, fructose and glucose contents during ‘Hongxiangyu’ microcorm development
2.2红香芋试管球茎总淀粉、直链淀粉、支链淀粉含量的变化
从图2中可以看出,在红香芋试管球茎膨大始期(20 d),总淀粉含量最低,仅占干重的46.41%;培养至41 d时,淀粉积累速率加快,总淀粉含量达到膨大始期(20 d)的1.5倍;至膨大后期(48 d),总淀粉含量维持在76%并基本保持不变。直链淀粉在球茎膨大始期含量很低,仅占干重的2.66%,随培养时间延长呈增加的趋势,至球茎膨大后期,直链淀粉含量为干重的13.71%,约占总淀粉含量的18%。支链淀粉含量与总淀粉含量变化趋势相似,在膨大始期含量较少,膨大中期(41 d)为快速积累期,含量大幅度提高,达到61.44%,到膨大后期支链淀粉积累减少,含量占总淀粉含量的82%。在不同发育时期,试管球茎直链淀粉含量差异显著,而淀粉总量和支链淀粉含量在膨大中期(41 d)均显著高于前期(20~34 d),而与膨大后期无显著差异。
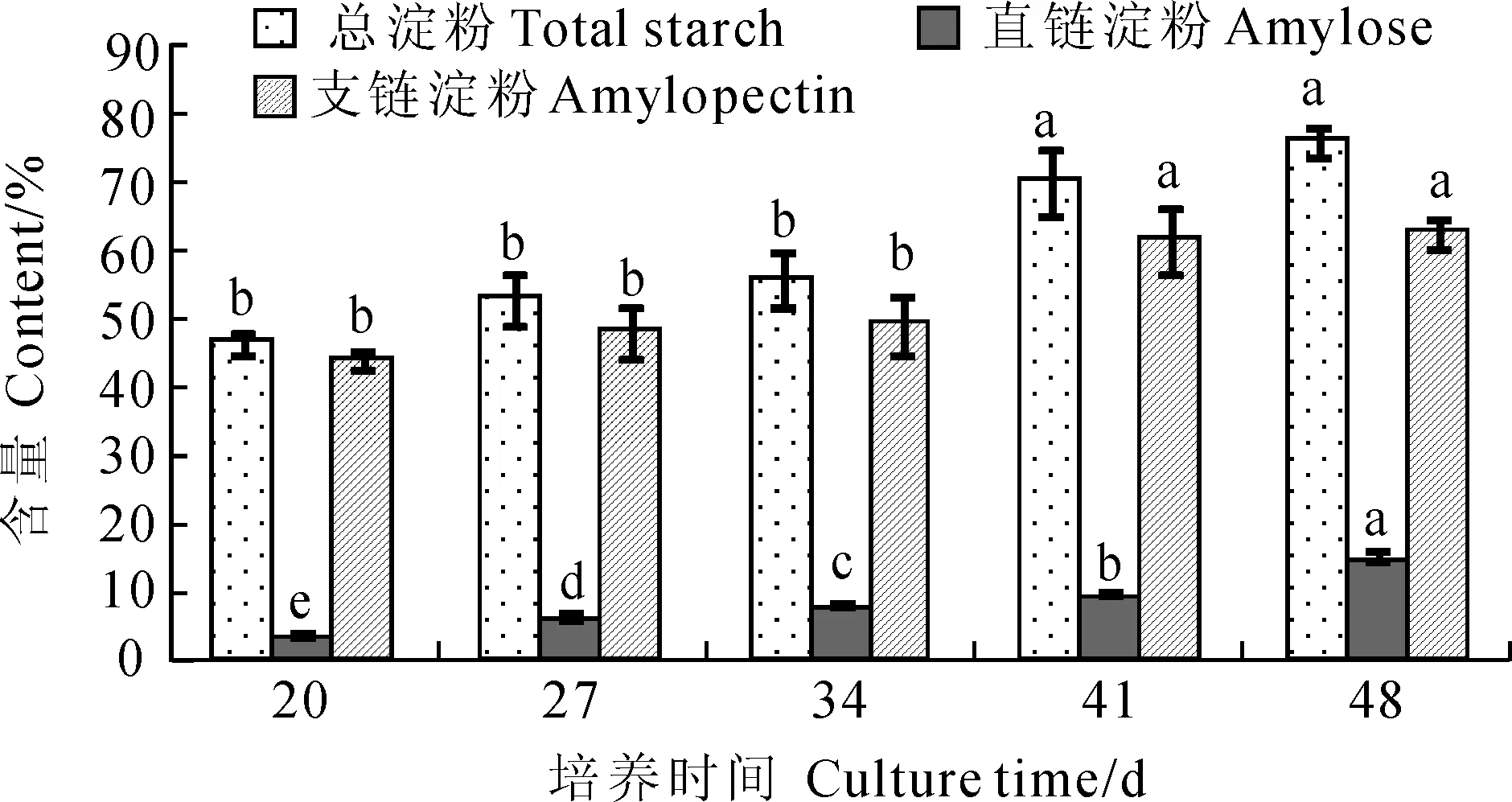
图2 红香芋试管球茎膨大过程中总淀粉、直链淀粉、支链淀粉含量的变化Fig.2 Changes of total starch, amylose and amylopectin contents during ‘Hongxiangyu’ microcorm development
2.3红香芋试管球茎ADPG焦磷酸化酶和Q-酶活性的变化
由图3可知,在芋试管球茎膨大的过程中,ADPG焦磷酸化酶和Q-酶活性均呈先上升后下降的变化趋势。在球茎膨大始期(20 d),ADPG焦磷酸化酶和Q-酶活性都处于较低的水平,分别是0.31和0.38 μmol·g-1·min-1;培养至41 d时,ADPG焦磷酸化酶和Q-酶活性均达到最大值,分别为1.22和2.39 μmol·g-1·min-1;至球茎膨大后期(48 d),ADPG焦磷酸化酶和Q-酶活性迅速降低,仅分别为0.44和0.59 μmol·g-1·min-1。
对ADPG焦磷酸化酶活性和总淀粉含量、Q-酶活性和支链淀粉含量两组变量分别进行相关性分析发现,从试管球茎膨大始期(20 d)至ADPG焦磷酸化酶和Q-酶酶活性达峰值(41 d)时,相关系数分别为0.819(P<0.01,n=12)和0.738(P<0.01,n=12),均呈极显著正相关(表1)。说明ADPG焦磷酸化酶和Q-酶活性显著影响总淀粉和支链淀粉的合成速率及积累。
2.4红香芋试管球茎淀粉粒的显微观察
试管球茎形成过程中球茎淀粉粒变化见图4。图中紫红色的颗粒为经染色的芋试管球茎中的淀粉粒。在红香芋叶柄基部未膨大的假茎段中,淀粉粒非常稀少(图4,A)。在叶基部膨大始期(20 d),淀粉粒主要出现在维管束周围的薄壁细胞中(图4,B)。随着培养时间的延长,试管球茎开始形成并增大,淀粉粒密度增加,颜色变深,说明有大量淀粉粒积累。至球茎膨大中期与后期,淀粉粒大量积累在储藏细胞,其积累部位从中心微管组织延伸至周围皮层中的薄壁细胞(图4,C~E)。从图4,F中可以看到,芋球茎中淀粉粒的形态主要为复粒,单粒淀粉含量很少。
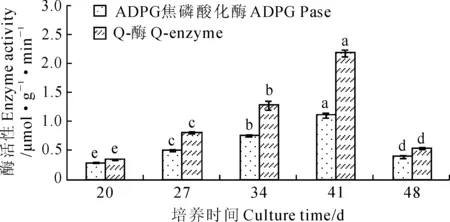
图3 红香芋试管球茎膨大过程中ADPG焦磷酸化酶和Q-酶活性的变化Fig.3 Changes in activities of ADPGPase and Q-enzyme during ‘Hongxiangyu’ microcorm development

表1 淀粉含量与相关酶活性之间的相关系数Table 1 Correlation coefficient between starch content and lelated enzyme activity
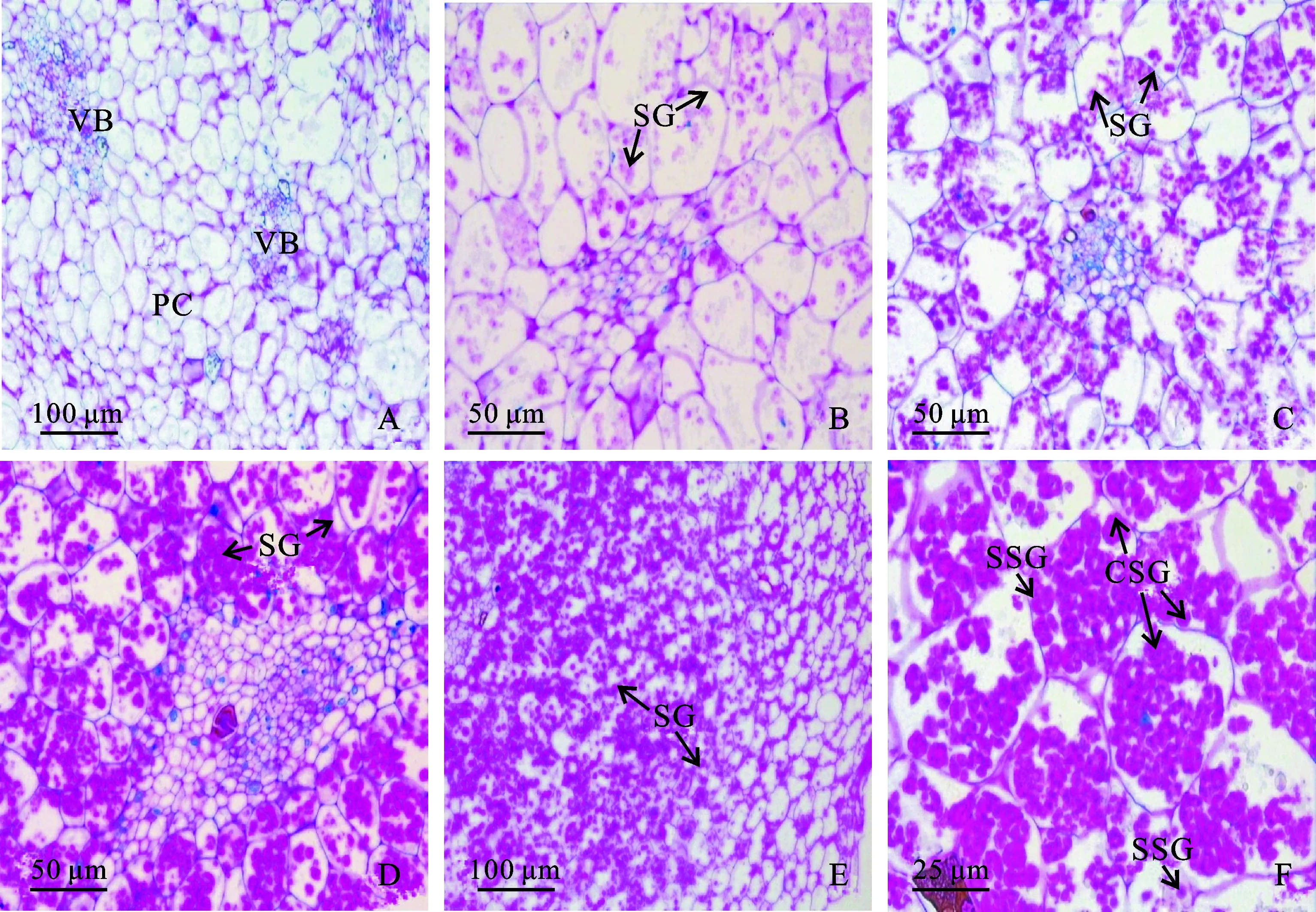
A.未膨大时叶柄基部茎段(10×);B.膨大始期(20×);C.膨大前期(20×);D.膨大中期(20×) ;E.膨大后期(10×);F.淀粉粒形态(40×) ;VB.维管束;PC.薄壁细胞;SG.淀粉粒;CSG.复粒淀粉粒;SSG.单粒淀粉粒图4 红香芋试管球茎膨大过程中淀粉粒的变化A.The petioles basal stem segment (10×); B.The beginning stage of taro corms development (20×); C.The early stage of taro corms development (20×); D.The middle stage of taro corms development (20×); E.The end stage of taro corms development (10×); F.The morphology of starch grain (40×); VB. Vascular bundle; PC. Parenchyma cell; SG. Starch grain; CSG. Compound starch grain; SSG. Single starch grainFig.4 Changes of starch granule during ‘Hongxiangyu’ microcorm development
3讨论
芋在后期的营养生长阶段,进行光合作用的叶片逐渐枯萎,以变态茎为“库”进行养分的积累,形成作为贮藏器官和繁殖器官的球茎。相关研究表明,山药块茎、木薯块根、莲藕根状茎等贮藏器官的形态建成与碳水化合物的代谢密切相关。本研究中发现,在红香芋试管球茎形成过程中,球茎的淀粉和可溶性糖含量变化也表现出一定的规律性。
本研究发现,在红香芋试管球茎膨大始期,可溶性糖类含量较低,因为此时叶片光合作用产生的糖类主要维持植株的生长,而向下运输的较少,故芋假茎的薄壁细胞中淀粉粒稀少。至膨大前期,蔗糖不断从叶片运输到球茎中,可溶性糖含量上升,为其形态建成提供物质与能量基础,淀粉含量也缓慢增加。至膨大中、后期,球茎形态基本建成,糖类物质主要用于合成淀粉并贮藏在球茎中,因此,可溶性糖含量降低,而淀粉快速积累,至膨大后期达到最大值。随球茎的膨大,淀粉粒密度逐渐增加,至膨大后期布满薄壁细胞。梁任繁等[16]发现在山药块茎发育过程中,可溶性糖积累方式呈单峰曲线变化,即在膨大前期含量不断增加,中期达到峰值后下降。杨鑫等[17]对高低淀粉两个木薯品种进行研究,发现两者的块根淀粉含量变化趋势基本一致,均随膨大发育时间的积累而持续增加,在块根膨大后期淀粉含量达到最大值。康利平等[18]对地笋根状茎的研究也出现了类似结果。说明淀粉及可溶性糖在植物不同的贮藏性变态器官中的变化具有相似性,试管器官虽然是在特殊的离体培养条件下诱导形成,但其与在自然条件下形成的贮藏器官碳水化合物积累有相同的变化规律。
直链淀粉和支链淀粉的代谢直接影响着球茎中总淀粉含量,两者的比例影响淀粉的诸多性质[19]。李良俊等[3]研究发现,随着莲藕根状茎的形态建成,膨大茎中支链淀粉含量不断增加,始终约占总淀粉含量的70%。本研究中红香芋试管球茎的支链淀粉含量也远远大于直链淀粉,其变化趋势与总淀粉含量保持一致,在膨大后期占总淀粉含量的82%。说明在试管球茎膨大过程中,总淀粉积累规律以支链淀粉的积累为主,这与姜瑞敏等[20]对自然条件下生长的芋球茎的测定结果相近,其支链淀粉占总含量的86%。说明芋球茎在离体诱导条件下与在自然条件下形成淀粉的积累特点相同。因此,本研究从红香芋试管球茎形成过程中得出的碳水化合物变化规律,在一定程度上可以反映在自然条件下芋球茎的形成过程。
在植物体内,淀粉合成代谢受到多种酶的调控,ADP-葡萄糖焦磷酸化酶是调控淀粉合成的关键酶之一,淀粉分支酶(Q-酶)是支链淀粉合成的关键酶[21-22]。吴沙沙等[23]发现百合鳞茎从栽种期到形成新鳞茎的过程中,当鳞茎作为“源”提供能量时,淀粉被分解,含量降低,ADPG焦磷酸化酶活性也呈现出下降趋势;当鳞茎作为“库”贮藏能量时,淀粉积累量和ADPG焦磷酸化酶活性均升高。在本研究中,淀粉合成相关酶活性随着红香芋试管球茎发育进程而改变,进而影响淀粉的积累速率。在试管球茎膨大初期,ADPG焦磷酸化酶和Q-酶活性均较低,总淀粉和支链淀粉合成较少。诱导培养至膨大中期的过程,ADPG焦磷酸化酶和Q-酶活性均持续上升,并达到最高,使总淀粉和支链淀粉含量在膨大中期快速积累。虽然在球茎膨大后期两个酶活性都大幅度下降,但仍起到一定的催化作用,即淀粉总量和支链淀粉含量在培养至48 d时仍有小幅度的增加。说明ADPG焦磷酸化酶和Q-酶的酶活性表达均存在时段性,且直接影响着总淀粉和支链淀粉合成的速率和积累量。
综上所述,在红香芋试管球茎膨大始期,可溶性糖类含量增加,为球茎的前期发生提供物质和能量基础,而淀粉合成较少。至球茎膨大中期,ADP-葡萄糖焦磷酸化酶和Q-酶活性达到最大值,促进淀粉合成,从而可溶性糖含量减少,试管球茎中淀粉积累量显著增加,且主要以支链淀粉为主。解剖学观察发现,随着试管球茎的形成与膨大,贮藏组织中淀粉粒密度不断增大,至球茎膨大后期,淀粉粒布满薄壁细胞,即总淀粉含量达到最大值,并处于比较稳定的水平。
参考文献:
[1]FERNIE A R,WILLMITZER L.Molecular and biochemical triggers of potato tuber development[J].PlantPhysiology,2001,127:1 459-1 465.
[2]孙玉燕,李锡香.蔬菜变态根茎发育的分子机理研究进展[J].中国农业科学,2015,48(6):1 162-1 176.
SUN Y Y,LI X X.A review on molecular mechanism of the modified roots or sterms development in vegetables[J].ScientiaAgricultureSinica,2015,48(6):1 162-1 176.
[3]李良俊,张晓冬,潘恩超,等.莲藕膨大过程中淀粉合成相关酶的活性变化及其与淀粉积累的关系[J].中国农业科学,2006,39(11):2 307-2 312.
LI L J,ZHANG X D,PAN E C,etal.Relationship of starch synthesis with it’s related enzymes’ activities during rhizome development of lotus(NelumbonuciferaGaertn)[J].ScientiaAgricultureSinica,2006,39(11):2 307-2 312.
[4]苑智华,何秀丽,徐哲,等.唐菖蒲球茎形成期蔗糖和淀粉代谢及其相关酶活性[J].林业科学,2008,44(8):47-51.
YUAN Z H,HE X L,XU Z,etal.Metabolism and related enzymes activities of sucrose and starch in the stages of bulb formation ofGladiolushybridus[J].ScientiaSilvaeSinicae,2008,44(8):47-51.
[5]江解增,曹碚生,黄凯丰,等.茭白肉质茎膨大过程中的糖代谢与激素含量变化[J].园艺学报,2005,32(1):134-137.
JIANG J Z,CAO P S,HUANG K F,etal.Changes of NSC,enzymes and endogenous hormones duringZizaniagallpsswelling[J].ActaHorticultureSinica,2005,32(1):134-137.
[6]张延龙,张启翔,薛晓娜.光周期对野生卷丹试管苗鳞茎形成及糖代谢的影响[J].园艺学报,2010,37(6):957-962.
ZHANG Y L,ZHANG Q X,XUE X N.The effects of the photoperiods on the bulblet formation and sugar metabolism change of wildLiliumlancifoliuminvitro[J].ActaHorticultureSinica,2010,37(6):957-962.
[7]唐绪飞,钏秀娟,刘秦,等.木薯试管微型薯与田间块根的结构发育比较[J].热带作物学报,2014,35(10):1 884-1 889.
TANG X F,CHUAN X J,LIU Q,etal.Structure development of cassva tuber root in field-grown andinvitro[J].ChineseJournalofTropicalCrops,2014,35(10):1 884-1 889.
[8]连勇,邹颖,东惠茹,等.马铃薯试管薯形成过程中几种内源激素的变化[J].园艺学报,2002,29(6):537-541.
LIAN Y,ZOU Y,DONG H R,etal.Changes of several endogenous hormones during process of potato microtuber formation[J].ActaHorticultureSinica, 2002,29(6):537-541.
[9]ZHOU S P,HE Y K,LI S J.Induction and characterization ofinvitro corms of diploid-taro[J].PlantCell,TissueandOrganCulture,1999,57:173-178.
[10]刘玉平,柯卫东,黄新芳,等.试管芋诱导的研究[J].园艺学报,2003,30(1):43-46.
LIU Y P,KE W D,HUANG X F,etal.Study on induction of taroinvitro[J].ActaHorticultureSinica,2003,30(1):43-46.
[11]汤章城.现代植物生理学试验指南[M].北京:科学出版社,1999.
[12]张志良.植物生理学实验指导[M].北京:高等教育出版社,2001.
[13]杨金华,毕晨光,宋文昌.半粒稻米直链淀粉测定方法的研究及应用[J].作物学报,1992,18(5):366-372.
YANG J H,BI C G,SONG W C.A half-grain method for analyzing the amylose content in rice grains and its application[J].ActaAgronomicaSinica,1992, 18(5):366-372.
[14]NAKAMURA Y,YUKI K.Changes in enzyme activities associated with carbohydrate metabolism during the development of rice endosperm[J].PlantScience, 1992,82(1):15-20.
[15]NAKAMURA Y,YUKI K,PARK S Y,etal.Carbohydrate meatoblism in the developing endosperm of rice grains[J].PlantCellPhysiology,1989,30(6):833-839.
[16]梁任繁,李创珍,张娟,等.山药块茎发育中物质积累及相关代谢酶变化[J].作物学报,2011,37(5):903-910.
LIANG R F,LI C Z,ZHANG J,etal.Changes of matter accumulation and relative enzymatic activity during Yam tuber development[J].ActaAgronomicaSinica,2011,37(5):903-910.
[17]杨鑫,罗兴录,覃宏宇.木薯内源激素含量与块根淀粉积累关系研究[J].中国农学通报,2013,29(33):158-164.
YANG X,LUO X L,QIN H Y,etal.Study on endogenous hormones content and its relations to tuberous root starch accumulation in cassava[J].ChineseAgricultureScienceBulletin,2013,29(33):158-164.
[18]康利平,靳博,云兴福,野生蔬菜-地笋根状茎膨大规律及其主要有机物积累的研究[J].干旱区资源与环境,2013,27(12):131-136.
KANG L P,JING B,YUN X F.Research on the expanding regulation and the changes of major organic matter in rhizome ofLycopuslucidusTurcz[J].JournalofAridLandResourcesandEnvironment,2013,27(12):131-136.
[19]张攀峰,陈玲,李晓玺.不同直链/支链比的玉米淀粉分子质量及其构象[J].食品科学,2010,31(19):157-160.
ZHANG P F,CHEN L,LI X X,etal.Molecular mass and conformation of corn starches with different amylose/amylopectin ratios[J].FoodScience, 2010,31(19):157-160.
[20]姜瑞敏,史美丽,陈玉珍,等.芋头淀粉性能及化学组成的研究[J].莱阳农学院学报,1998,15(2):128-131.
JIANG R M,SHI M L,CHEN Y Z,etal.Research on properties and chemicals composition of taro starch[J].JournalofLaiyangAgricultureCollege, 1998,15(2):128-131.
[21]PREISS J,BALL K,SMITH-WHITE B,etal.Starch biosynthesis and its regulation[J].BiochemicalSocietyTransactions,1991,(19):539-547.
[22]ZHAO B H,ZHANG W J,WANG Z Q,etal.Changes in activities of the key enzymes related to starch synthesis in rice grains during grain filling and their relationships with the filling rate and cooking quality[J].AgriculturalSciencesinChina,2005,4(1):26-33.
[23]吴沙沙,彭东辉,等.东方百合‘索邦’鳞茎源-库转化过程中碳水化合物代谢及相关酶活性变化[J].北京林业大学学报,2013,35(6):96-102.
WU S S,PENG D H,etal.Carbohydrate metabolism and activity variation of related enzymes during the exchanging role of bulb source and sink of oriental hybrid lily‘Sorbonne’[J].JournalofBeijingForestryUniversity,2013,35(6):96-102.
(编辑:潘新社)
Study on the Dynamic Changes of the Major Carbohydrate Content and the Related Enzyme Activities during the Microcorm Development ofColocasiaesculenta
ZANG Yuwen, JIANG Fangling, CHENG Yaqi, KONG Xiangyu,WU Zhen*
(College of Horticulture,Nanjing Agricultural University,Nanjing 210095,China)
Abstract:In order to investigate the characteristics of carbohydrate accumulation during the expansion stage of Colocasia esculenta (L.) Schott microcorm, with aseptic ‘Hongxiangyu’ plantlets as material, we studied the changes of the major carbohydrate content and the relevant enzymes activities as well as their correlation under high glucose concentration. The results showed that:(1) The contents of fructose, glucose and soluble sugar all increased firstly and then decreased during the development of microcorm. The fructose content of corms reached the maximum after 27 days induction, and the highest contents of total soluble sugar and glucose appeared on the 34th day. The sucrose content represented an up-down-up trend, peaking on the 48th day. (2) The contents of total starch, amylose and amylopectin increased with the incubation time. The total amount of starch reached the peak at late extension stage, accounting for about 76% of dry weight, and mainly was amylopectin. (3) Based on anatomical study, the starch granule density of storage tissue increased with the development of microcorm and covered the parenchyma cells in late stage. (4) Both of ADPGPase and Q-enzyme activities reached the maximum on the 41st day, with 1.22 and 2.39 μmol·g-1·min-1,respectively. By correlation analysis between ADPGPase activity and total starch content, Q-enzyme activity and amylopectin content, from shoots beginning to expand (20 d) to ADPGPase and Q-enzyme activity reaching the peak (41 d), the correlation coefficient were 0.819 and 0.738, showing a significant positive correlation. The research suggested that the accumulation of starch and soluble sugar content changes were closely related to the development of ‘Hongxiangyu’ microcorm, and were regulated by related enzymes.
Key words:Colocasia exculenta (L.) Schott; microcorm; carbohydrate; ADPGPase; Q-enzyme
文章编号:1000-4025(2016)04-0700-06
doi:10.7606/j.issn.1000-4025.2016.04.0700
收稿日期:2015-10-12;修改稿收到日期:2016-01-17
基金项目:江苏高校优势学科建设工程资助项目——现代园艺科学
作者简介:臧玉文(1989-),女,硕士研究生,主要从事蔬菜生理生态研究。Email: 18761866557@163.com *通信作者:吴震,教授,主要从事蔬菜生理生态的教学和科研工作。Email: zpzx@njau.edu.cn
中图分类号:Q945.3; Q813.1+2;
文献标志码:A

