钙调蛋白小亚基Capn4在鼻咽癌细胞中的表达及对CNE2细胞增殖的影响
王 丰, 郑 鸣, 郑培婵, 吴丽贤, 王 慧
(1福建中医药大学中西医结合学院,福州 350004; 2福建医科大学药学院药理系; *通讯作者,E-mail: zming_1956@163.com)
钙调蛋白小亚基Capn4在鼻咽癌细胞中的表达及对CNE2细胞增殖的影响
王丰1, 郑鸣2*, 郑培婵2, 吴丽贤2, 王慧2
(1福建中医药大学中西医结合学院,福州350004;2福建医科大学药学院药理系;*通讯作者,E-mail: zming_1956@163.com)
摘要:目的研究钙调蛋白小亚基Capn4在鼻咽癌病理组织及鼻咽癌细胞CNE2中的表达,并观察Capn4对顺铂作用后细胞增殖的改变。方法收集153例鼻咽癌组织及30例非癌鼻咽组织的石蜡标本,所有患者均未进行放化疗,免疫组化法检测Capn4在鼻咽癌组织及非鼻咽癌组织中的表达;选取鼻咽癌细胞CNE2与293T细胞在37 ℃、5%CO2条件下培养,Western blot法检测不同细胞中Capn4蛋白表达水平;构建shRNA下调Capn4表达的CNE2细胞并以Western blot法验证;MTT法检测顺铂作用下,shRNA下调Capn4的鼻咽癌细胞增殖改变。结果Capn4在鼻咽癌组织中的表达显著高于正常鼻咽组织(P<0.001),在鼻咽癌细胞系中表达明显高于293T细胞;shRNA确实下调Capn4在鼻咽癌细胞中的表达;DNA损伤药物顺铂作用下,下调Capn4表达的鼻咽癌细胞CNE2较之未下调的CNE2细胞增殖受抑制(P<0.05)结论Capn4在鼻咽癌组织和细胞中高表达,下调Capn4表达能抑制顺铂作用后的细胞增殖。
关键词:Capn4;鼻咽癌;顺铂;shRNA
鼻咽癌是起源于鼻咽上皮细胞的恶性肿瘤,在东南亚地区和中国南方有极高的发病率。钙调蛋白Calpain是Ca2+依赖的半胱氨酸蛋白水解酶家族。至今,Calpain在人类已鉴定14个家族成员,大部分成员与细胞黏附相关,参与细胞的伸展、迁移、增殖、细胞周期的的调控和凋亡等。Capn4(又称为CapnS1)是Calpain蛋白的一个小分子调节亚基,在调节Calpain的稳定性和活性中发挥着至关重要的作用[1]。最近的研究报道,Capn4在肝细胞癌、肝内胆管上皮细胞癌、结直肠癌和肾透明细胞癌中高表达,通过调节转录参与肿瘤的发生[2,3]。本研究拟探讨Capn4在鼻咽癌病理组织与细胞中的表达,构建shRNA以下调Capn4的表达,研究顺铂作用后细胞增殖的改变。
1材料与方法
1.1组织标本
收集福州总医院以及广州总医院1999-2010年切除的鼻咽癌组织及正常鼻咽组织石蜡标本,共计153例鼻咽癌组织及30例非癌鼻咽组织。所有标本均经病理学证实。鼻咽癌组织中,男性104例,女性49例,年龄29-83岁,中位年龄53岁,所有患者均未进行放化疗。
1.2细胞株和主要试剂
人鼻咽癌细胞CNE2购自中国科学院上海生命科学研究院细胞资源中心,人肾上皮细胞293T细胞购自我校细胞动物实验中心。兔抗人Capn4多克隆抗体购自LifeSpan公司,HRP标记的羊抗兔IgG抗体购自中杉生物公司。免疫组化试剂盒购自中杉生物公司。Hyclone RPMI 1640培养基和Hyclone胎牛血清均购于Thermo Scientific。顺铂由Hospira公司生产,每50 ml含顺铂50 mg。慢病毒质粒pGC-LV、包装质粒pHelper 1.0和pHelper 2.0购自上海吉凯基因化学技术有限公司。MTT[3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐]购置于美国Sigma公司,用磷酸盐缓冲液(PBS)稀释成5 g/L,存储液,小剂量分装,-20 ℃避光储存。
1.3免疫组织化学检测Capn4在鼻咽癌病理组织中的表达
按SP试剂盒说明书操作,取石蜡切片按程序脱蜡至水,3%H2O2孵育30 min,灭活内源性过氧化物酶活性;微波抗原修复,山羊血清封闭,加兔抗人Capn4多克隆抗体一抗,稀释度为1∶1 000;4 ℃冰箱过夜后加羊抗兔IgG二抗,加酶标记物,DAB 显色,光镜下观察;梯度乙醇脱水、封闭。阴性对照一抗滴加PBS,余相同。
依据已发表的文献判定标准,在显微镜下观察组织切片的染色轻度和染色细胞的比率;染色强度判定:无染色记为0,弱阳性记为1,中等阳性记为2,强阳性记为3;阳性细胞数比率判定:<1%记为0,1%-25%记为1,26%-50%记为2,51%-75%记为3,>75%记为4;再根据染色轻度的得分与阳性细胞比率的得分乘积判定各切片的染色结果:阴性(得分0-1),低表达(得分2-6),高表达(得分7-12)。
1.4细胞培养
CNE2细胞和293T细胞采用含0.1的胎牛血清RPMI1640,青霉素(100 000 IU/L)和链霉素(50 mg/L),在37 ℃、5%CO2孵育箱中培养,取对数生长期细胞用于实验。
1.5Western blot检测Capn4表达
细胞在37 ℃、5%CO2,条件下培养,细胞丰度达80%时提取细胞总蛋白。PBS清洗、胰酶消化、离心5 min,收集细胞。加入200 μl裂解液和1 μl蛋白酶抑制剂,室温混匀10 min,4 ℃,离心15 min,取上清液备用。利用Brandford方法测蛋白浓度。10%SDS凝胶电泳分析。电泳完毕后将胶上蛋白质转移至PVDF膜。PVDF膜经封闭液处理并在Tris缓冲盐(TBS)充分洗涤后,加入1∶1 000稀释的兔抗人Capn4抗体4 ℃杂交过夜。TBS洗膜数次后加入碱性磷酸酶标记的二抗溶液,4 ℃孵育1 h后,洗涤,曝光显色记录结果。同时检测β-肌动蛋白作为蛋白定量的内标。
1.6构建shRNA载体转染CNE2抑制Capn4表达
根据Genbank中Capn4基因已知序列按siRNA序列设计原则,应用Ambion公司网上在线设计工具设计,并将选出的siRNA序列进行BLAST搜索,作同源性分析以保证序列的特异性,最后确定3个区段。根据Capn4 cDNA序列构建表达Capn4 mRNA特异的,含绿色荧光蛋白基因(EGFP)的shRNA真核表达质粒CAPNS1-RNAi。CAPNS1-RNAi作用的三个靶序列分别为5′-CCACAGAACTCATGAACAT-3′(CAPNS1-RNAi89)、5′-AGGCCATATACAAACAGTT-3(′CAPNS1-RNAi90)及5′-ATGTTCCGTGCCTTCAAAT-3′(CAPNS1-RNAi91),阴性对照CON207作用的靶序列为5′-TTCTCCGAACGTGTCACGT-3′。利用包装质粒pHelper 1.0和pHelper 2.0转染CNE2细胞,并用Western blot法测Capn4的表达情况。
1.7MTT法检测顺铂对细胞的增殖抑制作用
取对数生长期的鼻咽癌细胞CNE2(阴性对照CON207载体转录作为对照组)和慢病毒下调Capn4表达的CNE2Capn4(-)(为实验组),按5×107/L接种于96孔培养板中,每孔180 μl。实验组对照组均分别加入不同浓度的药物20 μl,另设背景对照,每组设3个平行孔,37 ℃培养24 h。加入5 g/L的MTT溶液,每孔20 μl,继续培养4 h,离心弃上清,加入150 μl DMSO,微量振荡仪振荡10 min,立即用酶标仪在570 nm波长处测吸光度(OD值)。根据吸光度计算细胞生长抑制率IC50,细胞生长抑制率(%)=(对照组OD-实验组OD)/对照组OD×100%。以药物浓度为横轴,抑制率为纵轴绘制细胞增殖抑制量效关系曲线。
1.8统计学分析
2结果
2.1Capn4在鼻咽癌组织中的表达
为了验证Capn4在鼻咽癌组织中及正常鼻咽组织中的表达差异,收集了153例鼻咽癌和30例非癌鼻咽石蜡组织进行免疫组化检查分析,结果提示Capn4在鼻咽癌细胞中主要是定位于胞质,少数位于胞核中(见图1)。进一步分析发现Capn4在鼻咽癌组织与非癌组织中的表达差异具有统计学意义(P<0.001,见表1)。
2.2Capn4在鼻咽癌细胞CNE2中的表达
Western blot结果显示,Capn4在鼻咽癌细胞CNE2中表达量高于293T细胞,且差异有统计学意义(P<0.05,见图2)。
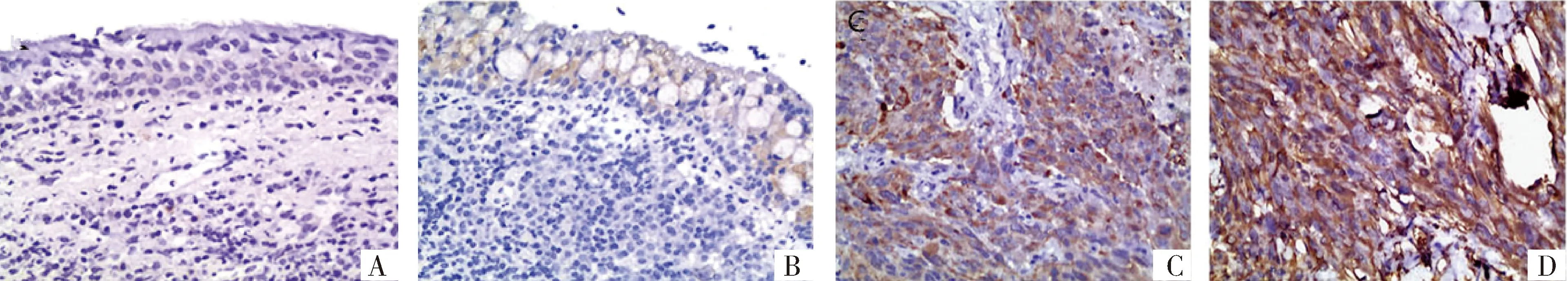
A.不表达的非癌鼻咽组织 B.低表达的非癌鼻咽组织 C.中表达的鼻咽癌组织 D.高表达的鼻咽癌组织 图1 免疫组化分析Capn4在非癌鼻咽组织及鼻咽癌组织中的表达 (20×20)Figure 1 Expression of Capn4 in human nasopharyngeal carcinoma tissues and non-tumor nasopharyngeal tissues by immunohistochemistry (20×20)
表1免疫组化检测Capn4在鼻咽癌组织及非癌鼻咽组织中的表达例(%)
Table 1Expression of Capn4 in nasopharyngeal carcinoma and non-tumor tissuescases(%)
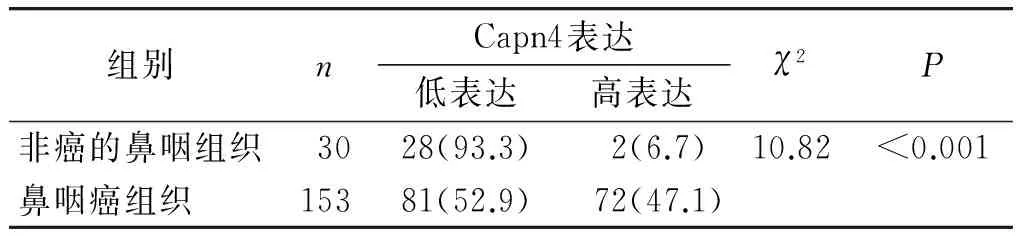
组别nCapn4表达低表达高表达χ2P非癌的鼻咽组织3028(93.3) 2(6.7)10.82<0.001鼻咽癌组织15381(52.9) 72(47.1)
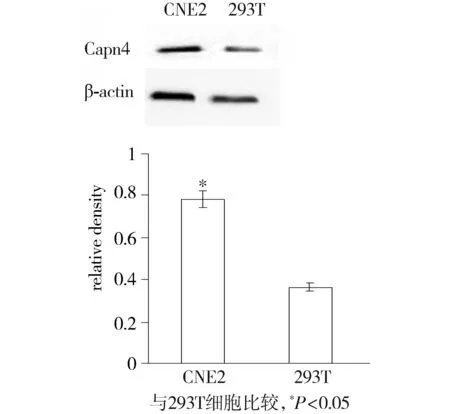
图2 Western blot分析Capn4在鼻咽癌细胞CNE2及293T细胞中表达Figure 2 Protein level of Capn4 in CNE2 cells and 293T cells by Western blot
2.3构建三株shRNA载体转染CNE2细胞下调Capn4表达并Western blot验证
三株shRNA载体(CAPNS1-RNAi90,CAPNS1-RNAi89,CAPNS1-RNAi91)构建成功并转染CNE2,均下调Capn4在CNE2中的表达,其中CAPNS1-RNAi89下调Capn4表达最显著,差异有统计学意义(P<0.01,见图3)。
2.4顺铂处理后细胞增殖改变
转入空载体(CON207)的CNE2与shRNA下调Capn4表达后的CNE2细胞共同运用不同浓度的顺铂处理48 h后,下调Capn4表达的CNE2细胞增殖明显受抑制(见图4),IC50值采用GraphPad Prism5软件进行方差分析,差异有统计学意义(P<0.05)。
3讨论
鼻咽癌是我国南方常见的恶性肿瘤。其发病原因与遗传易感性、种族背景、EB病毒感染、饮食习惯和环境等多种因素密切相关[4]。Calpain是Ca2+依赖半胱氨酸蛋白水解酶[5]。目前Calpain在鼻咽癌中的作用尚无文献报道,最近的研究报道Capn4在肝细胞癌和肝内胆管上皮细胞癌中高表达,而且Capn4表达程度与患者的预后密切相关。干扰Capn4的表达能够显著降低肝细胞癌和肝内胆管上皮细胞癌的细胞侵袭和迁移能力[6,7]。由此,推测Capn4在转移癌的细胞迁移和黏附中发挥一定的作用,其在鼻咽癌的发生发展过程中是否发挥类似的作用尚不清楚。
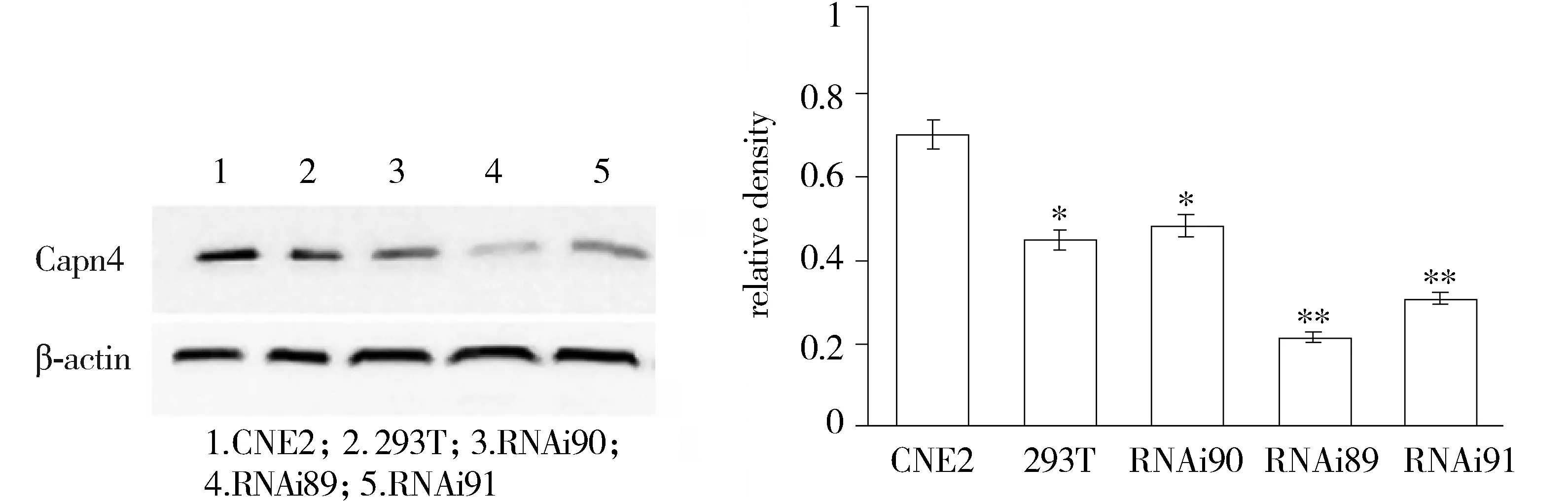
与CNE2细胞比较,*P<0.05,**P<0.01图3 Western blot分析三株shRNA下调Capn4在CNE2中的表达Figure 3 Expression of Capn4 after transfected with shRNA by Western blot
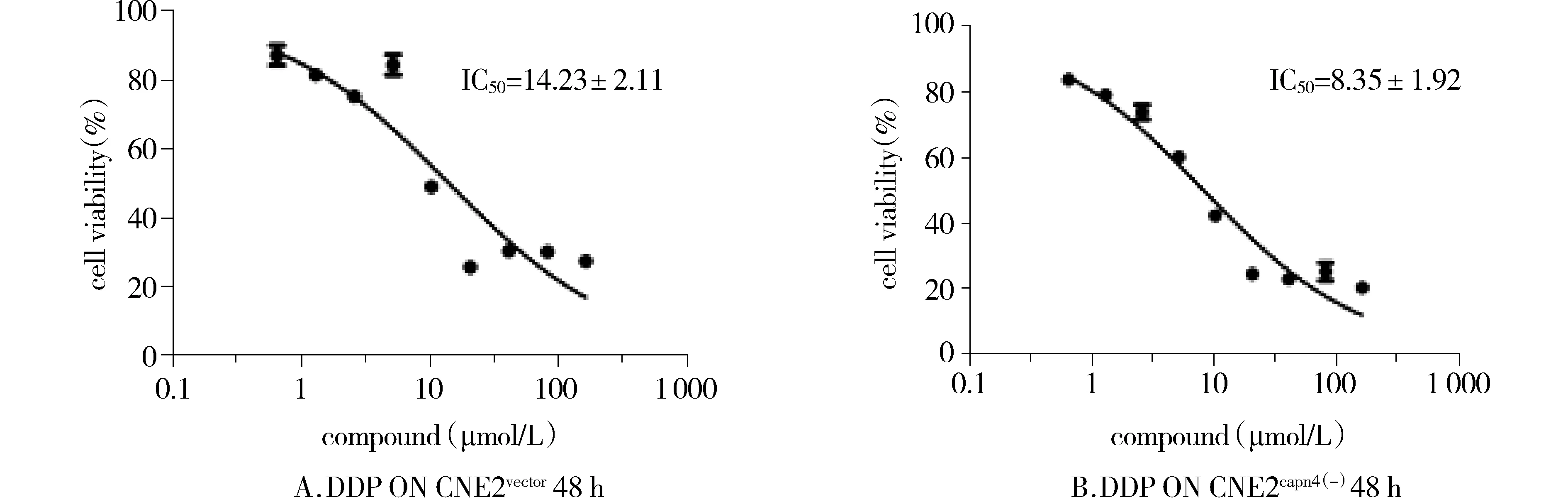
图4 MTT法分析在CNE2细胞及shRNA下调Capn4表达的CNE2细胞中运用顺铂后细胞增殖Figure 4 The proliferation of CNE2 cells and Capn4 knockdown CNE2 cells determined by MTT
本研究首先收集了152例鼻咽癌组织和30例非癌鼻咽组织进行免疫组化染色,统计结果分析显示:Capn4在鼻咽癌组织中的表达明显高于非癌鼻咽组织,差异具有统计学意义。应用Western blot探测性研究Capn4在鼻咽癌细胞CNE2中的表达情况,结果也提示Capn4在鼻咽癌细胞中的表达显著要高于正常人肾上皮细胞294T。这些结果提示Capn4可能与鼻咽癌的恶性表型相关并在鼻咽癌的发生发展中发挥一定的作用。
顺铂是临床常用的鼻咽癌化疗药物[8],它是一种细胞毒药物,不仅能杀伤肿瘤细胞,抑制肿瘤细胞修复损伤,当它与放射治疗何用,还具有放疗增敏的作用。顺铂作为细胞周期非特异性化疗药物可将氯解离成双矛状,与DNA双链上的碱基形成交叉连接,引起DNA链间、链内或蛋白质DNA交联[9]。本研究进一步构建了shRNA以下调Capn4表达并运用Western blot法验证。MTT法检测在不同浓度的顺铂作用48 h后,转入空载体的CNE2细胞和敲除Capn4的CNE2细胞相比,后者的细胞增殖明显受抑制,说明Capn4参与顺铂损伤后鼻咽癌细胞的DNA损伤过程,并可能抑制了DNA损伤后癌细胞的修复过程。
损伤DNA的分子机制不尽相同,常见的DNA损伤类型有单链断裂,双链断裂等[10]。在DNA的损伤中,双链断裂是最严重的,主要通过HR和NHEJ进行修复。DNA修复能力异常激活和增强是导致鼻咽癌细胞对DNA损伤剂耐药的重要分子基础;相反,修复缺陷则使肿瘤对其高敏感。寻找DNA修复抑制剂成为抗肿瘤研究领域的一项新热点。因此,干扰鼻咽癌细胞DNA修复很可能增敏基于DNA损伤的鼻咽癌放化疗作用。Calpain也可通过维持去泛素化酶USP1稳定性的方式影响细胞基因组的稳定性。USP1-UAF1是DNA损伤反应的一种关键调节因子,去泛素化酶USP1通过与UAF1(U2核糖核蛋白颗粒辅助因子1)结合,对两种关键的DNA修复蛋白FANCD2-ub及PCNA-ub进行去泛素化而调控DNA修复。敲除了USP1、UAF1以及二者都敲除的鸡DT40细胞表现了对化学交联剂、喜树碱、聚腺苷二磷酸-核糖聚合酶(PARP)抑制剂的高度敏感性,提示USP1/UAF1复合物促进了同源重组(HR)介导的DAN双联断裂的修复[11]。通过免疫共沉淀发现USP1去泛素化酶与Capn4(即CAPNS1)相互结合并相互作用,通过单细胞电泳(彗星实验)发现在敲除Capn4的MEFs细胞中,经UV照射后不论是DNA损伤应答还是DNA损伤修复均受抑制,提示伴随Capn4的抑制,PCNA超泛素化与UV照射后DNA损伤修复缺陷有关[12]。Capn4参与上述哪条损伤通路,是否影响细胞周期蛋白尚待进一步研究。对Capn4的抑制可能成为鼻咽癌放化疗后抑制DNA损伤修复的重要因素。
参考文献:
[1]Simoes A T,Goncalves N,Koeppen A,etal.Calpastatin-mediated inhibition of calpains in the mouse brain prevents mutant ataxin 3 proteolysis,nuclear localization and aggregation,relieving Machado-Joseph disease[J].Brain,2012,135(8):2428-2439.
[2]Trinchese F, Fa M,Liu S,etal.Inhibition of calpains improves memory and synaptic transmission in a mouse model of Alzheimer disease[J].J Clin Invest,2008,118(8):2796-2807.
[3]Tonnetti L,Netzel-Arnett S,Darnell GA,etal.SerpinB2 protection of retinoblastoma protein from calpain enhances tumor cell survival[J].Cancer Res,2008,68(14):5648-5657.
[4]Li L,Tao Q,Jin H,etal.The tumor suppressor UCHL1 forms a complex with p53/MDM2/ARF to promote p53 signaling and is frequently silenced in nasopharyngeal carcinoma[J].Clin Cancer Res,2010,16(11):2949-2958.
[5]Goll DE,Thompson VF,Li H,etal.The calpain system[J].Physiol Rev,2003,83(3):731-801.
[6]Zhuang Q,Qian X,Cao Y,etal.Capn4 mRNA level is correlated with tumour progression and clinical outcome in clear cell renal cell carcinoma[J].J Int Med Res,2014,42(2):282-291.
[7]Zhang C,Bai DS,Huang XY,etal.Prognostic significance of Capn4 overexpression in intrahepatic cholangiocarcinoma[J].PLoS One,2013,8(1):e54619.
[8]Brmcu C,Gherman CD,Irimie A,etal.Epigallocatechin-3-Gallate(EGCG)inhibits cell proliferation and migratory behaviour of triple negative breast cancer cells[J]. J Nanosci Nanotechnol,2013,13(1):632-637.
[9]Chaney SG,Campbell SL,Bassett E,etal.Recognition and processing of cisplatin-and oxaliplatin-DNA adducts[J].Crit Rev Oncol Hematol,2005,53(1):3-11.
[10]Aziz K,Nowsheen S,Pantelias G,etal.Targeting DNA damage and repair:embracing the pharmacological era for successful cancertherapy[J].Pharmacol Ther,2012,133(3):334-350.
[11]Junko Murai,Kailin Yang,etal.The USP1/UAF1 Complex Promotes Double-Strand Break Repair through Homologous Recombination.Mol.Cell.Biol,2011,31(12):2462-2469.
[12]Francesca Cataldo,Leticia Y.etal.CAPNS1 regulates USP1 stability and maintenance of genome Integrity[J].Mol Cell Biol,2013,33(12):2485-2496.
Expression of Capn4 in nasopharyngeal carcinoma and its effect on proliferation of CNE2
WANG Feng1, ZHENG Ming2*, ZHENG Peichan2, WU Lixian2, WANG Hui2
(1CollegeofIntegrativeMedicine,FujianUniversityofTCM,Fuzhou350004,China;2DepartmentofPharmacology,FujianMedicalUniversity;*Correspondingauthor,E-mail:zming_1956@163.com)
Abstract:ObjectiveTo investigate the expression of Capn4 in nasopharyngeal carcinoma(NPC) tissues and nasopharyngeal carcinoma cells(CNE2), and explore its effect on proliferation after treated with cisplatin in CNE2 cells.MethodsThe expression level of Capn4 protein was detected in archived paraffin-embedded NPC tumor(n=153) and non-tumoral nasopharyngeal specimens(n=30) by immunohistochemical staining. The protein levels of Capn4 in CNE2 and 293T cells were examined by Western blot. The Capn4 knockdown cells using shRNA was constructed in CNE2 cells and further identified by Western blot. The proliferation of knockdown Capn4 cells were determined by MTT after treated with cisplatin.ResultsThe expression levels of Capn4 in NPC samples were significantly higher than that of non-tumoral tissues (P<0.001), and the expression levels of Capn4 were significantly higher in CNE2 cells than in 293T cells. The shRNA inhibited Capn4 expression in CNE2 cells. The proliferation was inhibited in Capn4 knockdown CNE2 cells after treated with cisplatin compared to normal CNE2 cells(P<0.05).ConclusionThe expression levels of Capn4 in tissues and cell lines of NPC are significantly higher than in normal nasopharyngeal tissues and 293T cells. Capn4 knockdown may inhibit the cell proliferation after treated with cispaltin.
Key words:Capn4;nasopharyngeal carcinoma;cisplatin;shRNA
基金项目:国家自然科学基金资助项目(81572662)
作者简介:王丰,女,1979-02生,博士,讲师,E-mail:fangfei1931@126.com
收稿日期:2016-02-25
中图分类号:R739.62
文献标志码:A
文章编号:1007-6611(2016)05-0434-05
DOI:10.13753/j.issn.1007-6611.2016.05.008

