藻酸双酯钠对脂多糖所致小鼠肺微血管内皮细胞损伤的保护作用研究*
黄厚刚,史 斌,税春玲△
(1.重庆医科大学附属永川医院麻醉科,重庆 402160; 2.四川省革命伤残军人医院麻醉科,成都 610501)
藻酸双酯钠对脂多糖所致小鼠肺微血管内皮细胞损伤的保护作用研究*
黄厚刚1,史斌2,税春玲1△
(1.重庆医科大学附属永川医院麻醉科,重庆 402160; 2.四川省革命伤残军人医院麻醉科,成都610501)
[摘要]目的研究藻酸双酯钠(PSS)对脂多糖(LPS)所致的小鼠肺微血管内皮细胞(PMVEC)损伤的保护作用。方法体外培养PMVEC,随机将细胞分为空白对照组(C组)、LPS刺激组(L组)、PSS+LPS组(LP组)。采用MTT法检测PSS对LPS刺激PMVEC的细胞活力的影响,虎红染色法测定中性粒细胞(PMN)对PMVEC黏附数量的影响,酶联免疫吸附试验(ELISA)法检测3组培养上清液中肿瘤坏死因子-α(TNF-α)和细胞间黏附分子-1(ICAM-1)的浓度。结果PSS能抑制LPS所致的PMVEC细胞活力下降(P=0.001);与C组比较,L组的PMVEC与PMN的黏附数量明显增加(P=0.000),TNF-α和ICAM-1的表达显著增加(P=0.000);与L组比较,PSS预处理1 h能显著降低LPS所致的PMVEC与PMN的黏附(P=0.000),LP组的TNF-α和ICAM-1表达显著降低(P<0.05)。结论PSS能抑制LPS对PMVEC的损伤及PMVEC与PMN的黏附,其作用机制可能与降低ICAM-1和TNF-α的表达有关。
[关键词]急性肺损伤;藻酸双酯钠;肿瘤坏死因子-α;细胞间黏附分子-1
急性肺损伤 (acute lung iniury,ALI)是一组因肺泡毛细血管膜弥漫性损伤导致肺水肿和肺微不张,以呼吸窘迫和顽固性低氧血症为主要临床表现的综合征,进一步可发展为急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS),在临床非常常见且十分凶险。由于其发病机制复杂,治疗效果不佳,其病死率仍然居高不下,平均病死率高达50% 以上[1]。近年来许多研究显示,肺血管内皮细胞在ALI/ARDS病理、生理过程中既是主要的受损靶细胞,亦是活跃的炎症和效应细胞,在ALI/ARDS中发挥重要作用[2],其损伤及活化是ALI/ARDS发生、发展的重要病理基础和关键环节,因而改善内皮细胞损伤及调控其不当活化对ALI/ARDS的治疗和预后具有重要意义。
国内外研究发现传统的抗凝药肝素具有抑制中性粒细胞(PMN)对毛细血管内皮的黏附、减少炎症介质及细胞因子的产生、阻止内皮细胞活化及氧自由基和脂质过氧化物的生成而发挥对抗氧自由基的损伤等作用,从而应用于ALI的治疗[3-5]。藻酸双酯钠(polysaccharide sulfate,PSS)是我国最早从海藻中提取的一种类肝素物质,被证明具有调血脂、抗凝血、改善血流动力学及改善微循环等作用,过去临床上主要被应用于缺血性心脑血管病的治疗[6-7]。本实验采用小鼠肺微血管内皮细胞(pulmonary microvascular endothelial cell,PMVEC)为研究对象,用细菌脂多糖(lipopolysaccharide,LPS)刺激PMVEC建立炎性反应模型,以研究PSS对LPS诱导PMVEC损伤的保护作用及可能的机制。
1材料与方法
1.1材料
1.1.1药物与试剂PSS纯原料粉剂由青岛正大海尔制药公司馈赠;LPS购自美国Sigma公司;内皮细胞及培养液购自武汉原生原代生物医药科技有限公司;虎红和台盼蓝购自美国Sigma公司;兔抗小鼠ICAM-1单克隆抗体购自武汉博士德生物工程公司;TNF-α酶联免疫吸附法(ELISA)试剂盒购自美国R&D公司。
1.1.2仪器酶标仪(美国Bio-Rad公司),倒置相差显微镜(日本Olympus公司);Thermo Forma 3110二氧化碳培养箱(美国Thermo Scientific 公司)。
1.2方法
1.2.1MTT法检测PMVEC的细胞活力将小鼠PMVEC接种至96孔板,每孔100 μL,采用专用培养液在37 ℃、5% CO2培养箱培养24 h。实验分3组:空白对照组(C组)、LPS组(L组)与LPS+PSS组(LP组)。C组和L组分别加入100 μL培养液,LP组加入含100 μg/mL PSS的培养液,于培养箱中孵育1 h后取出培养板,L组和LP组加入100 μL含有1 μg/mL LPS的ECM,C组加入100 μL ECM。每组各设10个复孔。继续孵育24 h后将培养液吸出,向每孔内加入20 μL 0.5% MTT溶液及100 μL培养液,37 ℃孵育4 h后吸掉培养液,每孔中加入DMSO溶液150 μL,振荡10 min以完全溶解结晶。最后使用酶标仪检测各孔的490 nm吸光度值。
1.2.2PMVEC与PMN黏附实验各组细胞孵育24 h后吸除每孔培养液,立即加入PMN 200 μL,培养1 h后吸去上清液,用PBS清洗2遍,然后在每孔中加入100 μL 0.25%虎红染色,室温静置10 min后吸除虎红液,再用PBS清洗2遍,加入200 μL 1∶1的95%乙醇-PBS以脱色,室温静置1 h,最后用酶标仪测定各孔550 nm波长处的吸光度值。
1.2.3PMVEC培养上清液中TNF-α的测定采用双抗体夹心ELISA,按试剂盒说明书操作步骤测定PMVEC培养上清液中TNF-α的含量。
1.2.4免疫细胞化学染色检测细胞间黏附分子-1(ICAM-1)细胞爬片,PBS洗涤盖玻片3×5 min,加3% H2O2室温孵育10 min,PBS洗涤3×5 min,加山羊血清封闭,室温静置20 min,吸干后滴加一抗 50 μL(1∶200),4 ℃孵育过夜,PBS充分洗涤3×5 min,然后加二抗于室温静置20 min,PBS充分洗涤3次,每次各5 min。使用DAB显色,苏木精复染,最后于乙醇脱水二甲苯透明,使用中性树胶封片。采用 Image Proplus 5.1软件拍照并进行半定量分析,用蛋白阳性表达面积(area)和积分光密度值(IOD值)两个指标进行比较。
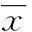
2结果
2.1PSS对LPS诱导PMVEC增殖的影响与C组比较,L组PMVEC经LPS刺激24 h后,细胞活力明显下降(P=0.000)。LP组经过PSS预处理,与L组比较PMVEC活力升高,差异具有统计学意义(P=0.001),见表1。
2.2PSS对PMVEC与PMN黏附作用的影响L组中PMVEC与PMN的黏附数量较C组显著增加(P=0.000),而LP组PMVEC与PMN的黏附数量较L组显著减少(P=0.000),见表2。
2.3PSS对LPS诱导PMVEC分泌TNF-α的影响ELISA结果显示:与C组比较,LPS刺激PMVEC 24 h后,TNF-α分泌水平显著提高(P=0.000)。与LPS组比较,PSS预处理PMVEC TNF-α分泌显著降低(P=0.000),见表3。
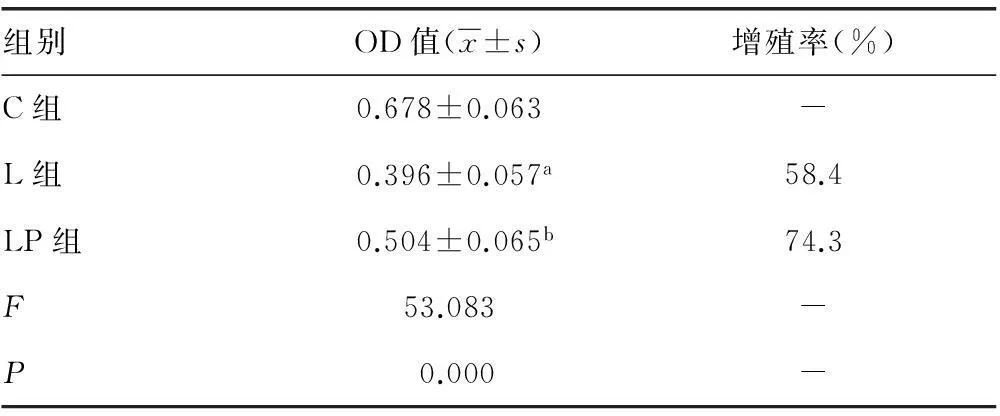
表1 PSS对LPS诱导PMVEC增殖的影响(n=10)
a:P<0.05,与C组比较;b:P<0.05,与L组比较;-:此项无数据。
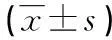
表2 PSS对LPS诱导PMVEC与中性粒细胞黏附作用的影响
a:P<0.05,与C组比较;b:P<0.05,与L组比较。
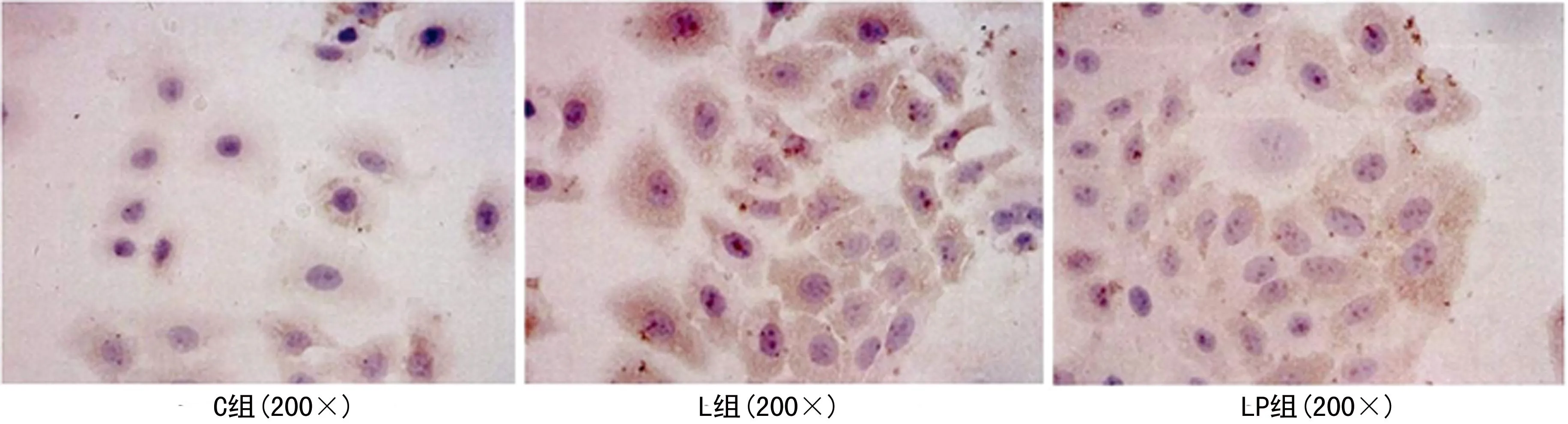
图1 各组PMVEC中 ICAM-1免疫细胞化学检测结果
2.4PSS对LPS诱导PMVEC表达ICAM-1的影响光镜下观察C组PMVEC细胞质中可见少量ICAM-1表达(图1)。半定量分析结果显示,L组ICAM-1 阳性表达面积和IOD较C组均显著增加(P=0.000)。而PSS预处理组的ICAM-1 阳性表达面积和IOD均显著低于L组(P=0.05、0.025),见表3。
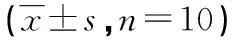
表3 PSS对LPS诱导PMVEC表达TNF-α和ICAM-1的影响
a:P<0.05,与C组比较;b:P<0.05,与L组比较。
3讨论
近期研究发现肺血管内皮细胞在ALI的发病机制中担当着重要角色。肺血管内皮细胞在LPS等的作用下,分泌和释放多种炎症介质及细胞因子,打破机体促炎和抗炎过程的平衡,引起PMN激活黏附聚集等过度炎性反应,同时亦诱发凝血与抗凝系统平衡紊乱,导致肺微循环障碍及肺动脉高压,从而患者出现以进行性低氧血症和呼吸窘迫为主要表现的临床症状[8-9]。国内外研究报道传统的抗凝药肝素具有改善低氧血症和减轻炎性反应的效应从而可用于治疗ALI。此外还有报道,甘糖酯作为PSS的换代产品可通过增强尿激酶活性、激活纤溶系统,而表现出良好的抗血栓作用,且对氧化低密度脂蛋白所引发的血管内皮细胞损伤亦具有修复和保护作用[10-11]。因此,笔者推测PSS具有保护血管内皮细胞、抑制PMN与内皮细胞黏附的功能。
本研究采用100 μg/mL浓度PSS预处理PMVEC,在1 μg/mL的LPS刺激下,PMVEC的活力明显的减低,而PSS能部分的抑制LPS导致的PMVEC损伤,说明PSS具有保护PMVEC的作用。有文献报道适当浓度的PSS能促进体外培养的人类脐静脉血管内皮细胞生长[12],与本研究结果类似。肺血管内皮细胞是各种肺损伤因素攻击的靶细胞,其损伤后导致肺血管内皮细胞屏障功能下降,毛细血管通透性增加,从而出现肺水肿,呼吸困难。因此,PSS对PMVEC发挥出的保护作用提示其对ALI的治疗潜力。
正常情况下,PMN和PMVEC不黏附或很少黏附[13]。当细菌进入体内释放LPS等内毒素性物质会激活机体炎症细胞释放PG、LT及TXA2等致炎因子,从而促进PMN趋化和黏附聚集增多[14]。检测内皮细胞与中性粒细胞黏附的方法目前主要有直接计数法[15]和虎红染色法[16]。本实验采用的虎红染色法具有省时、方便、重复性好的优势。实结果显示LPS刺激可显著增加PMN对PMVEC的趋化和黏附数量,而PSS处理能显著抑制这一过程,推测其可能存在以下机制:(1)PSS具有保护内皮细胞作用,促进其损伤修复,从而降低LPS对PMVEC的炎症激活效应;(2)PSS系一种酸性黏多糖类阴离子聚电解质,其分子本身带有负电荷,故能增加PMVEC表面负电荷及细胞间静电排斥力,从而阻碍其黏附[6];(3)PSS可能减少炎症因子和黏附分子的表达而发挥直接抗炎作用。本研究亦进一步对此进行了验证,发现PSS确可抑制LPS诱导的肺微血管内皮细胞ICAM-1和TNF-α表达。
总之,本研究证实PSS能抑制LPS对PMVEC的损伤,并能抑制LPS诱导的PMVEC与PMN之间的黏附,其作用机制可能与降低ICAM-1和TNF-α的表达有关,这些发现提示PSS应用于治疗ALI的潜力。但本研究仅为体外试验,PSS对ALI的确切疗效还有待在动物实验中进一步验证评价。
参考文献
[1]金发光.急性肺损伤的诊治研究现状及进展[J/CD].中华肺部疾病杂志:电子版,2013,6(1):1-3.
[2]Cheng IW,Matthay MA.Acute lung injury and the acute respiratory distress syndrome[J].Crit Care Clin,2003,19(4):693-712.
[3]杨琼,刘丰海,徐仑.急性肺损伤的发病机制及肝素的保护作用[J].齐鲁医学杂志,2002,17(3):278-279.
[4]Derhaschnig U,Pernerstorfer T,Knechtelsdorfer MA,et al.Evaluation of antiinflammatory and antiadhesive effects of heparins in human endotoxemia[J].Crit Care Med,2003,31(4):1108-1112.
[5]韩旭东,黄晓英,葛志华,等.持续小剂量肝素治疗脓毒症患者急性肺损伤/急性呼吸窘迫综合症的临床研究[J].临床肺科杂志,2010,15(12):1730-1732.
[6]于丽凤,赵金生,于龙,等.藻酸双酯钠对2型糖尿病心血管并发症防治作用的研究[J].中国药理学通报,2008,24(5):630-635.
[7]史丽华,荣阳,荣根满.藻酸双酯钠溶栓治疗急性脑梗死的疗效分析与临床研究[J].中国医药指南,2015,13(9):128-129.
[8]李亚春,李颖川,周明.肺血管内皮细胞损伤与修复在急性肺损伤中的作用[J].中国临床医学,2010,17(6):819-821.
[9]杜景霞,魏国会.肺血管内皮细胞结构功能变化与急性肺损伤[J].河北医药,2012,34(23):3624-3626.
[10]姚子昂,马洪明,姜招峰,等.甘糖酯对大鼠尿激酶型纤溶酶原激活物活性的诱导作用[J].青岛海洋大学学报:自然科学版,2001,31(2):215-219.
[11]滕继军.甘糖酯对氧化低密度脂蛋白损伤血管内皮细胞的作用[J].齐鲁医学杂志,2003,18(3):224-226.
[12]赵仁亮,王春霞,赵俊武,等.藻酸双酯钠对血管内皮细胞的生长及其与中性粒细胞黏附功能的影响[J].中国海洋药物,2007,26(3):41-44.
[13]Van Nieuw Amerongen GP,Vermeer MA,Nègre-Aminou P,et al.Simvastatin improves disturbed endothelial barrier function[J].Circulation,2000,102(23):2803-2809.
[14]Wyman TH,Bjornsen AJ,Elzi DJ,et al.A two-insult in vitro model of PMN-mediated pulmonary endothelial damage:requirements for adherence and chemokine release[J].Am J Physiol Cell Physiol,2002,283(6):C1592-1603.
[15]曾祥元,顾大勇,马布仁,等.LPS诱导肺微血管内皮细胞与PMN的黏附作用及核调控机理的实验研究[J].中国微循环,2002,6(5):310-311.
[16]任钧国,邱全瑛,郝钰,等.清解宁对白细胞血管内皮细胞粘附的影响[J].中国免疫学杂志,2003,19(9):618.
Protective effects of polysaccharide sulfate on LPS-induced mice pulmonary microvascular endothelial cell injury*
Huang Hougang1,Shi Bing2,Shui Chunling1△
(1.Department of Anesthesiology,Affiliated Yongchuan Hospital of Chongqing Medical University, Chongqing 402160,China;2.Department of Anesthesiology,Sichuan Provincial Hospital for Disabled Revolutionary Servicemen,Chengdu,Sichuan 610501,China)
[Abstract]ObjectiveTo investigate the effects of polysaccharide sulfate (PSS) on lipopolysaccharide(LPS)-induced mice pulmonary microvascular endothelial cell(PMVEC) injury in vitro.MethodsPMVEC were divided into the blank control group (C),LPS stimulation group (L) and PSS+LPS group (LP).The effect of PSS on the viability of LPS-induced PMVEC was observed by MTT assay.The influence of polymorphonuclear(PMN) on the PMVEC adhesion number was measured by the rose Bengal staining.The concentrations of TNF-α and ICAM-1 in culture supernatant of PMVEC were detected by ELISA assay.ResultsPSS could inhibit the decrease of PMVEC viability caused by LPS(P=0.001),compared with the group C,the adhesion number of PMVEC and PMN in the group L was significantly increased(P=0.000),the expression of TNF-α and ICAM-1 was significantly increased(P=0.000);compared with the group L,PSS pretreatment for 1 h could significantly decrease the LPS caused adhesion of PMVEC and PMN(P=0.000),the expression of TNF-α and ICAM in the group LP was significantly decreased (P<0.05).ConclusionPSS can inhibit LPS-induced PMVEC injury and adhesion of PMVEC and PMN,its mechanism may be related with the decrease of ICAM-1 and TNF-α expression.
[Key words]acute lung injury;polysaccharide sulfate;tumor necrosis factor-α;intercellular adhesion molecular-1
doi:论著·基础研究10.3969/j.issn.1671-8348.2016.09.005
* 基金项目:重庆医科大学附属永川医院青年课题(YJQN201002)。
作者简介:黄厚刚(1974-),硕士,主治医师,主要从事急性肺损伤研究。△通讯作者,E-mail:scling@163.com。
[中图分类号]R543
[文献标识码]A
[文章编号]1671-8348(2016)09-1167-03
(收稿日期:2015-09-10修回日期:2015-12-06)

