OPN干预子宫内膜异位症腺上皮细胞中NF-κBp65表达及其对细胞侵袭性的影响*
白治苗,卢玉凤,杨 眉,李望舒,哈春芳
(1.宁夏医科大学,银川 750004;2.宁夏医科大学总医院妇产科/宁夏生育力保持重点实验室,银川 750004)
OPN干预子宫内膜异位症腺上皮细胞中NF-κBp65表达及其对细胞侵袭性的影响*
白治苗1,卢玉凤1,杨眉1,李望舒1,哈春芳2△
(1.宁夏医科大学,银川 750004;2.宁夏医科大学总医院妇产科/宁夏生育力保持重点实验室,银川 750004)
[摘要]目的探讨子宫内膜异位症(EMS)患者在位内膜腺上皮细胞中骨桥蛋白(OPN)对核因子κB(NF-κB)p65表达的影响及其与细胞侵袭的关系。方法原代分离培养12例EMS患者在位内膜原代腺上皮细胞。采用OPN siRNA干扰细胞24 h后收集,Western blot、RT-PCR方法分别检测干预前、后细胞中OPN、NF-κBp65蛋白及其mRNA表达情况;Transwell试验检测干预前、后细胞侵袭性的变化。采用相同剂量的无RNA酶水干预EMS患者在位内膜腺上皮细胞作为未干预组。结果与干预前比较,OPN siRNA干扰后细胞中OPN蛋白、mRNA的表达明显下降(t1=7.92,t2=9.87,P<0.05);与未干预组比较差异无统计学意义(P>0.05);OPN siRNA干扰后细胞中NF-κBp65蛋白及mRNA的表达明显减弱(t1=-2.13,t2=- 8.61,P<0.05),与未干预组比较差异无统计学意义(P>0.05)。OPN siRNA干扰后原代腺上皮细胞的侵袭性明显降低(t=2.38,P<0.05),与未干预组比较差异无统计学意义(P>0.05)。OPN、NF-κBp65在EMS患者在位内膜腺上皮细胞中的表达呈明显的正相关(r=0.87)。结论OPN siRNA沉默EMS患者腺上皮细胞中的OPN后OPN、NF-κBp65的表达及细胞的侵袭性均明显降低,且二者呈明显正相关,揭示二者极有可能在异位细胞的侵袭中发挥同步协调作用。
[关键词]子宫内膜异位症;骨桥蛋白质;核因子-κBp65
子宫内膜异位症(endometriosis,EMS)简称内异症,是指具有活性的子宫内膜组织(腺体和间质)出现于子宫内膜以外的部位,导致临床上常见的痛经或慢性盆腔痛、不孕等为主要临床症状的疾病,目前病因及发生机制尚不十分明了,因而临床缺乏有效的根治性治疗方法,是妇科医生亟待解决的难题之一[1-2]。基础和临床研究显示EMS是一种子宫内膜活性增高所致的内膜异常性基因疾病,与内膜细胞的异地黏附和侵袭性增强有关[3]。EMS的黏附、侵袭、远处转移及术后易复发等特性类似于恶性肿瘤。肿瘤学研究显示,骨桥蛋白(osteopontin,OPN)通过与其受体结合后激活依赖MAPK/PI3K通路的核因子-κB(NF-κB)通路,进而促进细胞中尿激酶型纤溶酶原激活物(uPA)和基质金属蛋白酶9(MMPs)的分泌,介导细胞侵袭过程与细胞迁移,进而诱导肿瘤的发生与转移[4]。因此国内外很多学者将血管生长因子或黏附分子OPN、MMP9及NF-κB等与EMS的发生、发展联系起来,并揭示了这些因子可能与内膜的异位黏附、侵袭性相关[5-6]。但二者的相关性及其与细胞侵袭性的确切机制不清。故本研究旨在通过OPN siRNA干扰原代腺上皮细胞探讨OPN、NF-κBp65与EMS发病及细胞侵袭性的关系。
1资料与方法
1.1一般资料
1.1.1标本获取收集2013年12月至2014年12月于宁夏医科大学总医院妇产科因EMS行子宫全切术患者12例,用棉拭子将宫腔内的黏液蘸掉,用手术刀的刀背刮取内膜,快速于低温下转移至细胞间,进行原代细胞分离培养。
1.1.2纳入标准所有研究对象的年龄20~45岁,平均(32.41±5.43)岁,患者手术前月经周期均正常(28~35 d),均处于Ⅱ期(按照1985年AFS提出的修正EMS分期法),近3个月均未接受过激素类药物的治疗,无生殖道炎症及其他妇科疾病,无慢性肝炎、糖尿病、肿瘤等慢性疾病史。
1.2方法
1.2.1原代腺上皮细胞培养选取EMS患者行子宫全切术术后的子宫,术后用棉拭子蘸除黏液,手术刀刀背刮取内膜,置于含10 mL培养液的灭菌小瓶中,内含1%胎牛血清、DMED/F12(Penicillin及链霉素各100 U/mL),冰浴快速转运至实验室细胞间,用磷酸盐缓冲液(PBS)冲洗掉新鲜的子宫内膜组织中的血液成分,用眼科剪将内膜剪成约1 mm3大小的组织块,加入含有0.25%胶原酶/dispase(终浓度为1 mg/mL)的培养液中,于37 ℃用一次性吸管吹打消化3次,每次10 min,加入含血清的培养液终止消化,500 r/30 s离心,取上清液重复离心5次,沉淀中加入培养液,制成细胞悬液。细胞计数后,均匀将细胞接种于60 mm培养皿中,置于37 ℃ 5%CO2细胞培养箱中培养。
1.2.2OPN siRNA干扰待上述原代细胞融合度为70%~90%时,进行siRNA干扰。分别用500 μL Opti-MEM无血清培养基稀释10 μL TransLipid HL,500 μL Opti-MEM无血清培养基稀释10 μL OPN特异性siRNA及干扰siRNA(稀释前的siRNA浓度20 μM),于室温静置5 min后,将稀释好的OPN特异性siRNA(OPN siRNA干预组)及干扰siRNA(siRNA干预组)与TransLipid HL轻柔混合后室温静置20 min后,将混合物分别加入含5 mL Opti-MEM无血清培养液的60 mm培养皿中,其中一组加入相同剂量无RNA酶水干预的培养液作为空白对照组(未干预组)。放入培养箱中培养4~6 h后更换培养液继续培养24 h。
1.2.3RT-PCR总RNA的提取直接在60 mm培养皿中加入600 μL裂解液RZ裂解细胞并反复抽打至溶液透明,将匀浆样品室温放置5 min,加入150 μL氯仿,剧烈震荡15 s后室温放置3 min,4 ℃ 12 000 r/min离心10 min,将水相转移至新的Ep中。加入150 μL无水乙醇,混匀后将溶液转入吸附柱CR3中,再次离心,弃掉收集管中的废液,向吸附柱CR3中加入500 μL去蛋白液RD,离心,弃废液,将CR3放回收集管中,再次向吸附柱CR3中加入500 μL漂洗液RW,室温静置2 min,离心,弃废液,将吸附柱放入2 mL收集管中,离心去掉残余液体,最后将吸附柱CR3转入一个新的1.5 mL离心管中,加30 μL无酶的双蒸水,室温放置2 min,4 ℃ 12 000 r/min离心2 min后于BioTek ELx808酶标仪上行RNA纯度及浓度的测定。
1.2.4Western blot检测按照凯基蛋白质说明书提取试剂盒提取细胞总蛋白,并于酶标仪中进行蛋白定量。根据待测蛋白分子的大小制备适宜浓度的SDS分离胶及浓缩胶,插入相应大小的梳子,加入相应分组中蛋白样品及标准蛋白标志物,电泳分离蛋白质后,转运蛋白于硝酸纤维素膜;载有蛋白的硝酸纤维素膜经5% 脱脂牛奶封闭后,加入NF-κBp65、OPN及内参照β-actin等一抗4 ℃过夜,经TBST换洗1次(5 min),5次后加相应二抗孵育2 h,增强型ECL显影,于BIO-RAD成像仪中曝光成像并测定各蛋白条带光密度值,计算相应的光密度比值。
1.2.5穿膜实验(transwell)待预先培养于60 mm培养皿中的EMS原代腺上皮细胞以及OPN siRNA干扰24 h后的细胞融合至80%~90%时,用0.25%的胰酶将其消化,采用无血清培养液将其制成细胞悬液,用一次性吸管吸取1滴进行细胞计数后,将悬液加入小室中(细胞数目大约为105),于小室的下室中加入有血清的培养液后置于37 ℃,5%CO2的细胞培养箱中培养24 h,洗掉培养液,用棉拭子将小室正面的细胞轻轻擦掉后PBS冲洗2~3次,用无水乙醇固定30 min后PBS冲洗2~3次,0.4%台盼蓝染色10 min后,将小室的膜固定于载玻片上在显微镜下进行细胞计数。
1.2.6结果判定标准(1)Western blot结果分析:采用BIO-RAD成像仪扫描滴加DAB显色剂后的蛋白条带,成像并保存图片,采用软件Quality One进行灰度值扫描。(2)RT-PCR结果分析:用BIO-RAD凝胶扫描系统分析摄像,用Roche-Lightcycler 96对产物进行半定量分析。(3)Transwell结果:0.4%台盼蓝染色10 min后,将小室膜刮下贴于载玻片上,滴加二甲苯,盖上盖玻片封片,置于Leica DC 300F正置显微镜下固定选取16个视野于10倍镜下进行细胞计数。
1.3主要试剂OPN siRNA、干扰siRNA(上海Invitrogen贸易有限公司);TransLipid HL Transfection Reagent(北京全式金生物技术有限公司);细胞全RNA提取试剂盒(上海田根有限公司);RNA反转录试剂盒(Thermol公司);免疫荧光定量试剂盒(Thermol公司);兔抗人NF-κBp65、OPN多克隆抗体分别由北京中杉生物工程公司、美国Abcam生物公司生产(稀释浓度分别为1∶100、1∶80)。
2结果
2.1OPN siRNA干扰前后OPN、NF-κBp65蛋白表达比较与siRNA干预组比较,OPN siRNA干扰EMS患者在位内膜腺上皮细胞后OPN蛋白及mRNA明显下降(OPN蛋白3.10±0.26 vs. 0.40±0.07,t1=7.92;OPN mRNA 2.80±0.25 vs. 0.30±0.08,t2=9.87,均P<0.05)。siRNA干预组与未干预组比较,差异无统计学意义(P>0.05),见图1~3、表1。
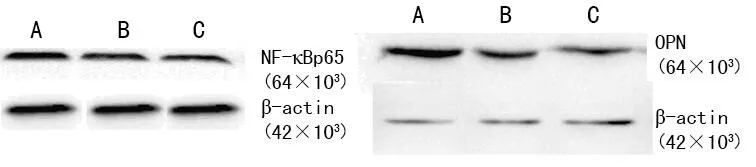
A:未干预组;B:siRNA干预组;C:OPN siRNA干预组。
图1OPN siRNA干扰前后OPN、NF-κBp65蛋白在腺上皮细胞中的表达
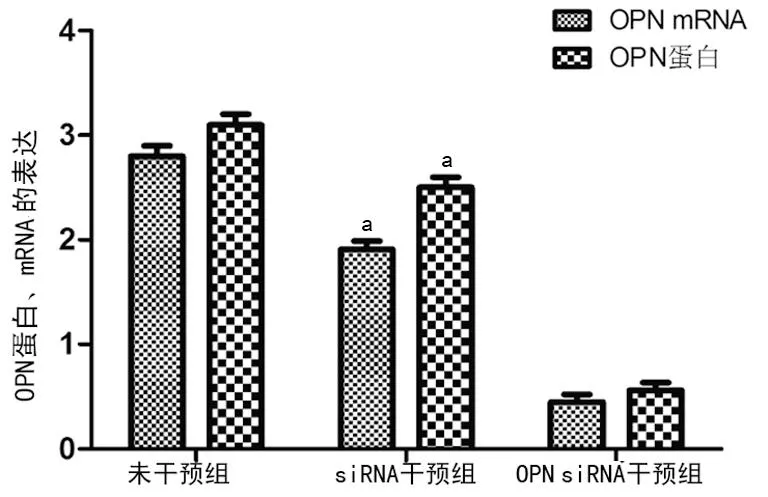
a:P<0.05,与OPN siRNA干预组比较。
图2OPN siRNA干扰前后OPN蛋白、mRNA蛋白在腺上皮细胞中的表达
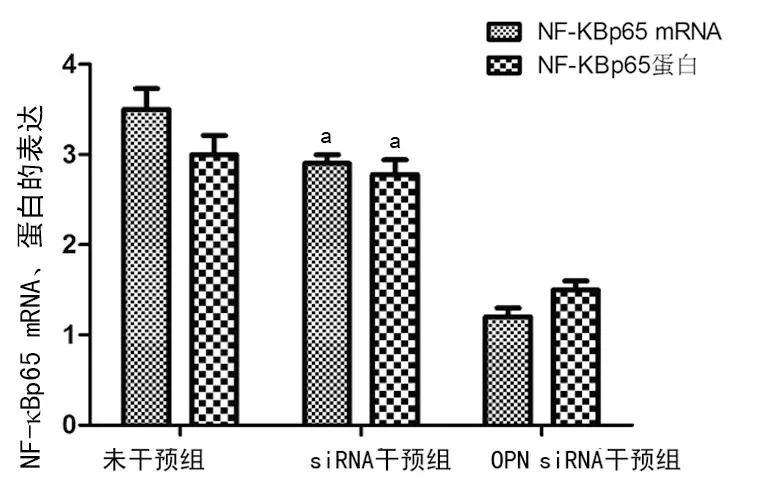
2.2OPN siRNA干扰前后NF-κBp65蛋白、mRNA的表达比较与siRNA干预组比较,OPN siRNA干扰后细胞中NF-κBp65蛋白及mRNA的表达明显减弱,且差异具有统计学意义(NF-κBp65蛋白2.90±0.26 vs. 1.20±0.09,t1=-2.13,mRNA 3.50±0.28 vs. 1.30±0.10,t2=-8.61,均P<0.05)。siRNA干预组与未干预组比较,差异无统计学意义(P>0.05),见图1、3、4、表1。
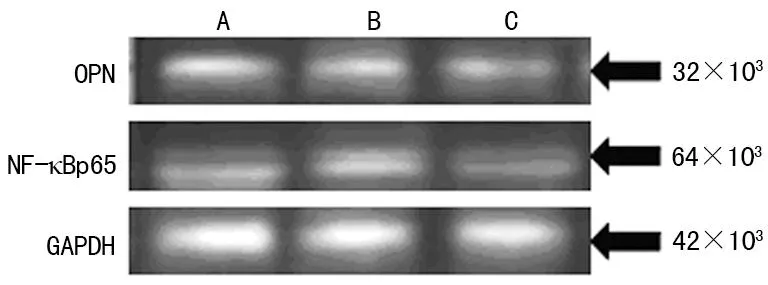
图3 OPN siRNA干扰前后OPN、NF-κBp65
2.3OPN siRNA干扰前后细胞侵袭性比较与siRNA干预组比较,OPN siRNA干扰后原代腺上皮细胞的侵袭性明显降低,差异有统计学意义(65.0±3.78 vs.24.0±1.56,t=2.38,P<0.05),siRNA干预组与未干预组比较,差异无统计学意义(P>0.05),见图5、6、表1。
a:P<0.05,与OPN siRNA干预组比较。
图4OPN siRNA干扰前后NF-κBp65蛋白、mRNA在腺上皮细胞中的表达
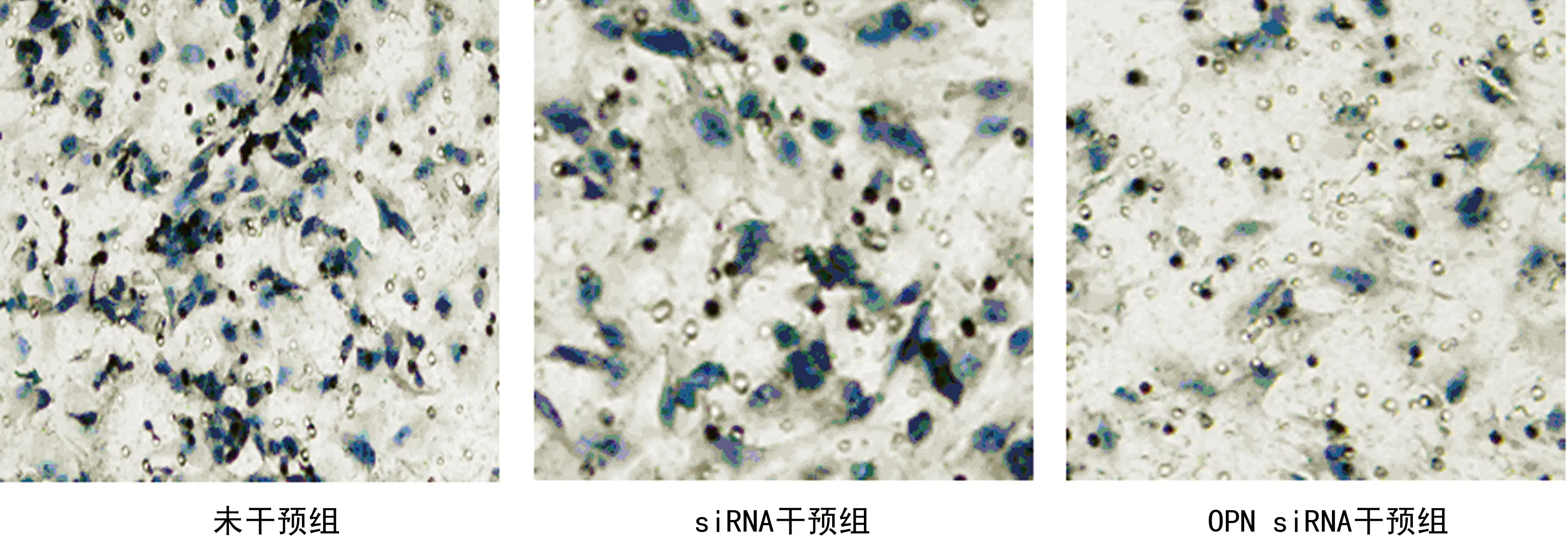
图5 3组显微镜下图像
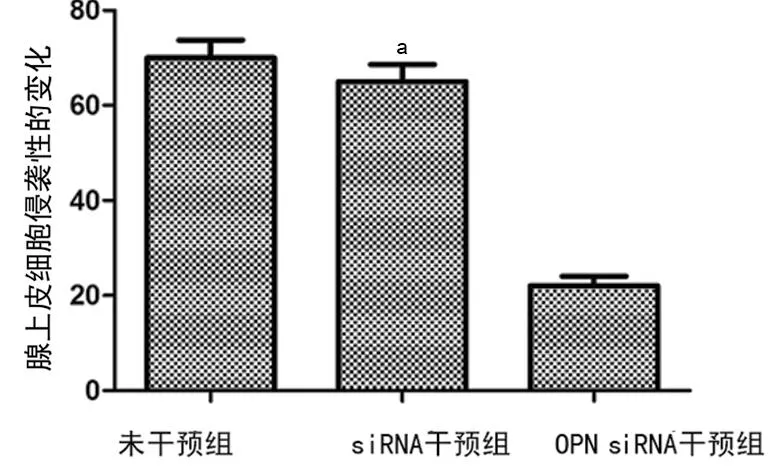
a:P<0.05,与OPN siRNA干预组比较。
图6OPN siRNA干扰前后原代腺上皮细胞的侵袭性比较
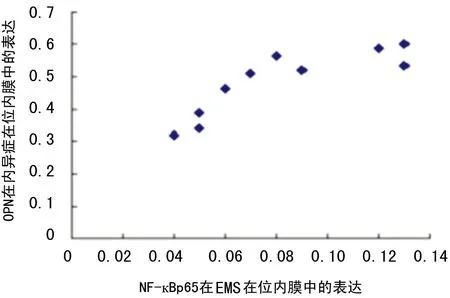
图7 OPN、NF-κBp65在腺上皮细胞中的表达关系
2.4OPN、NF-κBp65在细胞中的表达关系OPN、NF-κBp65在EMS患者在位内膜腺上皮细胞中的表达呈明显的正相关(r=0.87),见图7。
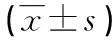
表1 OPN siRNA干扰前后OPN、NF-κBp65蛋白、mRNA积极细胞侵袭性的变化
3讨论
OPN是从骨组织中分离出来的一种磷酸化糖蛋白,组成结构中富含精氨酸-谷氨酸-天冬氨酸序列。有研究表明,OPN与恶性肿瘤的发生、发展密切相关,它通过与其受体avβ3结合后激活依赖MAPK/PI3K通路的NF-κB通路,进而促进细胞中尿激酶型纤溶酶原激活物(uPA)和MMPs的分泌,介导细胞侵袭过程、MMPs的降解和重塑、细胞迁移、宿主免疫细胞的逃逸和新生血管的形成及发挥抑制细胞凋亡、促进肿瘤血管的生成及肿瘤细胞的转移进而诱导肿瘤的发生[7-9]。NF-κB是Sen与Baltimore于1986年首次在成熟的淋巴细胞中发现的一种真核细胞转录因子,它是NF-κB/Rel蛋白家族成员之一,以最常见的p50/p65异源性二聚体形式存在于细胞核中参与许多基因转录的起始调节,如众多的细胞因子、黏附分子、蛋白酶类及炎症因子[10]。在人体的正常情况下,NF-κB存在于细胞质并与其抑制蛋白(IkB)结合,当受到外界异常刺激时,使IkB 磷酸化并被水解使NF-κB与抑制剂分离从细胞质进入细胞核参与细胞的转录调控[11]。近几年,NF-κB在EMS中的研究颇受关注。本课题组的前期试验已经在EMS患者及大鼠EMS模型的组织及细胞水平证实OPN、NF-κBp65在EMS的在位、异位内膜中高表达且呈正相关,且二者与细胞的侵袭性明显相关,通过雌孕激素及其激活剂、抑制剂干预EMS患者在位内膜腺上皮细胞后发现,OPN、NF-κBp65的表达及细胞的侵袭性也相应增加及减弱[12]。国内孙群燕[13]建立小鼠EMS模型并给予基因NF-κBp50敲除后发现与雌激素介导的痛觉过敏和炎症性疼痛密切相关的PKCepsilon因子的表达明显减弱,与激素类药物缓解EMS患者症状的机制相符,进一步验证了NF-κB在EMS的发病过程中发挥重要作用,与本课题组前期试验结果基本一致。
EMS在病理上虽为良性疾病但其有着与恶性肿瘤相似的特征,如异地黏附、侵袭、转移及复发等,EMS的治疗手段很有限,主要以手术治疗为首选,但手术常难以清除所有药物治疗病灶[14-15]。国内有学者通过构建OPN-siRNA的慢病毒载体,发现可以明显抑制结肠癌SW480细胞、胃癌细胞系GC9811的增殖,进而为恶性肿瘤的治疗奠定了基础[16-17]。故本试验通过探索导致EMS的关键因子进而通过阻断其表达来达到EMS的靶向治疗。本研究在前期试验结果OPN、NF-κB于EMS患者在位、异位内膜腺上皮细胞中高表达的基础上,通过质粒构建OPN 特异性siRNA干扰EMS患者在位内膜腺上皮细胞后经Westen blot、RT-PCR及穿膜实验等方法检测发现OPN、NF-κBp65蛋白、mRNA的表达明显下降,且腺上皮细胞的侵袭性也相应降低。因此,本研究结果提示,OPN可能是通过NF-κB通路促进uPA、MMPs的分泌,加速细胞外基质及基底膜降解,促进异位内膜的黏附、种植和生长,进而诱导EMS的发生。但是确切的分子机制还需要进一步的实验证实。因此,笔者认为NF-κB极有可能是OPN诱导EMS发生的关键枢纽,也是EMS药物靶向治疗的关键点。
参考文献
[1]Zhang J,Leng J,Dai Y,et al.Significance of symptom and physical sign to diagnosis of deeply infiltrating endometriosis[J].Zhonghua Fu Chan Ke Za Zhi,2014,49(8):599-603.
[2]Brown J,Farquhar C.An overview of treatments for endometriosis[J].JAMA,2015,313(3):296-297.
[3]Kobayashi H,Higashiura Y,Shigetomi H,et al.Pathogenesis of endometriosis:the role of initial infection and subsequent sterile inflammation[J].Mol Med Rep,2014,9(1):9-15.
[4]Riku D,Subha PD,Ganapati H,et al.Osteopontin:it′s role in regulation of cell motility and nuclear factorκB-mediated urokinase type plasminogen activator expression[J].Iubmb Life,2005,57(6):441-447.
[5]刘玉锋,哈春芳,马远.OPN与MMP-9在子宫腺肌症内膜上皮细胞的表达和意义[J].宁夏医学杂志,2014,36(7):580-581.
[6]杨眉,蒋春樊,年妍,等.雌激素对子宫内膜异位症内膜OPN与MMP-9表达及腺上皮细胞侵袭性的影响[J].宁夏医学杂志,2014,36(7):577-579.
[7]Xiao Y,Li T,Xia E,et al.Expression of integrin β3 and osteopontin in the eutopic endometrium of adenomyosis during the implantation window[J].Eur J Obstet Gynecol Reprod Biol,2013,170(2):419-422.
[8]Xu ST,Guo C1,Ding X,et al.Role of osteopontin in the regulation of human bladder cancer proliferation and migration in T24 cells[J].Mol Med Rep,2015,11(5):3701-3707.
[9]Liu J,Liu Q,Wan Y,et al.Osteopontin promotes the progression of gastric cancer through the NF-kappaB pathway regulated by the MAPK and PI3K[J].Int J Oncol,2014,45(1):282-290.
[10]Wei W,Yuan YH,Gao YN,et al.Polygalasaponin F inhibits secretion of inflammatory cytokines via NF-κB pathway regulation[J].J Asian Nat Prod Res,2014,16(8):865-875.
[11]Heyninck K,Lahtela-Kakkonen M,Van der Veken P,et al.With aferin A inhibits NF-kappaB activation by targeting cysteine 179 in IKKβ[J].Biochem Pharmacol,2014,91(4):501-509.
[12]哈春芳,肖成明,张晟宁,等.开放法大鼠子宫内膜异位症模型的建立与评价[J].山东大学学报:医学版,2011,49(1):1671-1675.
[13]孙群燕.NF-kappaB p50 基因敲除小鼠子宫内膜异位症模型的建立及其研究[J].实用医学杂志,2012,24(6):243-245.
[14]Vercellini P,Vigano P,Somigliana E,et al.Endometriosis:pathogenesis and treatment[J].Nat Rev Endocrinol,2014,10(5):261-275.
[15]Anborgh PH,Mutrie AB,Chambers AF.Role of the metastasis-promoting protein osteopontin in the tumour microenvironment[J].J Cell Mol Med,2010,14(8):2037-2044.
[16]唐红卫,潘阳林,聂勇战,等.Osteopontin特异性siRNA真核表达载体的构建及其在GC9811胃癌细胞中沉默效应的鉴定[J].第四军医大学学报,2005,26(3):202-205.
[17]邢译文,白静,范维宁,等.OPN siRNA慢病毒载体的构建及其对大肠癌细胞增殖的抑制作用[J].基础医学与临床,2014,34(3):350-354.
Expression of NF-κBp65 in glandular epithelial cells of endometriosis after OPN intervention and its influence on cell invasiveness*
Bai Zhimiao1,Lu Yufeng1,Yang Mei1,Li Wangshu1,Ha Chunfang2△
(1.Ningxia Medical University,Yinchuan,Ningxia 750004,China;2.General Hospital of Ningxia Medical University/Key Labroatory of Fertility Preservation and Maintenance of Ningxia,Yinchuan 750004,China)
[Abstract]ObjectiveTo explore the influence of OPN in eutopic glandular epithelial cells of endometriosis on the NF-κBp65 expression and its relationship with the cell invasion.MethodsThe eutopic primary glandular epithelial cells in 12 cases of endometriosis were performed the primary isolation and culture.The cells were collected after 24 h OPN siRNA intervention.Western blot and RT-PCR methods were adopted to detect the expressions of OPN,NF-κBp65 protein and its mRNA before and after intervention.The Transwell experiment was used to detect the change of cell invasiveness before and after intervention.ResultsThe expression of OPN protein and mRNA after interfering primary glandular epithelial cells by OPN siRNA was significantly decreased,and the difference was statistically significant (t1=7.92,t2=9.87,P<0.05).the expression of NF-κB p65 protein and mRNA after OPN siRNA interfering primary glandular epithelial cells was obviously weakened,the difference was statistical significant(t=2.38,P<0.05).the invasiveness of primary glandular epithelial cells after OPN siRNA intervention was significantly decreased,the difference was statistically significant(t=2.38,P<0.05).The expression of OPN and NF-κBp65 had a significantly positive correlation in eutopic endometrial glandular epithelial cells (r=0.87).ConclusionThe expression of OPN and NF-κBp65 is significantly decreased after OPN siRNA interfering eutopic endometrial glandular epithelial cells,therefore OPN most likely lead to the occurrence and development of endometriosis via the NF-κB pathway.
[Key words]endometriosis;osteopontin;NF-κBp65
doi:论著·基础研究10.3969/j.issn.1671-8348.2016.09.004
* 基金项目:国家自然科学基金资助项目(81160078)。
作者简介:白治苗(1991-),硕士,住院医师,主要从事妇科肿瘤方面的研究。△通讯作者,E-mail:hachunfang@163.com。
[中图分类号]R574
[文献标识码]A
[文章编号]1671-8348(2016)09-1163-04
(收稿日期:2015-10-08修回日期:2015-12-22)

