枸杞多糖对小鼠脑缺血再灌注损伤的保护作用及其抑制NF—κB,TNF—α,IL—6 和 IL—1β表达的机制
葛建彬+卢红建+宋新建+李梅+陈丹丹+吴锋


[摘要]探讨枸杞多糖(Lycium barbarum polysaccharides,LBP)对缺血再灌脑损伤小鼠的保护作用及其可能的机制。采用颈总动脉栓线造成大脑中动脉缺血,缺血2 h后将栓线拔出以实现大脑中动脉血流再灌注,形成小鼠短暂性大脑中动脉阻塞(transient middle cerebral artery occlusion,tMCAO)模型,观察LBP(25,50,100 mg·kg-1)对小鼠脑梗死范围,脑含水量,神经症状的影响;采用HE染色观察LBP对小鼠脑组织神经细胞的影响,Western blot法检测缺血大脑皮层NFκB p65蛋白的表达,ELISA法检测血清中TNFα,IL6和IL1β的水平。结果显示,LBP对缺血再灌注小鼠神经症状有明显的改善作用,能明显降低脑梗死范圍和脑含水量。脑组织病理切片也证实了LBP对神经细胞的保护作用。Western blot结果显示,小鼠缺血再灌后缺血侧大脑皮层p65蛋白水平明显增高,LBP能显著降低p65蛋白水平。ELISA结果显示,LBP能显著降低缺血再灌后TNFα,IL6和IL1β的生成。表明LBP对缺血再灌注小鼠脑损伤有明显保护作用,该作用可能与其抑制NFκB和炎症反应有关。
[关键词]枸杞多糖; 脑缺血; 核因子κB; 肿瘤坏死因子α; 白细胞介素6; 白细胞介素1β
Protective effects of LBP on cerebral ischemia reperfusion injury in mice and
mechanism of inhibiting NFκB, TNFα, IL6 and IL1β
GE Jianbin1,2, LU Hongjian1, SONG Xinjian1, LI Mei2, CHEN Dandan3, WU Feng3*
(1 The Second People′s Hospital of Nantong, Nantong 226002, China;
2 Department of Pharmacology, College of Pharmaceutical Science, Soochow University, Suzhou 215123, China;
3 Department of Pharmacology, Nantong University, Nantong 226001,China)
[Abstract]To observe the protective effects of Lycium barbarum polysaccharides (LBP) on cerebral ischemia reperfusion injury in mice and explore its mechanism Common carotid artery thread was used to cause middle cerebral artery ischemia, and the thread was taken out after 2 h ischemia to achieve cerebral ischemia reperfusion injury in mice Therefore, the transient middle cerebral artery occlusion (tMCAO) models were established to observe the effects of LBP (25,50, 100 mg·kg-1) on neurological outcome, infarct size and water contents HE staining was used to observe its effects on neurocytes of cerebral tissues in mice Western blotting was used to evaluate the protein expression levels of NFκB p65 ELISA was used to evaluate the levels of TNFα, IL6 and IL1β in the serum According to the results, LBP markedly improved neurologic deficits, and decreased infarct size and water contents at 24 h after reperfusion in mice Pathological section of brain tissues also proved its protective effects on neurocytes Western blot analysis indicated that LBP markedly downregulated the protein level of NFκB p65 ELISA indicated that LBP decreased the levels of TNFα, IL6 and IL1β in the serum 24 h after reperfusionIn conclusion, LBP has protective effects on cerebral ischemia reperfusion injury in mice, and this effect may be associated with inhibiting NFκB and inflammatory reactions
[Key words]LBP; cerebral ischemia; nuclear factor κB; tumor necrosis factorα; interleukin6; interleukin1β
脑梗死是临床常见病和多发病,具有极高的病死率和致残率,其病理机制复杂,目前临床治疗效果不理想。脑梗死后一段时间缺血区域局部血流恢复,形成再灌注损伤,与再灌注有关的急性炎症反应促进了继发性脑损害的发展[1]。研究表明,NFκB是与缺血损伤密切相关的转录因子,NFκB活化后可促进多种炎性细胞因子的表达,从而加重脑损伤。枸杞多糖(Lycium barbarum polysaccharides,LBP)是从茄科植物枸杞的成熟果实中提取而得的一种水溶性蛋白杂多糖,具有多种药理作用[2]。最近Gao等[3]的研究表明,LBP通过调节海马神经元的凋亡和再生,从而提高脑外伤大鼠的认知能力;Yang等[4]亦报道,LBP通过保护血脑屏障对脑缺血再灌注引起的脑损伤产生保护作用,提示LBP在神经系统损伤中可能发挥重要作用。本实验采用線栓法建立小鼠局灶性脑缺血再灌注损伤模型,观察LBP对脑缺血再灌注损伤的保护作用,并探讨其可能的作用机制。
1材料
11动物健康6周龄ICR小鼠,清洁级,雄性,体重20~25 g,由南通大学实验动物中心提供。
12药物与试剂枸杞多糖(LBP,宁夏沃福百瑞生物食品工程有限公司);尼莫地平注射液(拜耳医药);2,3,5氯化三苯基四氮唑(TTC,国药集团化学试剂有限公司);NFκB p65(Cell Signaling Technology公司);βactin(Sigma公司);TNFα,IL6 和 IL1β试剂盒(美国ADL公司)。
13仪器SZM45体视显微镜(宁波舜宇);AL104电子天平(MettlerToledo公司);Elx800酶标仪(Biotek公司);超声细胞破碎仪(Sonics & Meterials 公司);蛋白定量仪(Biorad公司);power PAC 2000电泳仪(Biorad公司);MicroCL 21R离心机(Thermo Scientific,德国)。
2方法
21分组将实验小鼠随机分为6组,每组30只,分别为假手术组、MCAO模型组、LBP高剂量组(100 mg·kg-1)、LBP中剂量组(50 mg·kg-1)、LBP低剂量组(25 mg·kg-1)和尼莫地平组(4 mg·kg-1)组。各组动物腹腔注射给药,每天1次,连续7 d,末次给药1 h后进行手术。假手术组和模型组每次注射等量生理盐水,其余实验步骤与LBP干预组相同。
22小鼠脑缺血再灌注损伤(MCAO)模型的制备参考Longa等[5]的方法,制备小鼠脑缺血再灌注模型:用4%水合氯醛(350 mg·kg-1)将小鼠腹腔注射麻醉,仰卧位固定,注意保持呼吸通畅。乙醇棉球颈部消毒,用手术剪沿颈中打开1 cm左右的切口。在体视显微镜下钝性分离下颌下腺,游离右侧颈总动脉、颈外动脉及颈内动脉,颈总动脉上用一丝线扎紧。在颈外动脉与颈总动脉分叉处用丝线打一松结,将颈外动脉远端用丝线结扎,用电凝笔将颈外动脉熔断游离;用丝线将颈内动脉扎紧,用显微眼科手术剪刀将颈外动脉剪一小孔,将线栓通过小孔向下插入至颈外动脉,松开颈内动脉上的线结,将线栓缓慢向颈内动脉方向插入,直至感到阻力时即止,为防止出血,将颈外动脉上线结扎紧。颈部伤口常规缝合。缺血2 h后,将线栓拔出,使动脉血重新流通24 h。假手术组手术步骤同前,不插入线栓。术后将动物置于室温25~28 ℃,自由饮水、进食。
23神经症状评分小鼠脑缺血再灌注后24 h,采用Longa (0~4分)5分制[5]对小鼠的神经功能缺损进行评分,0分:活动正常,无神经功能障碍者;1分:左前肢不能完全伸直;2分:爬行时向左转圈者;3分:爬行时向左侧倾倒;4分:意识丧失,不能行走者。
24脑梗死体积的测定小鼠脑缺血再灌注后24 h,断头取脑,迅速置于-20 ℃冰箱中冷冻20 min后取出,去除嗅球、小脑和低位脑干,在操作台上将脑组织由前向后行20 mm厚的连续5片冠状切片,将脑片置于1%的TTC(1 mol·L-1 KH2PO4 01 mL)磷酸盐缓冲液中,37 ℃避光温浴30 min。用扫描仪按顺序扫描染色后的脑片,采用计算机软件系统测量脑梗死面积,并计算脑梗死区占大脑总体积的百分比。
25脑含水量测定小鼠脑缺血再灌注后24 h,快速断头取脑,称取左右大脑半球湿重,置于电热恒温干燥箱中110~115 ℃烘烤至恒重,称取干重。计算脑含水量,计算公式为:含水量=(湿质量-干质量)/湿质量×100%。
26苏木素伊红(HE)染色小鼠脑缺血再灌注后24 h,心脏灌流,断头取脑,4 ℃下置于4%多聚甲醛中过夜,后置于20%~30%蔗糖溶液中至组织块沉底。依次脱水、透明、浸蜡及包埋,用冰冻切片机切片,厚度为8 μm,4 ℃冰箱中保存备用。HE染色时将玻片浸泡于二甲苯及不同浓度的乙醇之后水洗,于苏木素中浸泡5 min,伊红中浸泡2 min,逐级乙醇脱水,中性树胶封片,显微镜下观察,摄片。
27Western blotting检测将取好的小鼠大脑缺血侧皮层组织置于08 mL细胞裂解液中,低温下超声匀浆。离心机中12 000 r·min-1,4 ℃离心10 min,分取上清液,置于-20 ℃冰箱中保存备用。取上述处理过的1 μL溶液,采用BCA法测定各组蛋白含量,用配制好的细胞裂解液按比例调整蛋白浓度。样品中加入上样缓冲液,混合均匀后于95 ℃变性处理5 min。上样,安排βactin参照,SDSPAGE电泳,电压110 V,分离蛋白质。电泳结束后,取出凝胶置于转移缓冲液中平衡,凝胶上的蛋白转移到硝酸纤维素膜上。转膜结束后,用TBST溶液洗膜,常温封闭1 h。封闭结束后,TBST溶液洗膜,将膜放入塑料袋中,按01 mL·cm-2加入一抗溶液(p65,βactin,1∶1 000,5%脱脂牛奶溶液),混匀后将塑料袋中的气泡去除,用封膜机封口,置于4 ℃中过夜。次日取出硝酸纤维素膜,用TBST溶液漂洗3次,每次10 min。在膜上加入荧光二抗(1∶2万,用5%脱脂牛奶稀释),室温下杂交炉中轻轻振荡l h,取出膜,PBS溶液中洗膜3次,每次10 min。用Odyssey Western blot机器扫描获取Western条带图片。
28ELISA检测血清TNFα,IL6和IL1β的水平小鼠脑缺血再灌注后24 h,腹主动脉取血6 mL,室温静置4 h后离心(3 000 r·min-1,5 min)。取上清,采用ELISA试剂盒检测血清中的含量。具体操作按照试剂盒上的方法步骤进行。
29统计学处理实验结果以±s表示,采用SPSS 180软件中的相应程序分析处理数据,各组数据采用单因素方差分析(Oneway ANOVA)统计学分析后,2组间比较应用t检验。P<005为统计学差异有显著性。
3结果
31LBP对脑缺血再灌注小鼠脑梗死范围的影响缺血再灌 24 h后,假手术组小鼠脑组织没有梗死灶,与假手术组比较MCAO组脑组织梗死百分比显著升高;与MCAO组相比,给药组LBP高、中剂量组及尼莫地平组脑梗死范围明显减小(P<001或P<005),提示LBP对小鼠缺血再灌注脑损伤有保护作用,见图1。
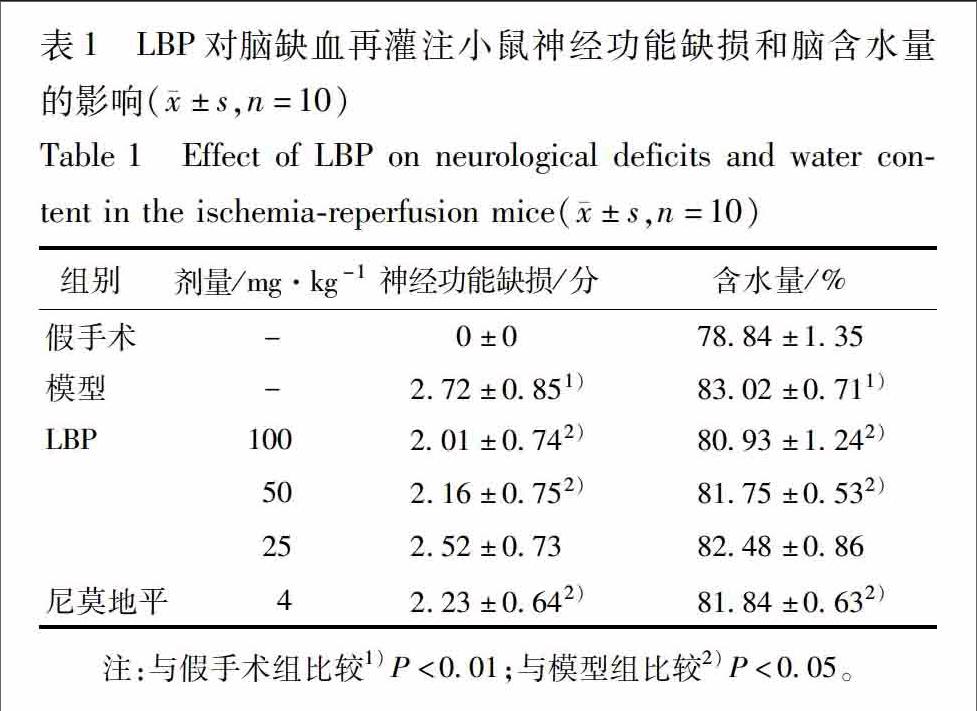
32LBP对脑缺血再灌注小鼠神经功能缺损的影响缺血再灌24 h后,假手术组小鼠行为正常,无神经功能缺损症状。MCAO组小鼠均出现明显的神经行为缺陷症状,给药组LBP高、中剂量组及尼莫地平组能明显减轻小鼠神经症状(P<005),提示LBP对缺血再灌注小鼠神经损伤有明显改善作用,见表1。
33LBP对脑缺血再灌注小鼠脑含水量的影响缺血再灌24 h后,与假手术组比较MCAO组小鼠脑含水量明显升高(P<001),给药组LBP高、中剂量组及尼莫地平组与MCAO组比较脑含水量明显降低(P<005),提示LBP能够抑制缺血再灌注损伤引起的脑水肿,见表1。
34LBP对脑缺血再灌注小鼠大脑皮层神经元形态结构的影响光镜下可见假手术组小鼠缺血侧大脑皮层神经细胞结构完整,排列整齐、致密,细胞呈圆形或椭圆形,模型组小鼠缺血侧大脑皮层神经细胞大量变性坏死、萎缩,细胞分布不均匀,细胞核与细胞质界限不清晰,胞核破碎或消失。与模型组相比,小鼠脑缺血再灌注后24 h,LBP干预组及尼莫地平组均可不同程度的改善缺血侧大脑皮层神经元形态,坏死与凋亡的细胞数量减少。其中LBP高剂量组效果较显著,而低剂量组的效果不明显,见图2。
35LBP对脑缺血再灌注小鼠大脑皮层NFκB p65蛋白表达的影响小鼠脑缺血再灌注后24 h,与假手术组相比,MCAO组小鼠大脑皮层缺血区p65蛋白表达明显增高。LBP高、中剂量组p65蛋白水平较MCAO组显著降低(P<001,P<005)。提示LBP能够抑制缺血损伤小鼠大脑皮层NFκB表达的增高,见图3。
36LBP对脑缺血再灌注小鼠血清TNFα,IL6和IL1β的影响与假手术组相比,小鼠脑缺血再灌注后24 h,模型组小鼠血清TNFα,IL6和IL1β水平均明显升高,与模型组比较,LBP高、中、低剂量组均可明显降低小鼠的血清TNFα和IL1β含量,LBP高、中剂量组可明显降低小鼠血清IL6含量,见表2。
4讨论
在缺血性脑血管病的治疗中,恢复缺血区的血流或加强对缺血区的血流供应是减轻缺血对中枢神经系统细胞结构和功能损伤的必要条件。但是,大量研究表明,如果脑血流的疏通和恢复超过一定的时间点,不仅不能改善缺血引起的组织损伤和功能障碍,反而会造成神经损伤进一步加重,这种现象即缺血再灌注损伤。抑制再灌注损伤是治疗缺血性
脑血管病的重要环节[67]。本研究采用小鼠短暂性局灶性大脑中动脉阻塞模型观察LBP对脑缺血再灌注损伤的作用,结果显示LBP不但能够改善缺血再灌注损伤小鼠的神经功能障碍,而且能减小脑梗死体积,降低脑水肿的程度,病理切片也表明LBP可明显改善脑缺血后神经元的损伤,说明LBP干预对小鼠脑缺血再灌注损伤具有保护作用。
脑缺血后,炎症、凋亡、氧化应激、兴奋性毒性等多种因素相互作用,相互影响,从而加剧神经损伤的发生、发展[8]。近年来,核因子κB (nuclear factor kappa B,NFκB)信号通路激活在缺血性脑中风引起的神经细胞死亡中的作用倍受关注,成为治疗缺血性脑血管病一个重要靶点[910]。NFκB是介导细胞增殖分化、细胞炎症、凋亡和免疫应答等作用的
关键性转录因子,大脑中的NFκB主要由p65和p50亚单位组成,参与调节体内的细胞因子、炎症分子、各种受体、蛋白等基因的表达和调控。脑缺血损伤时,NFκB在濒临死亡的神经细胞中被激活,通过促进炎症因子和促凋亡蛋白生成等许多潜在途径诱导细胞死亡,从而在缺血性脑损伤病理过程中发挥重要作用[11]。本实验中发现缺血再灌损伤后,小鼠大脑皮层缺血区NFκB p65蛋白表达明显增高,NFκB被激活,LBP能显著抑制缺血损伤引起的NFκB蛋白表达的增高,从而抑制NFκB的激活,可能是其发挥神经保护作用的機制之一。
研究表明,脑缺血后NFκB等转录因子的激活使脑组织中的炎症细胞如单核巨噬细胞、中性粒细胞、内皮细胞等迅速活化,大量表达炎性细胞因子如TNFα,IL6,IL8,IL1β等,这些炎性细胞在发挥吞噬作用、免疫作用的同时,向细胞外释放大量氧自由基、细胞因子、溶酶体酶等炎症介质,加重脑组织损伤,引起脑缺血再灌注损伤[12]。本实验中发现缺血再灌损伤后,小鼠血清TNFα,IL6和IL1β水平均明显升高,LBP能显著抑制缺血损伤引起的血清TNFα,IL6和IL1β水平的增高,提示LBP具有调节缺血损伤后炎症因子的生成,改善脑组织的微环境,从而减轻脑组织的病理损伤及缺血带来的神经功能障碍,从而起到对脑缺血损伤的保护作用。
[参考文献]
[1]Mohamed R A, Agha A M, AbdelRahman A A, et al Role of adenosine A2A receptor in cerebral ischemia reperfusion injury: signaling to phosphorylated extracellular signalregulated protein kinase (pERK1/2) [J] Neurosci, 2016, 314:145
[2]Cheng J, Zhou Z W, Sheng H P, et al An evidencebased update on the pharmacological activities and possible molecular targets of Lycium barbarum polysaccharides[J] Drug Des Dev Ther, 2015,9:33
[3]Gao J, Chen C, Liu Y, et al Lycium barbarum polysaccharide improves traumatic cognition via reversing imbalance of apoptosis/regeneration in hippocampal neurons after stress[J] Life Sci, 2015, 121:124
[4]Yang D, Li S Y, Yeung C M, et al Lycium barbarum extracts protect the brain from bloodbrain barrier disruption and cerebral edema in experimental stroke[J] PLoS ONE, 2012,7(3):e33596
[5]Longa E Z, Weinstein P R, Carlson S,et al Reversible middle cerebral artery occlusion without craniectomy in rats[J] Stroke, 1989, 20:84
[6]Eltzschig H K, Eckle T Ischemia and reperfusionfrom mechanism to translation[J] Nat Med, 2011, 17:1391
[7]Nagy K, Domoki F, Bari F Ischemic preconditioning in the brain[J] Ideggyogy Sz, 2005, 58:305
[8]Zhang J, Fang X, Zhou Y, et al The possible damaged mechanism and the preventive effect of monosialotetrahexosylganglioside in a rat model of cerebral ischemiareperfusion injury[J] J Stroke Cerebrovasc Dis, 2015, 24(7): 1471
[9]Sinke A P, Javakumar A R, Panickar K S, et al NFKappa B in the mechanism of ammoniainduced astrocyte swelling in culture[J] J Neurochem, 2008, 106: 2302
[10]Tounai H, Hayakawa N, Kato H, et al Immunohistochemical study on distribution on NFkappa B and p53 in gerbil hippocampus after transient cerebral ischemia: effect of pitavastatin[J] Metab Brain Dis, 2007, 22: 89
[11]Ridder D A, Schwaninger M NFkappaB signaling in cerebral ischemia[J] Neurosci, 2009, 158(3): 995
[12]Tu X K, Yang W Z, Chen J P, et al Curcumin inhibits TLR2/4NFkappaB signaling pathway and attenuates brain damage in permanent focal cerebral ischemia in rats[J] Inflammation, 2014, 37(5): 1544
[責任编辑张宁宁]
[收稿日期]20160626
[基金项目]国家自然科学基金青年基金项目(31500822);南通市社会事业科技创新与示范计划项目(HS2013020)
[通信作者]*吴锋,博士,副教授,Tel:(0513)85554335,Email:cuileish@163com

