采用HPLC法同时测定宫瘤清颗粒中大黄素、大黄酚的含量
戴希希
采用HPLC法同时测定宫瘤清颗粒中大黄素、大黄酚的含量
戴希希
目的 采用高效液相色谱法(HPLC)同时测定宫瘤清颗粒中大黄素、大黄酚的含量。方法 采用色谱柱为Kromasil C18(250mm×4.6mm,5μm),以甲醇-水(75∶25)为流动相,流速1.0mL/min,检测波长为286nm,进样量20μL,样品用甲醇加热回流提取后,提取液蒸干,残渣加盐酸溶液(1︰10)溶解后加热回流,再用乙醚提取,提取液浓缩至干,残渣加甲醇溶解后作为供试品溶液。结果 大黄素的量在2.40~19.22μg/mL范围内(r=0.9996),大黄酚的量在5.48~43.80μg/mL范围内(r=0.9992)峰面积积分值与含量呈良好的线性关系,平均回收率分别为98.4%、98.1%。结论该方法精密度好,结果准确、可靠,灵敏度高,可用于宫瘤清颗粒中大黄素、大黄酚含量的同时测定。
宫瘤清颗粒;高效液相色谱法;大黄素;大黄酚;含量测定
江西山高制药有限公司生产的宫瘤清颗粒为全国独家品种,主要组成药材为熟大黄、桃仁、蒲黄、枳实、牡蛎、地黄、白芍、甘草等11味中药[1-4],该药具有活血逐瘀、消癥破积、养血清热等功效,该药现行标准为国家食品药品监督管理局标准YBZ06132008。该药中熟大黄具有清湿热、泻火、凉血、祛瘀、解毒等作用。本实验对现行标准进行了提高,采用HPLC法测定该药处方中熟大黄的有效化学成分——大黄素和大黄酚的含量,建立HPLC法测定宫瘤清颗粒中所含大黄素和大黄酚含量的同时测定方法。
1 仪器与材料
1.1 实验仪器 美国waters2695e HPLC仪(2489uv检测器);电子天平(1/10万,德国赛多利斯BP-211D)。
1.2 药品与试剂 大黄素对照品(批号:110756;来源:中检院),大黄酚对照品(批号:110796-201118;来源:中检院,含量99.5%);宫瘤清颗粒(江西山高制药有限公司,批号:20131107、20140204、20140402、20140405、20140704);甲醇为色谱纯,AR级乙醚及盐酸。
2 实验方法与结论
2.1 高效液相色谱系统条件 色谱柱:瑞典(Akzo Nobel) Kromasil C18液相色谱柱(250mm×4.6mm,5μm);流动相为甲醇︰水(75︰25);流速为1.0mL/min;检测波长为286.0nm;进样量20μL[1]。
2.2 对照品溶液的制备方法 精密称取大黄素对照品约10mg及大黄酚对照品约20mg,置同一100mL量瓶中,加甲醇溶解并稀释至刻度,摇匀后,用移液管精密量取10mL置100mL容量瓶中,加甲醇溶解并稀释至刻度,摇匀即得[5-6]。
2.3 供试品溶液的制备方法 取10袋宫瘤清颗粒,精密称定内容物后,研匀,精密称定细粉(约2g),置锥形瓶中,加甲醇30mL,置水浴上加热回流30min,放冷,滤入50mL量瓶中,用甲醇20mL分次洗涤残渣及滤器,洗液并入同一量瓶中,加甲醇稀释至刻度,摇匀,精密量取20mL,蒸干,残渣加盐酸溶液(1︰10)10mL溶解,置水浴上加热回流20min,立即冷却,用乙醚振摇提取4次(20mL 2次、10mL 2次),合并提取液,浓缩至干,残渣加甲醇充分溶解,摇匀后移至10mL容量瓶中,用甲醇稀释至刻度,摇匀,用定量滤纸过滤,取续滤液用微孔滤膜过滤[1]。
2.4 干扰试验 采用宫瘤清颗粒处方(剔除熟大黄),依法制备阴性对照样品,采用“2.3”方法制备阴性对照溶液。结果阴性对照溶液(色谱图中10~12min处)在与供试品溶液中大黄素峰与大黄酚峰(2峰分离度大于2)相同的保留时间处无色谱峰,供试品溶液中大黄素峰及大黄酚峰保留时间均在10min之后,且与其他成分分离好,表明在此条件下,处分中其他药材的成分对该测定无干扰。色谱图见图1~图3。

图1 对照品色谱图
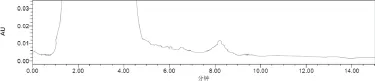
图2 阴性对照色谱图
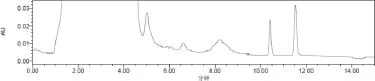
图3 样品色谱图
2.5 线性关系考察 精密称取大黄素对照品约25mg及大黄酚对照品约50mg,置同一100mL量瓶中,加甲醇溶解并稀释至刻度,摇匀后,用移液管精密量取10mL置100mL容量瓶中,加甲醇溶解并稀释至刻度,摇匀,即得每毫升约含大黄素25μg、大黄酚50μg的混合溶液,分别量取此溶液1.0、2.0、4.0、6.0、8.0mL至10mL量瓶中,加甲醇稀释至刻度,摇匀,依照色谱条件测定,绘制工作曲线,得回归方程:
大黄素为Y=33802X+3244.8,r=0.9996;大黄酚为Y=29873X-3143.2,r=0.9992
表明大黄素在2.40~19.22μg/mL之间,大黄酚在5.48~43.80μg/mL之间,有良好的线性关系。
2.6 精密度试验 将同一对照品溶液,进样6次,测定大黄素及大黄酚的峰面积,RSD分别为0.21%、0.30%,表明该方法精密度符合药典要求。
2.7 耐用性试验 将同一供试品溶液,依次在0~12h内(常温下每隔2h进样1次)测定大黄素的峰面积及大黄酚的峰面积。结果测得平均峰面积分别为662138、920157;RSD分别为0.26%、0.29%,表明12h内供试品中大黄素及大黄酚基本稳定。
2.8 重复性试验 取同一批号供试品(批号:20140405),按“2.3”方法进行含量测定,大黄素、大黄酚的平均含量分别为0.96、1.51mg/袋,RSD为1.6%(n=6)。
2.9 回收率试验 精密称取已知大黄素、大黄酚含量的供试品(批号:20140405)约1.0g,共5份,分别精密加入10mL 0.02402mg/mL的大黄素对照品溶液及10mL 0.03285mg/ mL的大黄酚对照品溶液,按“2.1”方法操作,计算回收率。结果见表1、表2。
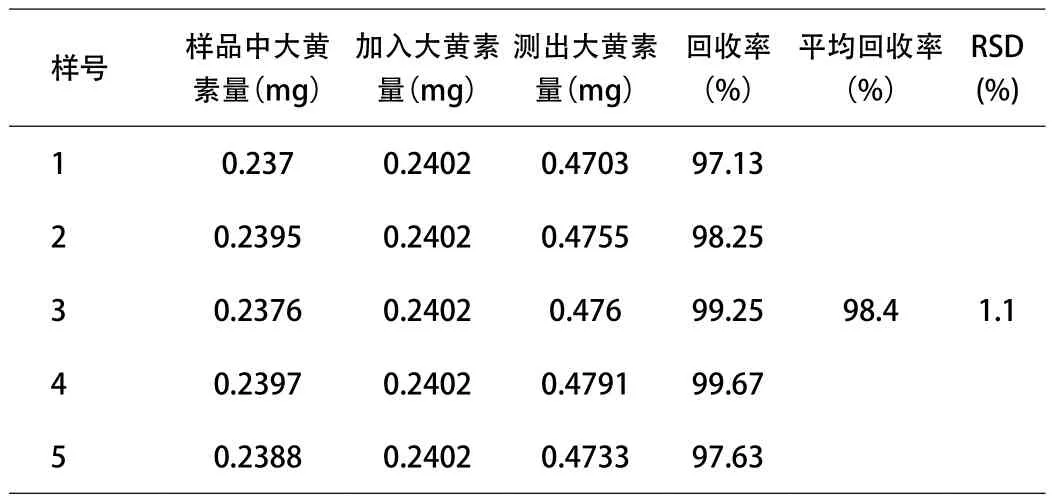
表1 回收率测定结果(大黄素)
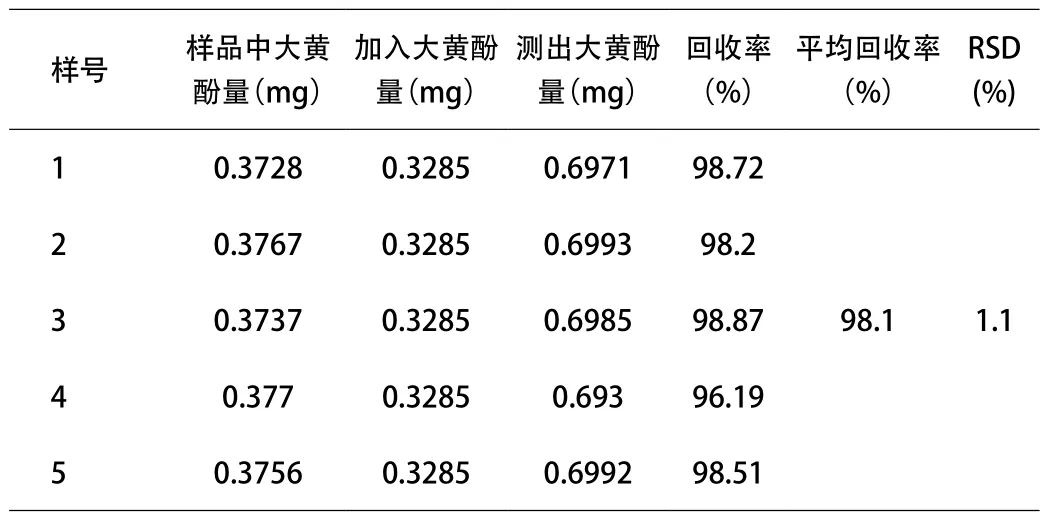
表2 回收率测定结果(大黄酚)
2.10 样品含量测定 取5份不同批号的供试品,按“2.3”方法操作,结果见表3、表4。

表3 大黄素测定结果

表4 大黄酚测定结果
3 讨论
3.1 该药的国家药品标准YBZ06132008【含量测定】中有大黄素的含量测定方法,但未同时对大黄酚进行测定,此2种化学成分虽较为接近,但能在液相色谱同一色谱条件中有效地分开[7-8]。
试验表明,在该色谱条件下,此2种化学成分分离度较好,符号药典要求。
3.2 本试验前处理较为复杂,曾摸索了各种选择试验以期简化,但提取此2种化学成分均不够完全,故最后确定取样2g,加热回流提取,以甲醇-水(75︰25)为流动相为最佳方案。
本试验方法操作简便、准确,具有良好的专属性、重现性与稳定性,认为可用于宫瘤清颗粒质量控制。
[1] 国家药典委员编.中国药典(二部)[S].北京:化学工业出版社,2010:963.
[2] 国家食品药品监督管理局.国家药品标准YBZ06132008.
[3] 王鼎峰,胡冰.HPLC法测定宫瘤清片中苦杏仁苷、黄芩苷的含量[J].海峡药学,2014,26(5):40-43.
[4] 许乾丽,茅向军,宋晓宁,等.HPLC法同时测定六味安消胶囊中芦荟大黄素、大黄酸、大黄素、大黄酚和大黄素甲醚的含量[J].药物分析杂志,2010,30(10):1841-1844.
[5] 毕云生,范云飞,王英萍,等.HPLC法同时测定消氮颗粒中芦荟大黄素、大黄酸、大黄素、大黄酚和大黄素甲醚五种成分的含量[J].解放军药学学报,2014,30(4):324-326.
[6] 方既明,章怀奋.高效液相色谱法同时测定麻仁丸中大黄素、大黄酚、大黄酸、大黄素甲醚、芦荟大黄素的含量[J].中南药学, 2011,9(5):342-345.
[7] 何素琴,欧阳吉德,肖琳.HPLC法测定胆石通胶囊中芦荟大黄素、大黄酸、大黄素、大黄酚及大黄素甲醚的含量[J].西北药学杂志, 2011,26(3):180-182.
[8] 薛小平,鹿燕敏,王倩,等.HPLC法测定清热解毒方芦荟大黄素、大黄酸、大黄素、大黄酚及大黄素甲醚的含量[J].中国实验方剂学杂志, 2009,15(7):6-8.
10.3969/j.issn.1009-4393.2016.6.101
江西 344000 抚州市食品药品检验所 (戴希希)
——一个解释欧姆表刻度不均匀的好方法

