自噬在高磷诱导的大鼠血管平滑肌细胞钙化过程中的作用研究
邱翠婷,郑海军,余文军,李爱琴,李寰,吕安林
自噬在高磷诱导的大鼠血管平滑肌细胞钙化过程中的作用研究
邱翠婷,郑海军,余文军,李爱琴,李寰,吕安林*
摘要
目的:探讨自噬在高磷诱导的大鼠血管平滑肌细胞(VSMC)钙化过程中的作用。
方法:采用磷酸盐(3.2 mmol/L Pi,即高磷状态)建立大鼠VSMC钙化模型。实验分为三组:对照组、钙化组(分为3个亚组:3.2 mmol/L Pi 4 d组、3.2 mmol/L Pi 6 d组、3.2 mmol/L Pi 8 d组);钙化+3-甲基腺嘌呤(3-MA)组(3.2 mmol/L Pi 8 d+5 mmol/L 3-MA)。分别通过茜素红S染色法和邻甲酚肽络合酮比色法检测各组细胞钙结节形成及钙含量;蛋白免疫印迹法检测各组细胞转录因子蛋白(Runx2)、α-肌动蛋白(α-SMA)和自噬相关蛋白—膜型微管蛋白1轻链3β(LC3Ⅱ)蛋白表达量。透射电子显微镜观察VSMC内自噬小体形成情况。免疫荧光显微镜下观察VSMC中LC3和Runx2定位表达。
结果:与对照组相比,3.2 mmol/L Pi 8 d组钙结节、钙含量、Runx2和LC3Ⅱ蛋白表达量及自噬小体均显著增高,α-SMA蛋白表达量降低,差异具有统计学意义(P<0.05)。与3.2 mmol/L Pi 8 d组相比,钙化+3-MA组细胞钙含量增多,LC3荧光分布量降低,Runx2阳性细胞数增多,差异具有统计学意义(P<0.05)。
结论:自噬在磷酸盐诱导的VSMC钙化过程中具有保护作用。
关键词自噬;磷酸盐类;肌,平滑;钙质沉着症
作者单位:454000河南省,焦作市人民医院心内科(邱翠婷、郑海军、李爱琴);中国人民解放军517医院内科(余文军);中国人民解放军第四军医大学第一附属医院心内科(李寰、吕安林)
(Chinese Circulation Journal,2016,31:484.)
线粒体是细胞内活性氧的主要来源,当细胞受到损伤时,线粒体的电子传递链发生异常,可能会导致活性氧簇(ROS)的进一步积聚和线粒体的损伤。受损、衰老、功能紊乱的线粒体破坏细胞稳态,可能导致三磷酸腺苷无法水解,产生过量ROS,并释放死亡相关蛋白[1]。机体存在的线粒体自噬正是清除受损线粒体,维持线粒体质量和数量平衡的一种溶酶体依赖性的胞内降解途径[2]。
动脉钙化是由多种病理因素引起的主动、可调控的“异位成骨样”过程,与正常骨骼中骨形成过程相似。糖尿病、慢性肾功能不全、高脂血症以及衰老等可造成体内代谢产物的堆积,如糖基化终末产物、无机磷、氧化低密度脂蛋白等,引起血管壁细胞受到氧化应激损伤(线粒体损伤)[3],ROS的增加可激活血管平滑肌细胞(VSMC)转录因子蛋白(Runx2)成骨信号途径,使血管平滑肌细胞由收缩表型转化为具有合成和分泌功能的成骨细胞样表型[4]。
本研究旨在探讨自噬在VSMC钙化过程中发挥的作用,是否通过吞噬、降解受损的线粒体,减少ROS的释放,从而抑制VSMC的钙化。
1 材料与方法
材料与主要试剂:雄性SD大鼠30只,体重80~100 g,购自第四军医大学实验动物中心。磷酸氢二钠、磷酸二氢钠(Sigma,美国);DMEM培养基(Hyclone,中国北京);胎牛血清(FBS,Hyclone,美国);茜素红S(Sigma,美国);钙测定试剂盒(邻甲酚肽络合酮比色法,北京中生北控生物公司);兔来源多克隆抗甘油醛-3-磷酸脱氢酶(GAPDH)抗体(Proteintech,中国上海);兔来源单克隆抗α-肌动蛋白抗体(α-SMA)(Sigma,美国);兔来源单克隆抗Runx2抗体(Cell Signaling Technology,美国);兔来源单克隆抗膜型微管蛋白1轻链3β (LC-3Ⅱ)抗体(Cell Signaling Technology,美国)。
大鼠VSMC培养:无菌条件下分离大鼠胸主动脉,4℃预冷的无菌磷酸盐缓冲液(PBS,pH =7.4)清洗分离的胸主动脉3次,完整剥去外膜,将血管剪成2 mm长的动脉环接种于细胞培养瓶中,置于37℃含5%二氧化碳孵箱中并用高糖DMEM培养基培养(含45 g/L葡萄糖,100 U/L青霉素及链霉素,20%胎牛血清)。经形态学和免疫组织化学法鉴定为VSMC。实验取用3~8代的VSMC[5]。
VSMC钙化模型建立与实验分组:将细胞以1×104/L 接种于24孔板中或以5×104/L接种于6孔细胞培养板中,待细胞贴壁后用含磷酸盐的DMEM培养基诱导VSMC 8 d(终浓度为3.2 mmol/L,NaH2PO4+Na2HPO4,Pi),每2 d更换一次培养基[6]。分别将正常培养的VSMC随机分组:对照组;钙化组(3.2 mmol/L Pi 4 d组、3.2 mmol/L Pi 6 d组、3.2 mmol/L Pi 8 d组);钙化+3-甲基腺嘌呤(3-MA)组(3.2 mmol/L Pi 8 d+5 mmol/L 3-MA)。
细胞钙化检测:(1)茜素红S染色法:细胞干预8 d后,PBS洗涤3次,4%多聚甲醛固定细胞20 min,加入1%茜素红S溶液,室温下孵育20 min后,PBS洗涤细胞3次,普通光学显微镜下观察钙结节被染成红色[7]。(2)细胞钙沉积含量检测(邻甲酚酞络合酮比色法):每组设3个复孔,细胞干预8 d后,4℃PBS洗涤3次,每孔加入1 ml盐酸(0.6 mol/L)进行细胞脱钙,次日收集盐酸检测其钙含量。将6孔板中的细胞洗涤3次,加入1 M NaOH/0.1% SDS裂解细胞,提取上清液,BCA法检测细胞蛋白含量。结果以钙含量/蛋白含量表示[5]。
VSMC内自噬体形成检测:VSMC经钙化培养基干预后,用0.25%胰蛋白酶消化,67.08 g离心5 min,迅速倾去部分培养基,重悬细胞并移入500 μl离心管中,67.08 g离心5 min,吸除上清液并迅速加入2%戊二醛固定细胞,4℃固定24 h,经脱水、浸透、包埋、修块、切片、染色、制半薄切片后在透射电子显微镜下观察自噬小体形成情况。每组3孔,每张片子观察20个视野。
细胞免疫荧光检测:细胞以1×104/L接种于激光共聚焦专用培养皿中,待细胞贴壁后钙化培养基干预VSMC 8 d,4%多聚甲醛固定20 min,3‰的Triton-X100室温破膜15 min,山羊血清封闭液封闭1 h,Runx2抗体(1:50,PBS稀释)或LC-3Ⅱ抗体 (1:50,PBS稀释)覆盖细胞面,37℃水浴1h后放入4℃冰箱孵育过夜。次日,应用山羊抗兔Cy3或Dylight488荧光二抗室温孵育1.5 h(PBS稀释,1:100)。鬼笔环肽衬染细胞骨架(PBS稀释,1:150),4',6-二脒基-2-苯基吲哚(DAPI)染细胞核(PBS稀释,1:1),每个操作之后分别用PBS洗涤三次。50%甘油封片。激光共聚焦显微镜下分别观察大鼠VSMC Runx2蛋白呈红色荧光,LC-3Ⅱ蛋白呈绿色荧光。每张切片随机摄取20个视野,计数每个VSMC中的LC3Ⅱ荧光点的个数,或计数VSMC细胞核表达Runx2阳性细胞数,分别计算平均值。
蛋白免疫印迹法检测Runx2、α-SMA和LC-3Ⅱ蛋白表达水平:VSMC经钙化培养基干预8 d,4℃PBS洗涤3次,160~180 μl细胞裂解液裂解细胞,收集含有VSMC的细胞裂解混合液并移入EP管中,超声破碎仪进行超声破碎,裂解15 min后高速离心并收集上清液。BCA法测定蛋白浓度,计算各组上样量。配置8% 和12% SDS-PAGE凝胶,经电泳、转膜、5%牛奶封闭后,分别敷抗Runx2蛋白抗体(1:1000稀释)、抗α-SMA蛋白抗体(1:1000稀释)和抗LC-3Ⅱ蛋白抗体(1:1000稀释),4℃冰箱慢摇封闭一抗过夜。次日,敷抗GAPDH蛋白抗体(1:5000稀释,Abbinke),室温条件慢摇封闭1 h。应用UVP紫外激发光系统对硝酸纤维素膜(NC膜)进行激发光。用Image J软件分析照片中蛋白条带积分吸光度值,以目的蛋白值/内参蛋白值的比值反映目的蛋白相对水平。
2 结果
高磷对大鼠VSMC钙化及成骨转化标志物表达水平的影响(图1):在钙化组中,随着高磷诱导大鼠VSMC时间延长,钙结节逐渐增多,钙含量也逐渐升高,其中3.2 mmol/L Pi 6 d组和3.2 mmol/L Pi 8 d组大鼠的钙含量显著升高,与对照组相比差异具有统计学意义(P<0.05)。蛋白免疫印迹结果显示,在56 kDa(Runx2)和42 kDa(α-SMA)处分别可见特异性条带。各组目的蛋白灰度值与GAPDH(37 kDa)的灰度值比较计算相对灰度值。与对照组相比,钙化组3个亚组随着钙化培养基干预时间延长,大鼠成骨转化标志物Runx2蛋白表达水平逐渐升高,VSMC标志蛋白α-SMA表达水平逐渐降低,差异具有统计学意义(P<0.05)。
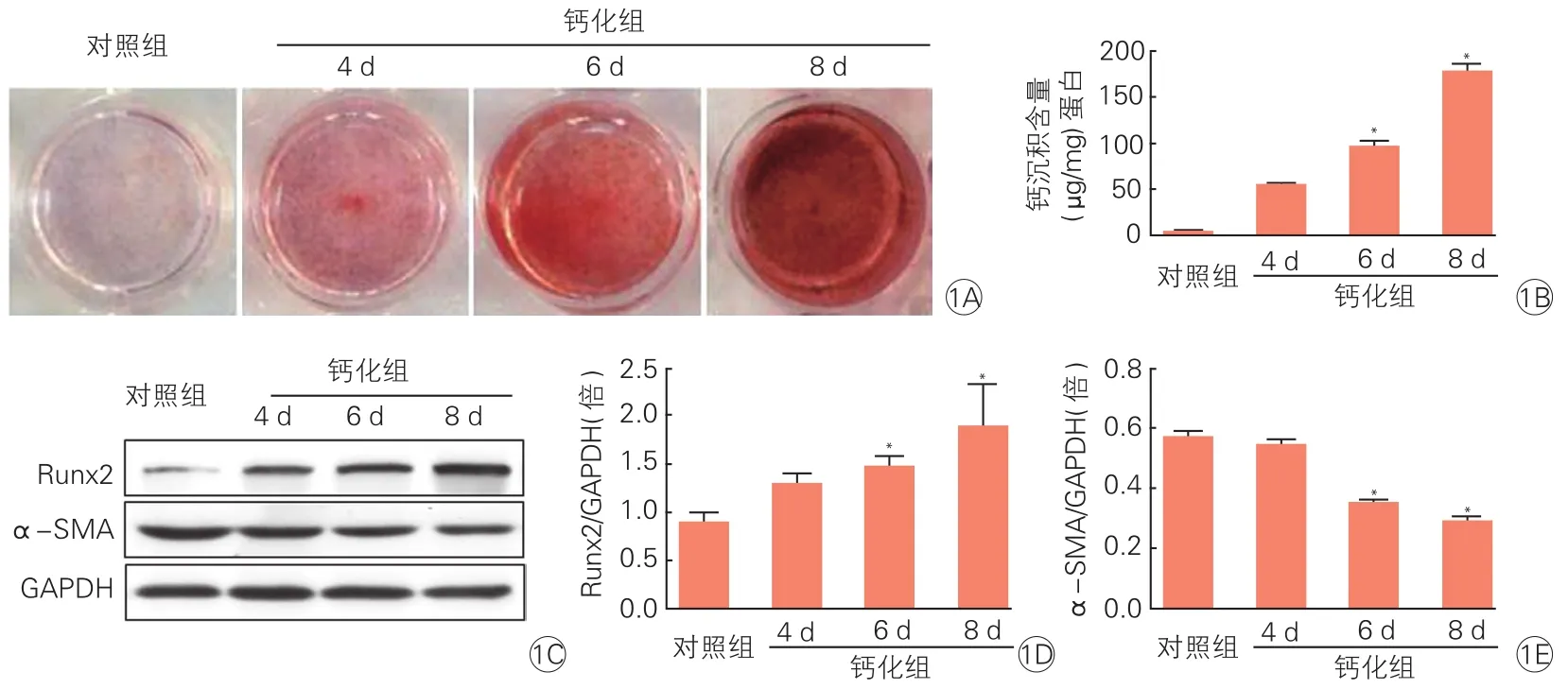
图1 高磷对大鼠血管平滑肌细胞钙化及成骨转化标志物表达水平的影响
高磷对大鼠VSMC自噬水平的影响(图2):与对照组相比,钙化组3.2 mmol/L Pi诱导VSMC钙化过程中大鼠自噬活性明显升高,具体表现为3.2 mmol/L Pi 6 d组和3.2 mmol/L Pi 8 d组大鼠的LC3Ⅱ蛋白表达水平上调;透射电子显微镜观察3.2 mmol/L Pi 8 d组大鼠VSMC自噬小体数量明显增多(14.67±4.50),与对照组(2.03±1.62)相比,差异均有统计学意义(P<0.05)。
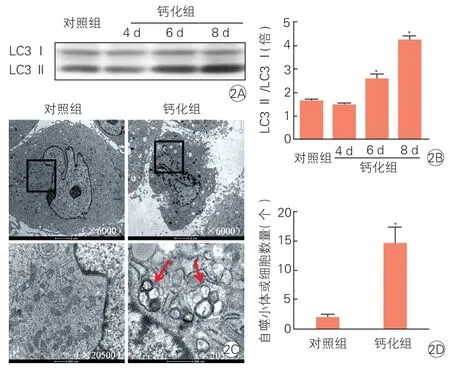
图2 高磷对大鼠血管平滑肌细胞自噬水平的影响
3-MA对大鼠VSMC自噬水平的影响(图3):与对照组相比,钙化组中3.2 mmol/L Pi 8d组大鼠LC3Ⅱ荧光分布明显上升,平均每个细胞(15.62±3.09)个,差异具有统计学意义(P<0.05);应用自噬抑制剂3-MA后,钙化+3-MA组大鼠LC3Ⅱ荧光分布明显减少,平均每个细胞(4.98±0.84)个,与钙化组中3.2 mmol/L Pi 8 d组相比差异具有统计学意义(P<0.05)。
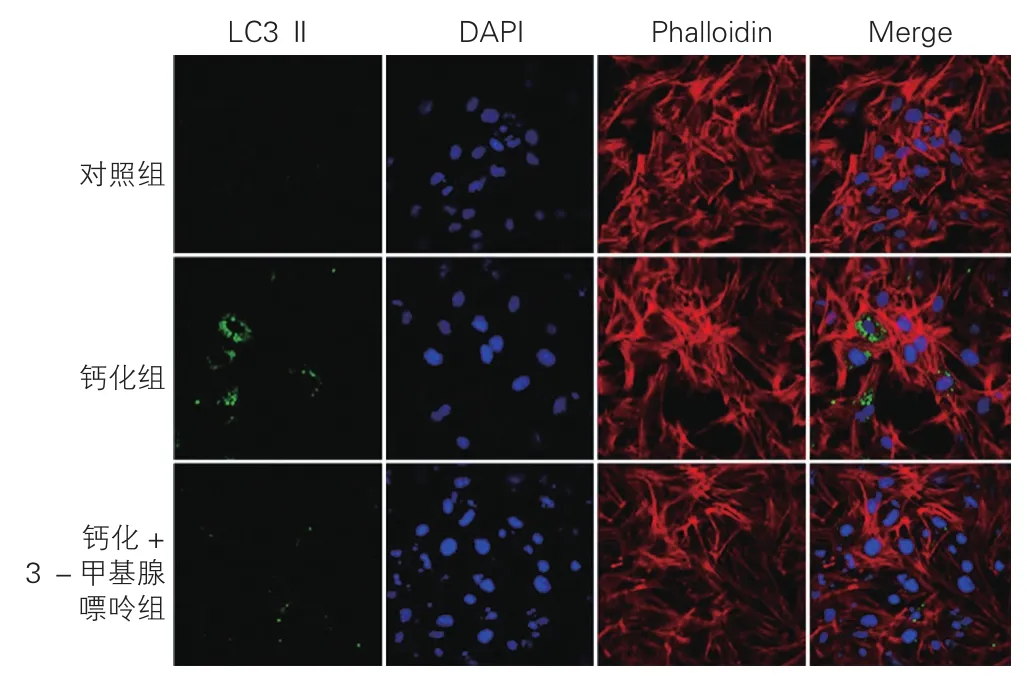
图3 3-MA对大鼠平滑肌细胞自噬水平的影响
3-MA对大鼠VSMC钙化与成骨标志物Runx2表达水平的影响(图4):与钙化组相比,钙化+3-MA组大鼠VSMC钙含量增加。与对照组相比,钙化组中3.2 mmol/L Pi 8d组大鼠VSMC中Runx2蛋白表达水平升高,表达Runx2阳性的细胞数为(35.4±7.16)个,差异具有统计学意义(P<0.05)。钙化+3-MA组大鼠VSMC Runx2表达阳性细胞数进一步增多,为(75.85±21.12)个,与钙化组中3.2 mmol/L Pi 8 d组相比具有统计学意义(P<0.05)。
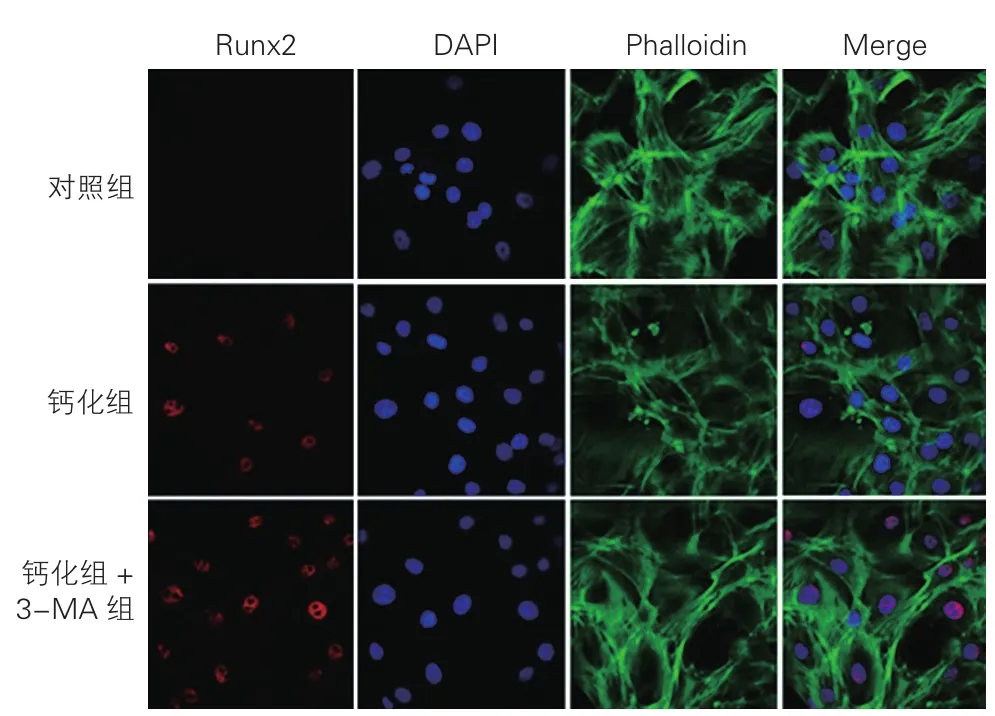
图4 激光共聚焦显微镜下观察对照组、钙化组和钙化+3-MA组大鼠VSMC内Runx2表达
3 讨论
动脉钙化过去被认为是一种被动的钙盐沉积过程,是不可逆转的退行性改变,这种认识阻碍了人们对治疗动脉钙化的进一步探索。近年来,一系列突破性研究让人们对动脉钙化本质认识发生了深刻转变。动脉钙化是由多种病理因素引起的主动、可调控的“异位成骨样”过程,与正常骨骼中骨形成过程相似[8]。因此,寻找能够有效控制VSMC成骨样转化和细胞外基质矿化的手段,是预防和治疗动脉钙化的关键。
自噬是存在于真核生物中一种溶酶体依赖性的自我降解途径,是细胞自身的一种防御和调控机制。细胞在应对外界刺激时会启动自噬程序,自噬小体将受损的细胞器吞噬并与溶酶体结合,降解成为氨基酸、核苷和脂肪酸等被细胞重新利用,合成新的分子或参与细胞器的合成,从而维持细胞的正常代谢和生存[9]。自噬分为3种类型:小自噬、大自噬和分子伴侣介导的自噬[10]。自噬也可分为选择性和非选择性自噬,其中选择性自噬包括线粒体自噬、胞质到液泡的靶向运输途径、过氧化物酶体自噬等。线粒体自噬是研究相对较多的一种选择性自噬,在ROS、饥饿状态、细胞衰老等外界刺激作用下,细胞内线粒体去极化出现损伤,损伤线粒体被特异性的包裹进自噬体中并与溶酶体融合、降解,从而维持细胞内环境的稳定,是一种保护机制[11]。
人体在衰老或罹患疾病时,细胞内线粒体受损伤,导致ROS大量蓄积,ROS能攻击蛋白质、脂肪酸和核酸并且启动氧化应激的连锁反应,进而促使机体出现血管钙化[12]。我们在研究中发现,在建立大鼠VSMC钙化模型中,随着磷酸盐诱导时间延长,VSMC钙化逐渐加重,成骨转录因子Runx2表达水平逐渐升高,同时细胞内自噬水平逐渐升高,主要表现为诱导第8天时LC3蛋白表达升高,自噬小体增多。自噬作为细胞内防御性调控机制,通过吞噬、降解损伤的线粒体从而降低氧化应激对细胞的损伤,从而通过减少ROS的释放抑制VSMC成骨样转化即抑制VSMC钙化形成。因此,自噬作为细胞水平的自我保护机制有可能成为防治动脉钙化的新靶点。
Dai等[6]发现在高磷诱导的血管钙化中,细胞自噬水平同时升高,而抑制细胞自噬则可导致平滑肌细胞释放更多基质囊泡,加重了钙化的进展。然而,利用丙戊酸外源性地诱导细胞自噬则能够部分抑制VSMC钙化。此外,Liu等[13]的研究发现,阿托伐他汀能够通过抑制β-链蛋白信号通路进而外源性地诱导细胞自噬行为,以抑制转化生长因子-β1诱导的VSMC钙化。我们在本研究中也发现,使用自噬抑制剂3-MA抑制细胞内自噬,大鼠VSMC钙化加重,同时VSMC成骨转录因子Runx2表达水平升高,与Dai等的研究结果相一致。上述结果提示,内源性的细胞自噬可能作为一种保护机制抑制动脉钙化。通过外源性的上调细胞自噬水平和活性是否能抑制血管钙化,有待于我们进一步深入研究。
参考文献
[1]Li L,Tan J,Miao Y,et al.ROS and autophagy:interactions and molecular regulatory mechanisms.Cell Mol Neuro Biol,2015,35:615-621.
[2]Salabei JK,Hill BG.Autophagic regulation of smooth muscle cell biology.Redox Biol,2014,4:97-103.
[3]孙洋.糖尿病冠状动脉硬化性心脏病中心肌损伤与氧化应激的关系.中国循环杂志,2014,29:952-954.
[4]Wu M,Rementer C,Giachelli CM.Vascular calcification:an update on mechanisms and challenges in treatment.Calcif Tissue Int,2013,93:365-373.
[5]Li H,Tao HR,Hu T,et al.Atorvastatin reduces calcification in rat arteries and vascular smooth muscle cells.Basic Clin Pharmacol Toxicol,2010,107:798-802.
[6]Dai XY,Zhao MM,Cai Y,et al.Phosphate-induced autophagy counteracts vascular calcification by reducing matrix vesicle release.Kidney Int,2013,83:1042-1051.
[7]邱翠婷,吕安林,李寰,等.钙磷诱导大鼠血管平滑肌细胞钙化的机制研究.中国循环杂志,2015,29:64-67.
[8]Sage AP,Tintut Y,Demer LL.Regulatory mechanisms in vascular calcification.Nat Rev Cardiol,2010,7:528-536.
[9]Nussenzweig SC,Verma S,Finkel T.The role of autophagy in vascular biology.Circ Res,2015,116:480-488.
[10]Narita M,Inoki K.Rags connect mTOR and autophagy.Small GTPases,2012,3:111-114.
[11]Yu L,McPhee CK,Zheng L,et al.Termination of autophagy and reformation of lysosomes regulated by mTOR.Nature,2010,465:942-946.
[12]Byon CH,Javed A,Dai Q,et al.Oxidative stress induces vascular calcification through modulation of the osteogenic transcription factor Runx2 by AKT signaling.J Biol Chem,2008,283:15319-15327.
[13]Liu D,Cui W,Liu B,et al.Atorvastatin protects vascular smooth muscle cells from TGF-beta1-stimulated calcification by inducing autophagy via suppression of the beta-catenin pathway.Cell Physiol Biochem,2014,33:129-141.
(编辑:朱柳媛)
Effect of Autophagy on Process of Phosphate Induced Vascular Smooth Muscle Cell Calcification in Experimental Rats
QIU Cui-ting,ZHENG Hai-jun,YU Wen-jun,LI Ai-qin,LI Huan,LV An-lin.
Department of Cardiology,Jiaozuo People’s Hospital,Jiaozuo (454000),Henan,China
Co-corresponding Authors:LI Huan,Email:lihuan816@yahoo.com and LV An-lin,Email:lvanlin@fmmu.edu.cn
Abstract
Objective:To explore the effect of autophagy on process of high phosphate salt induced vascular smooth muscle cell (VSMC) calcification in experimental rats.
Methods:Rats’ model of VSMC calcification was induced by phosphate incubation.VSMC were divided into 3 groups:①Control group,②Calcification group which included 3 subgroups as 4-day subgroup,the cells were cultured by 3.2 mmol/L phosphate for 4 days,6-day subgroup and 8-day subgroup,③Calcification+ 3-MA (autophagy inhibitor) group,in which the 8-day cells were cultured with 5mmol/L 3-MA.Calcium nodule formation and calcium deposition in VSMC were measured by Alizarin red staining and o-cresolphthaleincomplexone method,protein expressions of Runx2,α-SMA and LC3 II were examined by Western blot analysis,autophagosome formation in VSMC was measured by transmission electron microscope and the localization and expression of Runx2 and LC3 II in VSMC were observed by immunofluorescent microscope.
Results:Compared with Control group,the cells at 8-day subgroup showed more calcium nodules,higher calcium deposition,increased protein expressions of Runx2,LC3 II,more autophagosome and decreased α-SMA expression,all P<0.05.Compared with 8-day subgroup,the cells in Calcification+3-MA group presented increased calcium deposition,decreasedfluorescence distribution of LC3 II and more cells with positive Runx2 protein expression,all P<0.05.
Conclusion:Autophagy has the protective effect on process of phosphate induced VSMC calcification in experimental rats.
Key wordsAutophagy; Phosphate salts; Smooth muscle; Calcinosis
基金项目:国家自然科学基金(81170256);陕西省科技计划项目(2009K13-01)
作者简介:邱翠婷硕士研究生主要从事动脉钙化研究Email:qiucuiting87410@163.com通讯作者:李寰Email:lihuan816@yahoo.com吕安林Email:lvanlin@fmmu.edu.cn
中图分类号:R54
文献标识码:A
文章编号:1000-3614(2016)05-0484-05
doi:10.3969/j.issn.1000-3614.2016.05.016
收稿日期:(2015-09-09)

