超声心动图引导建立小型猪主动脉瓣反流模型的方法学研究
孙妍,王建德,李晓妮,张丽,张茗卉,唐越,贾六军,孟亮,王浩
超声心动图引导建立小型猪主动脉瓣反流模型的方法学研究
孙妍*,王建德,李晓妮,张丽,张茗卉,唐越,贾六军,孟亮,王浩
摘要
目的:研究如何应用超声心动图引导建立小型猪主动脉瓣反流模型。
方法:选用中华小型猪,静脉全麻后测量体重,并行超声心动图检查,排除主动脉瓣病变。将实验猪颈部小切口,暴露颈动脉,置入鞘管后送导管至主动脉窦部,用硬导丝穿出导管,调整导管位置,造成主动脉瓣损伤。超声评估主动脉瓣损伤情况及反流量。处死动物,取心脏,观察主动脉瓣损害情况。
结果:共入选中华小型猪7只,雄性4只,雌性3只,动物平均体重(24.7±3.6)kg。共5只顺利完成超声引导下主动脉瓣反流模型,造成少量反流1只,少-中量反流1只,中量反流2只,大量反流1只。其中4只造成瓣叶穿孔,1只造成瓣叶撕裂。
结论:(1)超声心动图可以顺利引导导丝穿过主动脉瓣并导致不同程度主动脉瓣损伤,用于小型猪主动脉瓣反流造模方法可靠。(2) 超声心动图可明确主动脉瓣损伤部位及损伤程度。
关键词模型,动物;超声心动描记术;主动脉瓣反流
作者单位:100037北京市,中国医学科学院北京协和医学院国家心血管病中心阜外医院超声科(孙妍、王建德、李晓妮、张丽、张茗卉、王浩),动物实验中心(唐越、贾六军、孟亮)
(Chinese Circulation Journal,2016,31:495.)
主动脉瓣反流是常见的心血管疾病之一。主动脉瓣反流的总体发病率Singh等[1]和Lebowitz等[2]的结果分别为4.9%和10%,显著的主动脉瓣反流明显影响患者生活质量及预期寿命[3]。无论是内科还是外科治疗主动脉瓣反流都需要了解不同程度主动脉瓣反流对心脏结构功能的影响及其自然进程,药物干预效果,手术时机选择等重要资料[4,5]。然而患者常有多种混杂因素[6],这些合并症使我们对疾病的分析增加了难度。应用动物造模是对单病种疾病发生发展规律研究的重要手段之一。由于超声可以实时观察导管等介入器材在心血管内位置,因而也被用于心脏造模过程中引导术者进行操作,同时还可以实时评估造模效果。我们希望通过本研究建立一种简单方便,无创及对操作者无放射损害的主动脉瓣反流造模方法。穿刺颈总动脉,置入6 F动脉鞘管,经动脉鞘置入5F猪尾导管,超声心动图引导导管至主动脉窦部并固定(图1)。置入硬导丝,超声心动图观察以确定硬导丝穿过猪尾导管上小孔。③建立主动脉瓣反流模型:猪尾导管停留在主动脉窦,超声心动图引导,用硬导丝刺穿主动脉瓣叶,超声心动图检测确定反流程度(图2)。④模型建立后完成超声检查,处死动物,取除心脏,观察主动脉瓣损伤情况(图3)。
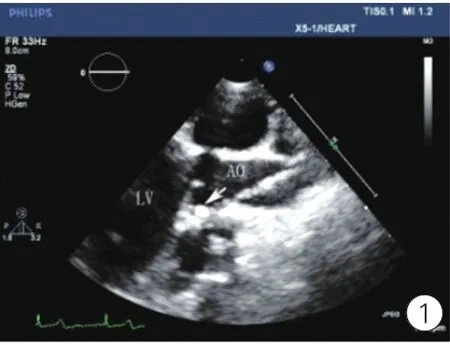
图1 胸骨旁左心室长轴切面,箭头所指为猪尾导管位置
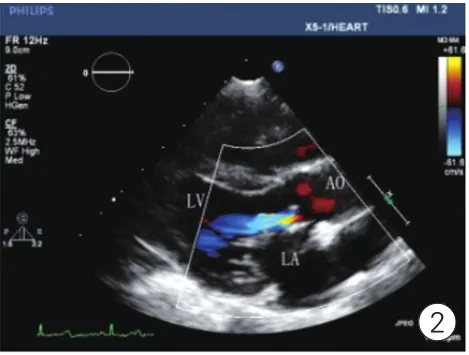
图2 胸骨旁左心室长轴切面彩色多普勒,主动脉瓣反流形成(LA:左心房;LV:左心室;AO:主动脉)
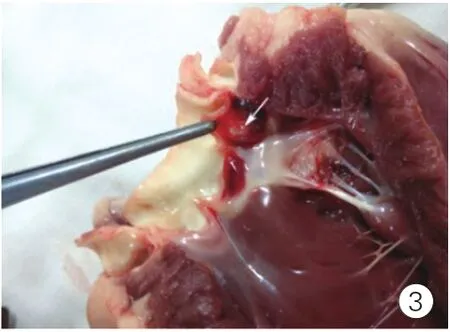
图3 猪心脏大体标本,箭头所指为穿孔部位
1 材料与方法
实验动物:2014-05至2014-12共入选中华小型猪7只,雄性4只,雌性3只,体重(24.7±3.6) kg,无微量以上主动脉瓣反流。实验动物由我院动物实验中心提供。本实验通过我院伦理委员会批准。
超声心动图图像采集及分析:经胸超声心动图使用飞利浦公司iE33机型,X5-1,基线和造模后均进行了全面心脏图像采集,包括M-型、二维超声及组织多普勒图像(TDI)。全部图像采集和分析全部由同一名操作者进行,图像分析应用飞利浦公司Qlab软件。
实验操作流程:(1)动物镇静及麻醉:①动物入选:按预定标准选取中华小型猪。②动物麻醉及肝素化:实验对象禁食禁水8 h以上,氟芬合剂2~3 ml/只皮下注射,戊巴比妥钠每只10 mg/kg皮下注射,建立气管插管并连接机械通气装置后用3:1氧化亚氮和氧气混合气体维持通气。静脉注入肝素8 000 U,后每隔1 h追加注射肝素2 000 U。③已麻醉好的中华小型猪固定在手术台上,心前区备皮,连接心电监护。(2)建立主动脉瓣反流模型:①超声观察双侧颈动脉,选较粗一侧为手术入路。②碘伏消毒颈部手术区域,做小切口,寻找并游离部分颈总动脉,
2 结果
共进行主动脉瓣反流造模实验7只猪,除1只为先天性心脏病,室间隔缺损外,其余6只猪心内结构均正常。由于本研究主要是方法学探索,因而没有排除具有室间隔缺损的猪。共5只顺利完成超声引导下主动脉瓣反流模型,1只由于未使用猪尾导管置入引导,硬导丝直接穿破左心室引起心包填塞,导致死亡。1只穿破主动脉左冠窦至左心房,形成主动脉左心房瘘,其余5只改为超声引导猪尾导管置入窦部,并固定,硬导丝穿刺主动脉瓣,均导致不同程度的主动脉瓣穿孔及反流,顺利完成超声引导下主动脉瓣反流模型,造成少量反流1只,少-中量反流1只,中量反流2只,大量反流1只。反流方向3只为偏心反流,2只为中心性反流。反流部位3只位于左冠窦,2只位于无冠窦。大体标本观察,主动脉左冠窦均有不同程度受损,表现为出血和水肿。2只损伤同时出现在左冠窦和无冠窦。瓣膜共4只出现穿孔,其中3只位于左冠窦,1只位于无冠窦,穿孔大小为1~3 mm。1只为无冠瓣瓣缘撕裂3.5 mm。受损瓣叶同超声判断一致。瓣膜损害程度与反流情况见表1。
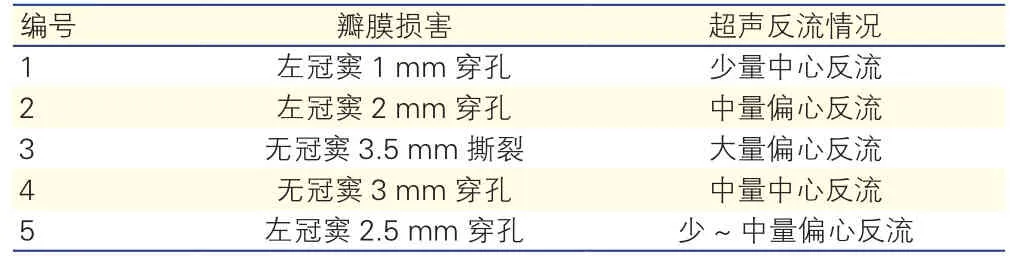
表1 瓣膜损害与瓣膜反流程度
3 讨论
目前,国内外主动脉瓣反流造模的方法主要集中在如下几个方面:(1)引导方式的选择上:通过X线引导及超声心动图引导[7];(2)入路选择上:开胸外科直视下造模[8],内科介入方法造模[9],通过某种食物(如,高胆固醇食物[10]等)喂养实验动物造模;在介入方法造模方面,穿刺的大动脉选择上也有不同,主要集中在股动脉[11]或颈总动脉[8,12];(3)制造主动脉瓣反流的方法:通过导丝在主动脉瓣上打孔制造反流[11],通过室间隔封堵器悬挂在主动脉瓣叶上制造反流[13];(4)模型动物选择上:有大鼠,兔,猪及狗等小型及大型动物。小型动物成本低,一般开胸操作,对进一步的研究有一定局限性;大型动物成本较高,但可采用介入手段造模,饲养后可观察药物疗效并且可以进行外科及介入治疗。尽管方法繁多,但这些方法制造的主动脉瓣反流主要缺点归结起来有:(1)通过X线引导造模,射线对操作者身体有一定损伤,需要杂交手术间,增加操作成本;(2)外科开胸直视下造模,死亡率高,破坏了原有的心脏结构,与实际患者主动脉瓣反流的发生情况不符;食物喂养干预造模,耗时长,主动脉瓣反流发生率低,且在机制探索上只能与该种因素相关,不能复制人类主动脉瓣反流的发生情况;(3)通过在主动脉瓣上打孔制造的主动脉瓣反流,通常其反流程度很轻,不能制造中重度主动脉瓣反流;通过在主动脉瓣叶上悬挂室间隔封堵器,通常只能制造重度主动脉瓣反流,且实验成本高,一旦主动脉瓣叶撕裂,封堵器脱落,可因栓塞使实验动物短时间内死亡。
我们所建立的模型具有以下优点:(1)操作简便,对操作者无伤害;(2)可重复性高;(3)能制造急性、慢性,轻、中、重度反流,以吻合人类主动脉瓣反流发生的不同病程和反流程度;(4)排除混杂因素,如不破坏除主动脉瓣外的原有心脏结构;(5)超声直视下引导导管放置位置,减少置管的盲目性,缩短手术时间并提高造模成功率;(6)对实验动物损伤小,可以保证术后长期存活,以利于观察慢性主动脉瓣反流所引起的一系列反应;(7)造模过程中及时准确评估反流量,判断是否达到预期目标,决定是否进一步操作还是完成造模;(8)相对于X射线引导下造模操作,该研究安全性能高,操作者及受试者无辐射损伤;手术成本低,不需要杂交手术间,不需要造影剂;对受试动物影响小,造模后如果观察药物治疗效果,X射线及造影剂可能会引起部分药物的药代动力学产生改变。
主动脉瓣反流模型的方法学确立,将有利于主动脉瓣反流研究的开展、推广和深入研究[14]。利用主动脉瓣反流动物模型可进行的研究包括:(1)了解不同病程和不同程度的主动脉瓣反流对左心室形态、结构和功能的影响,为患者选择最佳择期手术时机提供理论依据[15];(2)深入认识主动脉瓣反流,由于本方法进行造模没有破坏心脏结构,介入手术,对动物损伤较小,动物可以继续饲养,观察不同程度主动脉瓣反流进展情况,或分组给药,观察药物治疗效果;(3)该研究没有进行开胸手术,所以不影响经胸超声观察主动脉瓣反流情况。并可以通过超声心动图研究不同程度慢性主动脉瓣反流,各时间段对心脏结果功能,包括应变,扭转等多项参数研究;(4)了解主动脉瓣反流对冠状动脉循环的影响[16];(5)提高评估主动脉瓣反流量的准确性,拓展主动脉瓣反流量评估方式,如三维超声方法评估等;(6)为外科介入方法(TAVI)治疗主动脉瓣反流提供动物模型。本研究提示:(1)超声心动图可以顺利引导导丝穿过主动脉瓣并导致不同程度主动脉瓣损伤,用于小型猪主动脉瓣反流造模方法可靠;(2)超声心动图可明确主动脉瓣损伤部位及损伤程度。
参考文献
[1]Singh J,Evans J,Levy D,et al.Prevalenceand clinical determinants of mitral,tricuspid,and aortic regurgitation.Am J Cardiol,1999,83:897-902.
[2]Lebowitz NE,Bella JN,Roman MJ,et al.Prevalence and correlates of aortic regurgitationin American Indians:the Strong Heart Study.J Am Coll Cardiol,2000,36:461-467.
[3]Ross J Jr.Afterload mismatch in aortic and mitral valve disease:implications forsurgical therapy.J Am Coll Cardiol,1985,5:811-826.
[4]Hamirani YS,Dietl CA,Voyles W,et al.Acute aortic regurgitation.Circulation,2012,126:1121-1126.
[5]Gerald Maurer.Aortic regurgitation.Heart,2006,92:994-1000.
[6]明广华,张宇辉,吴海英,等.179例主动脉夹层患者的临床资料分析.中国循环杂志,2004,19:363-366.
[7]Plante E,Couet J,Gaudreau M,et al.Left ventricular response to sustained volume overload from chronic aorticvalveregurgitation in rats.J Card Fail,2003,9:128-140.
[8]Roscani MG,Polegato BF,Minamoto SE,et al.Left ventricularsphericity index predicts systolic dysfunction in rats with experimentalaortic regurgitation.J Appl Physiol,2014,116:1259-1262.
[9]Plante E,Lachance D,Beaudoin J,et al.Comparative study of vasodilators in an animal model of chronicvolumeoverload caused by severe aortic regurgitation.Circ Heart Fail,2009,2:25-32.
[10]Berry CJ,Miller JD,McGroary K,et al.Biventricular adaptation to volume overload in mice with aortic regurgitation.J Cardiovasc Magn Reson,2009,11:27.
[11]Zong GJ,Jiang HB,BaiY,et al.Percutaneousvalved stent implantation in the ascending aorta for the treatment of very high-risk aortic regurgitation:an animal study.J Surg Res,2013,185:940-944.
[12]Arsenault M,Plante E,Drolet MC,et al.Experimental aortic regurgitation in rats under echocardiographic guidance.J Heart Valve Dis,2002,11:128-134.
[13]陈翔,王飞宇,谭洪文,等.经导管建立大动物急性主动脉瓣关闭不全模型的实验研究.介入放射学杂志,2014,23:615-618.
[14]Bekeredjian R,Grayburn PA.Valvular heart disease:aortic regurgitation.Circulation,2005,112:125-134.
[15]Bonow RO.Aortic regurgitation:time to reassess timing of valve replacement? JACC Cardiovasc Imaging,2011,4:231-233.
[16]Rabkin SW.Differences in coronary blood flow in aortic regurgitation and systemic arterial hypertension have implications for diastolic blood pressure targets:a systematic review and meta-analysis.Clin Cardiol,2013,36:728-736.
(编辑:汪碧蓉)
Establishment of Aortic Regurgitation Model in Chinese Miniature Pigs Under Echocardiography Guidance
SUN Yan**,WANG Jian-de,LI Xiao-ni,ZHANG Li,ZHANG Ming-hui,TANG Yue,JIA Liu-jun,MENG Liang,WANG Hao.
Department of Echocardiography,Cardiovascular Institute and Fu Wai Hospital,CAMS and PUMC,Beijing (100037),China
Abstract
Objective:To establish the aortic regurgitation model in Chinese miniature pigs under echocardiography guidance.
Methods:The animal models were established by following steps:general anesthesia,measuring body weight and then receiving echocardiography examination to exclude aortic valve lesions; carotid artery was exposured by surgery,catheter was sent to aortic sinus with stiff guide wire penetrates and the position of catheter was adjusted to obtain aortic valve damage.The aortic valve injury and regurgitation were evaluated by ultrasound; then the pigs were killed and the heart was taken to observe aortic valve damage.
Results:A total of 7 pigs were used including 4 male and 3 female with the mean body weight of (24.7 ± 3.6) kg.Aortic regurgitation model was successfully established in 5 pigs including 1 mild,1 mild-moderate,2 moderate,1 severe aortic valve regurgitation,and 4 were with valve leaflets perforation and 1 with leaflets tearing.
Conclusion:①Echocardiography can smoothly guide wire go through aortic valve and make valve damage at different degrees,it is reliable to establish aortic valve regurgitation model in experimental pigs.②Echocardiography may clearly identify the position and degree for aortic valve injury.
Key wordsAnimal model; Echocardiography; Aortic regurgitation
基金项目:国家自然基金项目(81271583)
作者简介:孙妍主治医师博士主要从事心脏超声研究Email:sunxiaoyan01@sina.com*目前在首都医科大学附属北京儿童医院心脏超声科工作**Now work in Beijing Children's Hospital,Capital Medical University通讯作者:王浩Email:hal6112@gmail.com
中图分类号:R541
文献标识码:A
文章编号:1000-3614(2016)05-0495-04
doi:10.3969/j.issn.1000-3614.2016.05.018
Corresponding Author:WANG Hao,Email:hal6112@gmail.com
收稿日期:(2015-09-29)

