脂多糖诱导的小鼠急性肺损伤模型的建立
王玉明
酒泉职业技术学院,甘肃 酒泉735000
脂多糖诱导的小鼠急性肺损伤模型的建立
王玉明
酒泉职业技术学院,甘肃 酒泉735000
急性肺损伤是由创伤、感染、休克等诸多非心源性因素导致的一种急性、进行性呼吸障碍。该病的主要特点是出现顽固型低氧血症、促进呼吸频数升高、呼吸加重、呼吸困难、X线分析结果显示肺泡多出现弥漫性浸润等。本实验通过气管滴注脂多糖的方法建立急性肺损伤动物模型,通过HE染色观察肺组织病理学变化、测定肺组织湿干重比值(W/D)、试剂盒检测肺组织MPO活性变化及促炎性细胞因子的产生变化,以验证小鼠急性肺损伤模型是否建立成功。结果表明,脂多糖刺激显著破坏了肺脏组织结构、促进了大量炎性细胞浸润并伴有肺泡壁增厚。脂多糖可以显著提高肺湿干重比率(W/D),促进BALF中TNF-α、IL-1β和IL-6的表达,并提高肺组织的MPO活性。这些结果表明,我们成功利用脂多糖建立了小鼠急性肺损伤模型。
急性肺损伤;脂多糖;RAW264.7;核转录因子-κB; 丝裂原活化蛋白激酶
本实验构建LPS诱导的小鼠急性肺损伤模型,通过观察肺组织病理学变化、测定肺组织湿干重比值(W/D)、肺组织MPO活性变化及炎性细胞数量、促炎性细胞因子的产生变化,以验证小鼠急性肺损伤模型是否建立成功。
1.1 材料
1.1.1 动物 清洁级BALB/c小鼠(6-8周龄,体重20-23 g),购自吉林大学白求恩医学院动物实验中心,小鼠饲养一周左右以适应新环境,给予充足的饲料和饮水。
1.1.2 主要仪器设备及生产厂家 -80℃超低温冰箱日本SANYO公司生产;低温高速冷冻离心机德国SORVALL公司生产;显微镜,奥林巴斯品牌;酶标仪美国BIO-RAD公司生产;水平离心机长沙湘麓仪器有限公司生产;XW-80A漩涡混合器上海精科实业有限公司生产;Microchemi 4.2以色列DNA BIOIMAGE SYSTERM公司生产;HPS-250生化培养箱哈尔滨市东联电子技术开发有限公司生产。
1.1.3 药品和试剂及生产厂家 脂多糖(LPS)美国Sigma公司生产;地塞米松磷酸钠(DEX)注射液新乡长乐制药有限公司;MPO测试盒南京建成科技有限公司生产;TNF-α、IL-6、IL-1β ELISA试剂盒美国Biolegend公司生产;其他化学试剂均由北京化工厂生产。
1.2 方法
1.2.1 ALI模型的构建 小鼠禁食8 h,随机分为3组:空白对照组、LPS刺激组、LPS+DEX组,每组6只小鼠。DEX组小鼠腹腔注射DEX(5 mg/kg),而空白对照组和LPS刺激组小鼠则分别腹腔注射相同体积的生理盐水,1 h后,用乙醚将小鼠轻微麻醉,LPS组,LPS刺激组和DEX组小鼠分别鼻孔滴入LPS(500μL/kg),而空白对照组小鼠鼻孔滴入50 μL生理盐水。
1.2.2 小鼠肺组织湿干重比值(W/D)的测定 LPS刺激7 h,颈椎脱臼法处死小鼠,取出肺脏,用吸水纸吸去肺表面的血液后称重,即其湿重,后将其置入恒温箱中,80oC烘烤48小时达恒重,即其干重。按下列公式W/D:肺W/D=湿重/干重。
1.2.3 小鼠肺组织的病理学评估 病理切片制作步骤(1)取材:LPS刺激7 h后颈椎脱臼法处死小鼠,取出肺脏,PBS冲洗干净,放入固定液中。(2)固定:放入10%甲醛固定液固定24 h,并于石蜡板上修块,装填入组织处理盒中。(3)漂洗:自来水冲洗24 h。(4)脱水和透明:将组织处理盒依次做以下处理:分别于70%乙醇、80%乙醇处理12h,90%乙醇、95%乙醇处理2h,100%乙醇Ⅰ处理1 h,100%乙醇Ⅱ处理1 h,而后放入二甲苯中透明30 min。(5)浸蜡、包埋:将组织处理盒浸入石蜡以取代二甲苯,然后从组织盒中取出肺组织,用融化的石腊进行包埋,待其凝固。(6)切片:将修整好的组织块放入切片机,切片。(7)贴片:用眼科镊将切片轻轻放入40℃的水面上,待切片在水面上充分展平后,用载玻片将其捞起,使其平整的贴在载玻片上。(8)烘片:将载玻片置于烘箱内烤片15~30分钟,脱去溶化组织间隙的石蜡。
H.E. 染色(1)脱蜡:将载玻片放入二甲苯Ⅰ中处理10 min后,再放入二甲苯Ⅱ中处理10 min。(2)水化:将载玻片依次做以下处理:95%乙醇处理3 min→90%乙醇处理3 min→80%乙醇处理3 min→75%乙醇处理3 min,蒸馏水短暂漂洗2~3次。(3)苏木精染色:将载玻片放入苏木精水溶液中染色3 min。(4)分化:将载玻片放入酸水及氨水中分色1~3 s。(5)反蓝:流水冲洗载玻片1小时后入蒸馏水1~3 s,漂洗2~3次。(6)伊红染色:将载玻片放入伊红染色液中染色3 min。(7)脱水透明:将载玻片依次做以下处理:95%乙醇Ⅰ处理30 s→95%乙醇Ⅱ处理30 s→无水乙醇Ⅰ处理3 min→无水乙醇Ⅱ处理3 min。后放入二甲苯中透明30 min。(8)中性树胶封片:将已透明的载玻片滴上加拿大树胶,盖上盖玻片封固(9)镜下观察肺脏的组织病理学变化,采集图像。
1.2.4 小鼠髓过氧化物酶(MPO)活性的测定 LPS刺激7h后颈椎脱臼法处死小鼠,取出肺脏,称取100 mg的肺脏组织。将组织放入匀浆器中,加入1.9 mL的萃取液进行匀浆处理,冰上操作每个标本匀浆10 min,匀浆结束后取0.9 mL的组织匀浆加入0.1 mL磷酸缓冲液,充分混匀后于37℃水浴锅中水浴15 min,按MPO测试盒说明书检测其活性,操作方法如下:(1)取出酶标版,设置空白孔、标准孔以及待测样品孔。分别加入样品稀释液100 μL、标准品100 μL、待测样品100 μL,放置37℃孵育2 h。(2)移除液体,甩干并拍板。然后向各孔加入100 μL配好的检测溶液A,贴上覆封孔,37℃反应1 h。洗板3次,甩干。(3)每孔加入100 μL检测溶液B工作液,37℃反应1 h。洗板3次,甩干。(4)每孔加入100 μL底物溶液,37℃避光显色。(5)每孔再加入50 μL 终止液结束反应。(6)酶标仪于450 nm波长处测定OD值。(7)绘制标准曲线,分析并计算待测样品的浓度。
1.2.4 BALF中TNF-α、 IL-1β及IL-6细胞因子的测定 (1) 样本的制备 LPS刺激7 h后颈椎脱臼法处死小鼠,分离气管并进行气管插管。用PBS分3次进行肺泡灌洗,所得冲洗液即肺泡灌洗液,4℃ 3 000 rpm离心10 min,取上清液,后按ELISA操作说明书测其浓度。(2)细胞因子的测定①准备工作:于实验开始前30 min从冰箱中取出ELISA试剂盒,温度下降至室温,所需试剂分别在临用前15 min按所需浓度配好。②1× 包被液稀释一抗,每孔100 μL,每组3个重复,包被,封板后4℃过夜。③Wash buffer洗板4次,每次200 μL,洗涤1 min,洗涤手法保持一致。④加入稀释好的待测样品及标准品,每孔100 μL,密封后室温孵育1 h。⑤Wash buffer洗板4次,每次200 μL,洗涤1 min,洗涤手法保持一致。⑥将二抗用样品稀释液稀释,每孔100 μL,密封后室温孵育1 h。⑦Wash buffer洗板4次,每次200 μL,洗涤1 min,洗涤手法保持一致。⑧HRP用样品稀释液稀释,每孔100 μL,密封后室温孵育30 min。⑨Wash buffer洗板4次,每次200 μL,洗涤1 min,洗涤手法保持一致。⑩加入底物显色液TMB,每孔100 μL,室温避光孵育15~30 min。最后两项是至阳性对照显现蓝色,立即加入终止液,每孔100 μL。然后测定A450 nm。
1.2.5 数据处理及统计 将以上实验结果进行方差分析,其结果用Means±SEM形式表示。数据差异性均采用方差分析和Student′s检验进行分析。\%P<0.05 和 P\%<0.01 分别代表差异显著和差异极显著。
1.3 结果
1.3.1 小鼠肺湿干重比率的测定 肺湿干重比率(W/D)可以用来评估肺水肿的程度。于LPS滴注7h后,对其肺湿干重比率(W/D)进行测定。如图1.1(A)所示,与空白对照组相比,LPS组W/D值显著升高(﹟\%p\%<0.05)),而DEX组W/D值显著低于LPS组(\%p*<0.05 或 p\%**<0.01)。
1.3.2 小鼠肺组织病理学变化 LPS 滴注7 h后,对肺组织进行HE染色。结果如图1.1(B)所示,与空白对照组相比,LPS刺激组肺脏组织破坏较严重,大量炎性细胞浸润并伴有肺泡壁增厚。

图1.1 (A)肺湿干重比率(W/D)(\%p*<0.05 或 p\%**<0.01)(B)小鼠肺组织切片(HE染色)。

图1.2 小鼠肺组织MPO活性(#:\%P<0.05,**:P\%<0.01)
1.3.3 小鼠MPO活性的测定 LPS 滴注7 h后,对肺组织进行MPO活性测定。结果如图1.2所示,LPS刺激组MPO活性与空白对照组相比显著升高(﹟\%p\%<0.05),DEX组MPO活性明显低于LPS刺激组(*\%p<0.05,**p\%<0.01)。
1.3.4 小鼠BALF中细胞因子的测定 LPS 滴注7 h后,对BALF中TNF-α、IL-1β和IL-6进行测定。结果如图1.3所示,与空白对照组相比,LPS组BALF中TNF-α、IL-1β和IL-6表达水平明显升高(﹟\%P\%<0.05),但DEX组BALF中TNF-α、IL-1β和IL-6表达水平明显降低(* \%P <0.05,** P\% <0.01)。
1.4 结论
引起ALI的致病因素很多,其高致死率已引起人们的广泛关注,也是医学研究中的热点之一,但其发病机制尚未明确。目前,多种动物种类已被用来研究ALI,其中,啮齿类小鼠急性肺损伤模型应用最广泛。由于小鼠体型小,生长迅速,来源容易,已成为ALI实验研究中一种有效的手段。
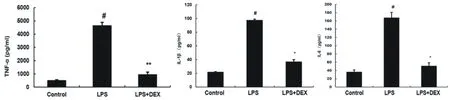
图1.3 小鼠BALF中炎性细胞因子测定(#:\%P<0.05,**:P\%<0.01)
脂多糖(lipopolysaccharide,LPS)是革兰氏阴性菌细胞壁的主要成分,能够导致肺组织发生水肿,伴有中性白细胞浸润,损伤上皮组织的完整性等。水肿是急性肺损伤的一个主要病理特征。本实验采用气管滴注的方法建立肺损伤动物模型。通过测定小鼠肺组织湿干重比值(W/D)来评价肺组织的水肿程度。结果显示LPS能够显著地增加肺组织的W/D比值。肺组织病理切片显示,在LPS组中能够发现大量的嗜中性粒细胞浸润,肺泡壁增厚,且具有明显的充血淤血现象。髓过氧化物酶(MPO)能够反映中性粒细胞的数量,通过测定肺组织的MPO活性,来判断肺组织中中性粒细胞浸润的程度,结果显示LPS刺激后,MPO活性明显升高。细胞因子在炎症反应中扮演着重要的作用,如TNF-α、IL-1β和IL-6。实验结果显示在BALF中LPS刺激能够产生大量的 TNF-α、IL-1β和IL-6。综合以上结果表明,利用LPS成功建立了小鼠急性肺损伤模型。
[1] 马李杰, 李王平, 金发光. 急性肺损伤/急性呼吸窘迫综合征发病机制的研究进展 [J].中华肺部疾病杂志(电子版), 2013(1): 65-68.
[2] 施卉, 任成山. 急性肺损伤/急性呼吸窘迫综合征基础及临床研究进展 [J]. 中华肺部疾病杂志(电子版), 2013, 04): 350-355.
[3] 钱桂生. 急性肺损伤和急性呼吸窘迫综合征研究现状与展望 [J]. 解放军医学杂志, 2003(2): 97-101
[4] 黄国华, 陈正贤. 急性肺损伤和急性呼吸窘迫综合征的诊治思维程序 [J]. 中国实用内科杂志, 2007(18): 1480.
[5] 崔蓉, 孟宪丽, 王平等. 黄芩水提取物对急性肺损伤大鼠的保护作用及其与胆碱能抗炎通路的相关性研究 [J]. 中草药, 2012(2): 321-326.
Modeling of Acute Lung Injury in Mice Challenged with LPS
WANG Yu-ming
(JiuquanVocationlandTechnicalCollege,JiuquanGansu735000China)
Acute lung injury (ALI) is an acute and progressive respiratory dysfunction, which is usually caused by trauma, infection, shock, and many other non-cardiac causes. The main features of the disease are stubborn hypoxemia, the breath frequency increases, heavy breathing, dysonea, X-ray analysis showed a diffuse infiltration of alveolar. Model of acute lung injury was established in mice by instilling weasand with LPS. The acute lung injury in mice was evaluated by H.E dyeing, lung tissue for wet dry weight ratio (W/D), MPO activity and inflammatory cytokines were determined. The results showed that lung organization structure damage, inflammatory cells infiltration and alveolar walls thickness were significantly induced by LPS. These results suggested that model of acute lung injury were successfully established in mice by instilling weasand with LPS.
Acute lung injury; LPS; RAW264.7; NF-κB; MAPK
2016-06-20
王玉明( 1974 - ) , 男, 甘肃酒泉人, 讲师,硕士, 从事动物病理及兽医临床教学和研究工作。
S 852.3
A
1004-6704(2016)06-0028-00

