高强度丁基壳聚糖膜的制备及性能测定*
曹 兴,李 露,于世涛,刘仕伟
(青岛科技大学 化工学院,山东 青岛 266042)
壳聚糖系天然高分子材料甲壳素的脱乙酰基产物,因其具有良好的吸附性,成膜性,生物相容性和一定的消炎等性能,使其在医药研究方面越来越受到重视[1-3]。由于壳聚糖独特的化学结构可以使其烷基化、羧基化、酰基化等生成不同性能的壳聚糖衍生物,从而拓宽了壳聚糖的应用范围[4-5]。丁基壳聚糖是一类重要的壳聚糖衍生物,具备壳聚糖所具有的优良性质[6-8],并且根据改性基团的不同还可以增加壳聚糖的一些特性。目前对于丁基壳聚糖的制备有一定的研究成果[9-10],但是对于丁基壳聚糖的成膜工艺及性能的研究很少。作者以微波碱化法制得的丁基壳聚糖(相对分子质量为6.9×105,取代度为21.49%)为原材料,探讨了HAc条件下壳聚糖的成膜工艺,以及得到最大拉伸强度丁基壳聚糖的制备条件。
1 实验部分
1.1 试剂与仪器
壳聚糖:黏均分子量117万,批号20131109,脱乙酰度≥95%,浙江澳兴生物科技有限公司;溴代正丁烷:分析纯,上海山浦化工有限公司;醋酸、氢氧化钠:分析纯,江苏强盛功能化学股份有限公司。
乌氏黏度计:D=0.46,α=0.93,北京天创上邦仪器设备有限公司;电脑微波固液相合成/萃取工作站:XH-200A,北京祥鸽科技发展有限公司;匀胶机:KW-4B,北京赛德凯斯电子有限责任公司;电热鼓风干燥箱:101-1H,天津市泰斯特仪器有限公司;智能恒温恒湿箱:LHP-160,上海三发科学仪器有限公司;视频接触角测定仪:JB1632,上海中晨数字设备有限公司;单纤维强力仪:LLY-06A,莱州市源骏电子仪器有限公司;FT-IR红外光谱仪:Nicolet 510P,美国Nicolet公司;旋转极X射线粉末衍射仪:Rigaku D/max-rB,日本Rigaku公司;TGA/DSC1同步热分析仪:11OOSF,Mettler Toledo公司。
1.2 丁基壳聚糖膜的制备
丁基壳聚糖的制备:将6.0 g NaOH和6.0 g壳聚糖加入带有回流装置的三口烧瓶中,并加入一定量异丙醇,在电脑微波工作站中60 ℃、600 W的条件下碱化反应1 h,然后将装置转移至70 ℃集热式恒温加热磁力搅拌器中,缓慢滴加溴代正丁烷7.19 g,反应4 h后结束。再用稀盐酸调节溶液pH至中性,抽滤后用甲醇、乙醚和去离子水反复洗涤固体产物,洗涤滤液至AgNO3检验无淡黄色沉淀,将滤饼于40 ℃烘箱中烘干,最后得到丁基壳聚糖产物(DS=21.49%,Mr=6.9×105)。
丁基壳聚糖膜的制备:将丁基壳聚糖溶解在HAc水溶液得到丁基壳聚糖溶液。将溶液经注射器定量滴于玻璃板上匀胶涂膜,控制厚度在一定范围内,恒温40 ℃、恒湿50%烘干。将玻璃板放入盛有NaOH溶液的托盘中浸泡,揭起得到丁基壳聚糖湿膜,清水冲洗至中性,并恒温恒湿烘干保存。
1.3 性能测试
1.3.1 膜的拉伸强度的测定
选取平整干净的膜样本,使用电子单纤维强力仪测试丁基壳聚糖膜的断裂强力、断裂伸长率、初始模量。测试条件为拉伸速率20 mm/min,间距10 mm,预张力0.4 cN,测定环境温度(23±1) ℃,相对湿度为(50±2)%。
(1)使用扫描电镜准确测定膜的厚度;(2)用标准切纸刀将膜裁制成长度>20 mm、宽2 mm的条形膜;(3)记录电子单纤维强力仪测试的丁基壳聚糖膜的断裂强力、断裂伸长率、初始模量,并按以下公式计算得到断裂强度(σ)[11]。
(1)
式中,F为断裂负荷,N;b为膜有效宽度,mm;d为膜有效厚度,mm。
1.3.2 接触角的测定
使用悬滴法对丁基壳聚糖膜的接触角进行测量,使用JY-82C视频接触角测定仪测量水在膜表面的接触角。对每个丁基壳聚糖膜分别取5个不同位置的点进行测定,并最终计算其平均值。
1.3.3 丁基壳聚糖膜的结构表征
FT-IR测定:测试范围为400~4 000 cm-1,分辨率为2 cm-1,用于分析丁基壳聚糖膜的结构组成。
TG测试:通N2保护,通气速率为50 mL/min,升温范围为25~500 ℃,升温速率为10 K/min,样品质量约为5 mg,用于测试丁基壳聚糖膜的稳定性。
XRD测定:扫描范围(2θ)为5~70 °,扫描速度为2 °/min,管流管压为40 kV和150 mA,用于测定丁基壳聚糖膜的结晶性。
2 结果与讨论
2.1 丁基壳聚糖膜机械性能影响因素考察
2.1.1 薄膜厚度对膜力学性能的影响
根据1.2的方法,将定量丁基壳聚糖溶解于w(HAc)=2.0%的水溶液中,配制成w(丁基壳聚糖)=1.0%的溶液。设置不同的转速匀胶后,恒温恒湿烘干,在w(NaOH)=2.0%的溶液中浸泡3.0 h后,揭膜洗净,恒温恒湿干燥,考察薄膜厚度对丁基壳聚糖膜力学性能的影响,结果见表1。

表1 HAc体系下薄膜厚度对丁基壳聚糖膜的影响
由表1可见,当丁基壳聚糖膜厚度增加时,丁基壳聚糖膜呈现断裂强力值随之增加的趋势,但是断裂强度和断裂伸长率在2.1~3.7 μm变化不大。所以在制膜过程中,膜的厚度尽量控制在2.1~3.7 μm,此时,薄膜厚度对丁基壳聚糖膜的断裂强度和断裂伸长率没有太大影响。
2.1.2 w(HAc)对膜力学性能的影响
根据1.2节的方法,将丁基壳聚糖溶解于不同质量分数的HAc水溶液中,配成w(丁基壳聚糖)=2.0%的溶液,匀胶后恒温恒湿烘干,在w(NaOH)=2.0%的溶液中浸泡3.0 h后,揭膜洗净,恒温恒湿干燥,考察w(HAc)对丁基壳聚糖膜性能的影响,结果见表2。
由表2可知,随着w(HAc)的增大,膜的断裂强度和断裂伸长率均呈现先升高后降低的趋势,当w(HAc)=2.5%时,膜的断裂强度和断裂伸长率最佳。这是由于当w(HAc)较低时,完全溶解等量的丁基壳聚糖需较长时间,可能会使其缓慢降解,破坏大分子链结构,致使膜的机械强度降低、断裂伸长率减小[12];当w(HAc)较高时,残留的HAc分子在与NaOH中和过程中,从膜表面大量而且快速溢出,使其分子结构变得疏松,导致丁基壳聚糖膜的机械强度降低、断裂伸长率也随之减小。同时随着w(HAc)的增大,膜的厚度逐渐减小,初始模量逐渐增大,接触角逐渐减小。这是因为随着w(HAc)的增大,丁基壳聚糖溶液的黏度减小,从而使膜的厚度、硬度、刚性以及初始模量减小,同时,随着w(HAc)的增大,丁基壳聚糖分子的质子化程度增大,导致分子间氢键减小,水溶性越大,接触角就会越小。因此,w(HAc)=2.5%为佳。

表2 w(HAc)对丁基壳聚糖膜的影响
2.1.3 w(丁基壳聚糖)对膜力学性能的影响
根据1.2节的方法,将w(HAc)=2.5%的水溶液溶解丁基壳聚糖,配成一定梯度的丁基壳聚糖溶液,匀胶后恒温恒湿烘干,在w(NaOH)=2.0%的溶液中浸泡3.0 h后,揭膜洗净,恒温恒湿干燥考察w(丁基壳聚糖)对丁基壳聚糖膜性能的影响,结果见表3。

表3 w(丁基壳聚糖)对丁基壳聚糖膜的影响
由表3可知,随着w(丁基壳聚糖)的增大,膜的断裂强度和断裂伸长率均呈现先增后降趋势,当w(丁基壳聚糖)=2.5%时,膜的断裂强度和断裂伸长率达到最佳,这是由于当w(丁基壳聚糖)较低时,溶液黏度较小,制得的膜太薄,断裂强度较低,伸长率较小;当w(丁基壳聚糖)较高时,分子排列杂乱,溶液流动性减小,黏度大,膜原液产生气泡后不易脱除,匀胶不均匀,影响了膜断裂强度和断裂伸长率的大小[13]。与此同时,随着原料w(丁基壳聚糖)的增大,丁基壳聚糖膜呈现厚度增大、初始模量减小、接触角增大的趋势。这是因为随着w(丁基壳聚糖)的增加,溶液体系黏度逐渐增大,从而使膜的厚度、硬度、刚性以及初始模量增大,同时,分子间氢键作用力增大、亲水性随之降低,导致接触角变大。因此,w(丁基壳聚糖)=2.5%较佳。
2.1.4 w(NaOH)对膜力学性能的影响
根据1.2节的方法,将w(HAc)=2.5%的水溶液溶解丁基壳聚糖,配制成w(丁基壳聚糖)=2.5%的溶液,匀胶后恒温恒湿烘干,在一定浓度的NaOH溶液中浸泡3.0 h后,揭膜洗净,恒温恒湿干燥,考察w(NaOH)对丁基壳聚糖膜性能的影响,结果见表4。
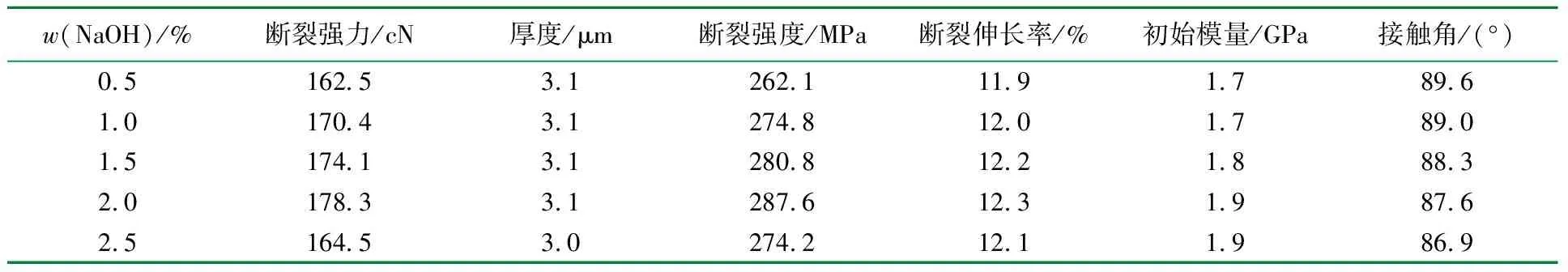
表4 w(NaOH)对丁基壳聚糖膜的影响
由表4可知,随着w(NaOH)的增大,丁基壳聚糖膜的断裂强度和断裂伸长率均呈现先升高后降降低的趋势,当w(NaOH)=2.0%时,膜的断裂强度和断裂伸长率达到最佳。这是因为HAc与NaOH发生中和反应,当w(NaOH)较低时,中和不彻底,会造成揭膜操作困难;当w(NaOH)较高时,中和反应过快,HAc从膜表面大量且快速溢出,对膜造成破坏使其韧性降低[14]。与此同时,丁基壳聚糖膜呈现厚度基本不变,初始模量增大、接触角减小的趋势。这是因为相同的溶质与溶剂,转速一定,所以烘干后得到的膜厚度相差不大。烘干后的干膜内仍会保留少量HAc,丁基壳聚糖膜浸泡于NaOH中,醋酸与NaOH发生中和反应,w(NaOH)越大中和的越快,使膜内部结构越紧密,硬度越高,初始模量越大,同时随着w(NaOH)的增加,膜的表面破坏程度越大,使膜的表面越粗糙,亲水性越好使得接触角越小。因此,以w(NaOH)=2.0%为宜。
2.1.5 碱液浸泡时间对膜力学性能的影响
根据1.2节的方法,将w(HAc)=2.5%的溶液溶解丁基壳聚糖,配制成w(丁基壳聚糖)=2.5%的溶液,匀胶后恒温恒湿烘干,在w(NaOH)=2.0%的溶液中浸泡一定时间后,揭膜洗净,恒温恒湿干燥,考察碱液中浸泡时间对丁基壳聚糖膜性能的影响,结果见表5。

表5 碱液浸泡时间对丁基壳聚糖膜的影响
由表5可知,随着在碱液浸泡时间的延长,膜的断裂强度和断裂伸长率均呈现先升高后降低的趋势,当浸泡时间为3.5 h时,膜的断裂强度和断裂伸长率较佳。这是由于当碱液浸泡时间较短时,NaOH与膜中残留的HAc中和不彻底,造成揭膜操作困难;但是浸泡时间过长,碱液会损坏膜的内部结构,使膜的力学性能降低。与此同时,丁基壳聚糖膜呈现厚度不变、初始模量变大、接触角变小的趋势。这是因为随着在碱液中浸泡时间的增长,与HAc中和的越彻底,使膜变得越难再溶解于水中,硬度增强,初始模量增大。同时,随着时间的延长,NaOH会侵蚀膜的表面结构,使得膜表面越来越粗糙,亲水性越好。与此同时,所以浸泡3.5 h为佳。
由上述实验结果可知,HAc体系下制备丁基壳聚糖膜的最佳工艺条件为:以w(HAc)=2.5%的水溶液溶解丁基壳聚糖,配制成w(丁基壳聚糖)=2.5%的溶液,匀胶成膜,恒温恒湿烘干。将玻璃板放入盛有w(NaOH)=2.0%的溶液的托盘中浸泡3.5 h,揭起得到丁基壳聚糖湿膜,清水冲洗至中性并恒温恒湿烘干。得到丁基壳聚糖膜的断裂强度为291.2 MPa,断裂伸长率为12.5%,初始模量为1.9 GPa。
2.2 丁基壳聚糖膜的结构表征分析
2.2.1 红外分析
HAc溶液制备的原料壳聚糖膜与丁基壳聚糖膜红外光谱图见图1。
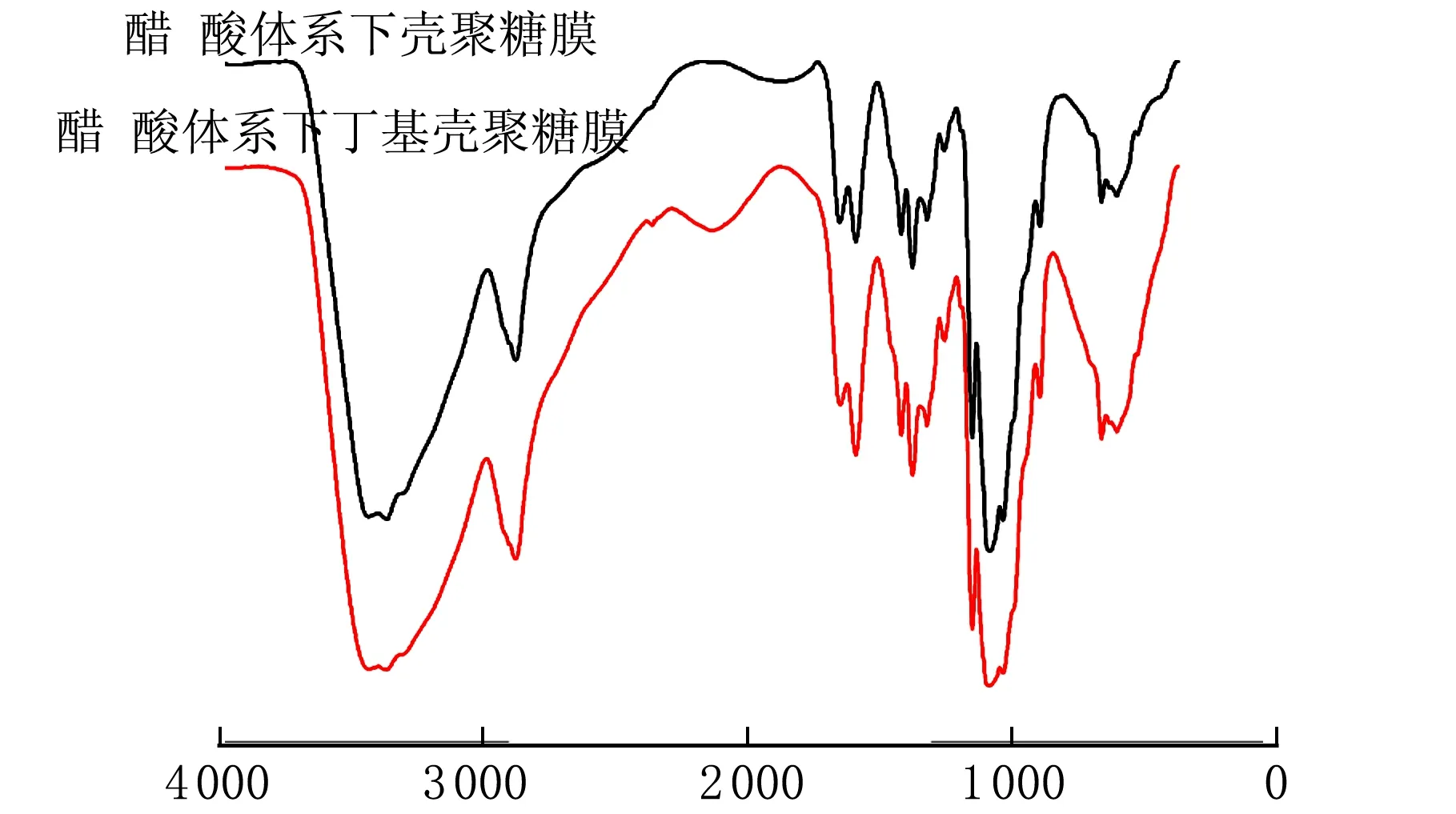
σ/cm-1图1 丁基壳聚糖膜的红外谱图
在图1中3 400 cm-1处的宽峰是因为形成氢键缔合的—OH伸缩振动吸收峰与—NH的伸缩振动吸收峰向低波数移动而生成的多重吸收峰。峰宽的差异反应了氢键的强弱,从图1中可以看出丁基壳聚糖膜较壳聚糖膜在3 400 cm-1处的宽峰窄,那是因为壳聚糖在氨基上进行烷基化反应造成的[15]。2 922.4~2 919.8 cm-1和2 881.7~2 880.4 cm-1分别是残糖基上甲基或次甲基的C—H伸缩振动吸收峰,受其它因素的影响小,比较稳定,常用于红外光谱法测定脱乙酰度作为基准峰。酰胺Ⅰ、Ⅱ、Ⅲ谱带分别在1 658.0~1 656.1 cm-1、1 598.8~1 591.5 cm-1、1 310 cm-1,由FI-IR谱图中可知,1 654.8、1 593.1和1 323.1 cm-1分别为壳聚糖膜酰胺Ⅰ、Ⅱ、Ⅲ的特征吸收峰。1 658.7、1 593.1和1 325.0 cm-1分别为丁基壳聚糖膜酰胺Ⅰ、Ⅱ、Ⅲ的特征吸收峰。由图1可知丁基壳聚糖膜和壳聚糖膜的脱乙酰度相差不大。896.9 cm-1是多糖的β-构型糖苷键的特征峰。丁基壳聚糖膜与壳聚糖膜相比主要峰型结构基本一致,分子的基本骨架均未发生改变。
2.2.2 TG分析
HAc溶液制备的原料壳聚糖膜与丁基壳聚糖膜的TG图见图2。

t/℃图2 丁基壳聚糖膜的TG曲线
由图2可知,HAc体系下壳聚糖膜和HAc体系丁基壳聚糖膜的TG曲线几乎重合,大约在225~380 ℃之间都有比较明显的热转变,二者的失重均随温度的不断升高而不断增加。从图中的曲线可以看出HAc溶剂中溶解的丁基壳聚糖膜与原料壳聚糖膜的热分解温度相比几乎相同,说明HAc体系下的丁基壳聚糖膜与原料壳聚糖的热稳定性相同。
2.2.3 XRD分析
HAc溶液制备的原料壳聚糖膜与丁基壳聚糖膜的XRD图见图3。
由图3可以看出丁基壳聚糖膜在2θ=20.5°出现一个主要的结晶峰,壳聚糖膜在2θ=20.6°出现一个主要的结晶峰,说明丁基壳聚糖膜具有和壳聚糖膜一致的晶体结构,且丁基壳聚糖膜和壳聚糖膜分子内和分子间都存在着较强的氢键作用,分子结构规整,因此丁基壳聚糖膜有较强的结晶性和较高的致密性。HAc体系丁基壳聚糖膜与丁基壳聚糖的特征衍射峰基本相符[16],制备的丁基壳聚糖膜与原料壳聚糖膜相比结晶度有所上升,说明在HAc的作用下丁基壳聚糖分子上的氨基质子化程度比壳聚糖质子化程度低。

2θ/(°)图3 丁基壳聚糖膜的XRD谱图
3 结 论
丁基壳聚糖膜的性能受薄膜厚度、w(溶剂)、w(丁基壳聚糖)、w(碱液)、碱液浸泡时间的影响。通过优化得到醋酸体系下高性能丁基壳聚糖膜,拓展了烷基壳聚糖在膜制备上的应用。
参 考 文 献:
[1] HOZUMI K,OTAGIRI D,YAMADA Y J,et al.Cell surface receptor-specific scaffold requirements for adhesion to laminin-derived peptide-chitosan membranes[J].Biomaterials,2010,31(12):3237-3243.
[2] YANG Y,WANG S P,WANG Y T,et al.Advances in self-assembled chitosan nanomaterials for drug delivery[J].Biotechnol Adv,2014,32:1301-1306.
[3] LIN Y C,LOU P G,YOUNG T H.Chitosan as an adjuvant-like substrate for dendritic cell culture to enhance antitumor effects [J].Biomaterials,2014,35:8867-8875.
[4] PENG Y,HAN B,LIU W,et al.Preparation and antimicrobial acitvity of hydroxypropyl chitosan[J].Carbohydrate Research,2005,340(11):1846-1851.
[5] 李卫红,朱娴,雷文,等.壳聚糖及其衍生物在医药领域的应用[J].高分子通报,2015,12:104-107.
[6] KIM C H,CHOI J W,CHUN H J,et al.Synthesis of chitosan derivatives with quaternary ammonium salt and their antibacterial activity[J].Polym Bul1,1997,38(4):387-393.
[7] KURITA Y,ISOGAI A.Reductive N-alkylation of chitosan with acetone and levulinic acid in aqueous media[J].International Journal of Biological Macromolecules,2010,47(2):184-189.
[8] BARAN E T,MANO J F,REIS R L.Starch-chitosan hydrogels prepared by reductive alkylation cross-linking[J].Mater Sci,2004,15(7):759-765.
[9] 王爱勤,俞贤达.丁烷基壳聚糖的制备[J].中国医药工业杂志,1998,29(10):471-472.
[10] 裴立军,李露,刘仕伟,等.微波促进高相对分子质量N-丁烷基壳聚糖的合成[J].化工科技,2011,19(3):1-5.
[11] MAKARAND V R,ANANDWARDHAN A H,SUJATA V B,et al.pH-Sensitive freeze-dried chitosan-polyvinyl pyrrolidone hydrogels as controlled release system for antibiotic delivery[J].Journal of Controlled Release,2000,68:23-30.
[12] 赵丽丽,解则安,李露,等.壳聚糖膜的制备及性能测定[J].应用化工,2014,43(9):1588-1591.
[13] 许勇,洪华,钱颖,等.医用壳聚糖膜的制备和性能研究[J].功能高分子学报,2004,17(1):55-66.
[14] 胡宗智,游敏,林少琨,等.壳聚糖在膜分离上的应用[J].三峡大学学报(自然科学版),2003,25(5):460-463.
[15] 赵国骏,姜涌明,孙龙生,等.不同来源壳聚糖的基本特性及红外光谱研究[J].功能高分子学报,1998,11(3):403-407.
[16] 高国辉.丁基壳聚糖膜的制备及性能研究[D].青岛:青岛科技大学,2013:9-19.

