精子DNA完整性对体外授精-胚胎移植妊娠结局的影响
汪李虎汪 艳梁嘉颖杨少芬杨旭辉张 杰朱照平易艳红
1. 广东省妇幼保健院生殖健康与不孕症科(广州 510010);2. 广州金域检验中心
精子DNA完整性对体外授精-胚胎移植妊娠结局的影响
汪李虎1*汪 艳2梁嘉颖1杨少芬1杨旭辉1张 杰1朱照平1易艳红1
1. 广东省妇幼保健院生殖健康与不孕症科(广州 510010);2. 广州金域检验中心
目的探讨精子DNA完整性对体外受精-胚胎移植(IVF-ET)临床结局的影响。方法采用染色质扩散实验(SCD)对接受203个周期IVF-ET治疗的男方精液进行精子DNA 完整性检测。因女方卵巢反应差取消10个周期,剩余193个周期。根据精子DNA碎片指数(DFI)是否超过30%和是否药物治疗分为3组:DFI异常组55例(DFI>30%),DFI正常组(DFI<30%)78例和DFI治疗组60例,其中DFI治疗组指患者DFI>30%,经药物治疗3个月,降至30%以下。比较DFI与受精率、2PN 受精率、卵裂率及优胚率的相关性;比较3组间的种植率、妊娠率和流产率。结果精子DFI与受精率、2PN受精率及卵裂率均无显著相关性(P>0.05),与优胚率具有显著负相关(P<0.05)。DFI正常组和DFI治疗组(治疗后DFI<30%)的种植率及妊娠率均高于DFI异常组,差异有统计学意义(P<0.05)。DFI正常组与DFI治疗组的种植率及妊娠率差异均无统计学统计(P>0.05)。3组流产率表现相当,差异均无统计学意义(P>0.05)。结论精子DNA完整性对受精率、2PN受精率及卵裂率无影响,对优胚率、种植率及妊娠率有负面影响,药物改善精子DNA完整性后可提高优胚率、种植率及妊娠率。
受精,体外; 精子DNA完整性; 妊娠结局
目前全球不孕不育患者呈逐年增加趋势,随着男科诊疗水平的提高,发现约有一半与男方因素有关[1]。对男性生育力评估传统方法主要依靠精液常规分析和精子形态分类,但这些方法仅能反映48%的男性生殖能力[2],因此,仅使用以上方法不足以评估男性生育力。精子DNA完整性的测定被认为是一项评估男性生育能力的稳定指标[2],而且也逐渐用于辅助生殖技术相关妊娠结局的重要预测指标[3]。但也有认为精子DNA完整性与受精率、优胚率、临床妊娠率均无相关性[4]。本文对在本院实施IVF-ET的男方采用精子染色质扩散实验(sperm chromatin dispersion,SCD)检测精子DNA碎片指数(DNA fragmentation index,DFI),并对部分DFI异常者给予抗氧化剂和中成药治疗,探讨精子DNA完整性与IVF-ET临床结局的关系。
对象与方法
一、研究对象
选取2013年1月1日至2015年10月31日本院行IVFET周期夫妇203对。
男方根据WHO《人类精液检查与处理实验室手册》第5版标准[2],行精液常规检查、精子形态分析和采用精子染色质扩散实验检测精子DNA碎片指数(DFI)。依据DFI是否超过30%和是否药物治疗分为3组:DFI异常组(DFI>30%)55例,DFI正常组(DFI<30%)78例和DFI治疗组60例。其中DFI治疗组指患者DFI>30%,经维生素E和中成药麒麟丸(太安堂集团,国药准字Z10930034,每日3次,口服,每次6g)治疗3个月,降至30%以下。女方纳入标准要求:(1)女方年龄<35岁;(2)长方案降调;(3)新鲜移植周期。双方染色体核型均正常。
二、精子DNA损伤检测
购买深圳博税德生物科技有限公司精子DNA碎片检测试剂盒,采用SCD法进行检测。手淫法取精,待精液液化后,用 PBS 稀释精子密度至 5~10×106/mL。易熔凝胶管80℃温浴20min,37℃复温5min。取出待测标本60μL加入上述易熔胶管中,充分混匀,加入30μL精子混合液在经过0.65%正常熔点琼脂预处理过的载玻片上,盖上22mm×22mm盖玻片,水平置于4℃冰箱5min。移至室温,去除盖玻片,避光条件下,放入 DNA 变性液中孵育7min,转入裂解液中孵育25min,放入蒸馏水中漂洗1~2min,换水1~2次。玻片依次放入70%、90%和100%乙醇中各脱水2min。玻片风干后用瑞氏染色15min,流水冲洗,空气干燥。在高倍镜下计数大于500条精子,并计算DNA存在损伤精子所占比例即DFI。以 DFI<30%为正常。
三、IVF方案
女方超排卵均采用常规长方案,卵泡成熟后肌注hCG,34~36h 在阴道B超引导下取卵;于采卵后4-6h 行体外受精,受精后第3天进行胚胎评价,根据卵裂球数目、形态、碎片多少将胚胎分为4级[5]其中Ⅰ、Ⅱ级胚胎为优质胚胎。取卵后第3天移植1~2枚胚胎。移植28d后行阴道超声检查孕囊及胎心。
四、统计学分析
数据采用 SPSS13.0 统计软件包进行分析。计量资料以x±s表示;组间计数、计量资料比较采用t检验;组间率的比较采用x2检验;相关性分析采用直线相关分析;P<0.05认为差异有统计学意义。
结 果
一、研究对象基本情况
203对夫妻共进行203个IVF周期:DFI异常组55个周期,DFI正常组78个周期和DFI治疗组60个周期。组间比较,男女方年龄、精子密度、正常形态精子百分率均无统计学差异(P>0.05);获卵数及移植胚胎数也无统计学差异(P>0.05)。见表1。
二、DFI与受精率、2PN受精率、卵裂率及优胚率的相关性分析
精子DFI与受精率、2PN 受精率、卵裂率均无明显相关性(P>0.05),精子DFI与优胚率呈显著负相关,见表2。
三、DFI与IVF-ET妊娠结局的关系
DFI正常组和DFI治疗组的种植率及妊娠率均高于DFI异常组,差异有统计学意义(P<0.05)。DFI正常组与DFI治疗组的种植率及妊娠率均无统计学差异(P>0.05)。3组流产率表现相当,差异均无统计学意义(均为P>0.05),见表3。

表1 男女双方基本情况比较

表2 DFI与受精情况的相关性分析
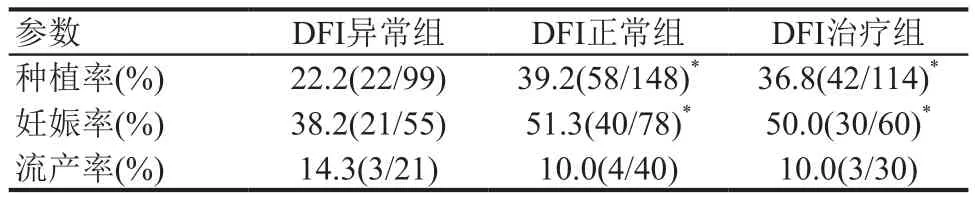
表3 3组IVF-ET妊娠结局的比较
讨 论
目前大量研究报道精子DNA完整性影响男性生育力,但对IVF临床结局仍存在诸多争议。有研究认为精子DNA损伤与受精率相关[3],但有研究报道两者无相关性[4]。Borini等[6]认为早期胚胎的发育主要受母源基因组的调控,受精以及受精卵2~4细胞卵裂均依赖卵母细胞发育和成熟阶段积累的线粒体RNA,父源基因组在胚胎发育至4~8细胞期后开始激活并影响胚胎的继续发育,因而认为精子DNA损伤并不影响受精以及细胞卵裂。同时,Jin等[7]发现卵母细胞的修复能力可能是决定精子DNA损伤影响IVF结局的关键因素,且卵母细胞的数量和质量是其修复能力的保障。本研究结果显示在女方获卵数和卵子质量相当情况下,精子DFI与受精率、2PN受精率、卵裂率均无相关性,说明DFI对精卵结合、胚胎卵裂没有明确的预示作用。
在精子形成过程中,组蛋白逐渐被鱼精蛋白替代,由二硫键交联形成高度致密细胞核,这种致密结构有利于保护精子染色质抵抗外界应激[8],保持精子DNA的完整性,保证遗传信息完整地传递给卵母细胞,在后续的胚胎发育中正确地表达。导致精子DNA完整性损伤的因素较多,包括环境毒物、精索静脉曲张、生殖道感染等病理性因素,以及精子冷冻、化疗、放疗等医源性损伤,通过精子发生缺陷、氧化应激、精子凋亡异常等机制造成DFI增高。在IVF过程中,男方精子在体外暴露时易引起氧化应激反应从而进一步加重DNA损伤。Janny等[9]认为质量差的精子受精后的胚胎,在3~4d大量胚胎质量评分低甚至发育停滞,致使DFI高的DFI异常组患者优胚率比DFI低的DFI正常组患者显著降低以及胚胎碎片增多、种植率降低等。本文结果显示DFI与优胚率呈显著负相关,差异有统计学意义(P<0.05);DFI异常组的种植率和妊娠率均低于DFI正常组和DFI治疗组,差异有统计学意义(P<0.05),均与国外资料相符。
精子DNA损伤与男性不育密切相关,其损伤程度与自然受孕率呈显著负相关,有报道认为DFI≥30%,则自然生育的可能性几乎为零[4]。而且本研究提示精子DNA损伤与IVF- ET的优胚率、胚胎种植率、临床妊娠率相关。因此,有必要对高DFI的患者在接受IVF前进行治疗,以提高精子DNA完整性。首先应针对引起DNA损伤的病因进行治疗,如精索静脉曲张患者行精索静脉高位结扎术,生殖道感染患者根据药敏试验选择有效抗生素规范治疗。抗氧化剂能有效地保护精子DNA免受ROS的损伤[10]。Tunc等对不育症患者口服抗氧化剂维生素E片剂治疗后,精子核DNA完整性提高,凋亡精子和精液中抗氧化镁活性显著提高[11]。根据中医“肾主生殖”理论,本课题采用具有“补肾填精,益气养血”的麒麟丸和抗氧化剂维生素E联合治疗3个月,高DFI患者均降至正常;且DFI治疗组与DFI正常组的胚胎种植率、临床妊娠率,均高于DFI异常组(未经治疗)。因此,中医药在精子DNA损伤的预防和保护中可能起到一定的作用,是值得深入研究的领域。
1 World Health Organization. WHO laboratory manual for the examination and processing of human semen.5th ed. Geneva: World Health Organization. 2010:112-114
2 Omran HM, Bakhiet M, Dashti MG. DNA integrity is a critical molecular indicator for the assessment of male infertility. Mol Med Rep 2013; 7(5):1631-1635
3 Huang CC, Lin DP, Tsao HM, et al. Sperm DNAfragmentation negatively correlates with velocity and fertilization rates but might not affect pregnancy rates. Fertil Steril 2005; 84(1): 130-140
4 Bungum M, Humaidan P, Axmon A, et al. Sperm DNA integrity assessment in prediction of assisted reproduction technology outcome. Hum Reprod 2007; 22(1): 174-179
5 庄广伦. 现代辅助生育技术. 第1版. 北京: 人民卫生出版社, 2005: 238-239
6 Borini A, Tarozzi N, Bizzaro D, et al. Sperm DNA fragmentation: Paternal effect on early post-implantation embryo development in ART. Hum Reprod 2006; 21(11): 2876-2881
7 Jin J, Pan C, Fei Q, et al. Effect of sperm DNA fragmentation on the clinical outcomes for in vitro fertilization and intracytoplasmic sperm injection in women with different ovarian reserves. Fertil Steril 2015; 103(4): 910-916
8 Reusser P. Oral valganciclovir: A new option for treatment of cytomegalovirus infection and disease in immunocompromised hosts. Expert Opin Investing Drugs 2011; 10(9): 1745-1753
9 Janny L, Menezo YJ. Evidence for a strong paternal effect on human preimplantation embryo development and blastocyst formation. Mol Reprod Dev 1994; 38(1): 136-142
10 Kammann U, Bunke M, Steinhart H, et al. Apermancent fsh cell(EPC) for genotoxicity testing of marine sediments with the comet assay. Mutat Res 2001; 498(1-2): 67-77
11 Tunc O, Thompson J, Trem Ellen K. Improvement in sperm DNA quality using an oral antioxidant therapy. Reprod Biom Online 2009 18(6): 761-768
(2016-08-05收稿)
Influence of the sperm DNA integrity on the clinical pregnancy outcomes of in vitro fertilization and embryo transfer
Wang Lihu1*, Wang Yan2, Liang Jiaying1, Yang Shaofen1, Yang Xuhui1, Zhang Jie1, Zhu Zhaoping1, Yi Yanhong1
1.Center of Reproductive Health and Infertility, Guangdong Women and Children's Hospital,Guangzhou 510010,Guangdong, China; 2.Guangzhou Kingmed Center for Clinical Laboratory
Wang lihu, E-mail:wanglihu25@163.com; Tel:13501540187
ObjectiveTo investigate the infuence of sperm DNA integrity on the clinical pregnancy outcomes of in vitro fertilization (IVF-ET).MethodsThis study included 203 couples accepted conventional IVF-ET cycles. 193 couples had fnally fnished the study due to cancelling 10 cases. Sperm chromatin dispersion (SCD) was used to test sperm DNA integrity. According to the level of sperm fragmentation index(DFI) and weather treatment the high DFI or not, the cases were divided into the normal DFI group(DFI<30%) and the abnormal DFI group(DFI≥30%) group and treatment DFI group(DFI≥30% after treatment), and the results among the three groups were compared.ResultsNo statistically signifcant correlation were observed among sperm DFI with fertilization rates, 2PN fertilization rates and zygote transgene rates (P>0.05), but DFI was negatively correlated with the optimal embryo rates (P<0.05) between the normal DFI group and the abnormal DFI group or between the abnormal DFI group and the treatment DFI group. The implantation rate and clinical pregnancy rate in the normal DFI group and the treatment DFI group were higher than the abnormal DFI group,showing signifcant difference (P<0.05). No statistically signifcant difference was observed between the normal DFI groupand the treatment DFI group.ConclusionIn IVF-ET treatment,the sperm DNA integrity has no effect on fertilization rate,2PN fertilization rates and zygote transgene rates,but DFI has negative effect on optimal embryo rates,implantation rate and clinical pregnancy rate. The optimal embryo rates, implantation rate and clinical pregnancy rate might increased if DFI exceeded 30% after treatment.
fertilization in vitro; sperm DNA integrity; pregnancy outcome
10.3969/j.issn.1008-0848.2016.10.008
R 321-33
*通讯作者,E-mail:wanglihu25@163.com; Tel:13501540187

