长筒石蒜组织培养中器官发生的MSAP分析*
刘合霞,李 博,周 坚
(1.广西壮族自治区中国科学院广西植物研究所园林园艺研究中心,广西 桂林541006;2.桂林师范高等专科学校化学与药学系,广西 桂林541001;3.南京林业大学生物与环境学院,江苏 南京210037)
长筒石蒜组织培养中器官发生的MSAP分析*
刘合霞1,李 博2,周 坚3
(1.广西壮族自治区中国科学院广西植物研究所园林园艺研究中心,广西 桂林541006;2.桂林师范高等专科学校化学与药学系,广西 桂林541001;3.南京林业大学生物与环境学院,江苏 南京210037)
采用甲基化敏感扩增多态性技术,从 64 对 MSAP 选扩引物中,选出扩增清晰、可辨且可重复的 51 对 MSAP 引物组合,扩增获得长筒石蒜种子胚、愈伤组织、苗等3个不同发育时期的 DNA胞嘧啶甲基化修饰水平及 MSAP扩增图谱。结果表明,种子胚基因组中有 68.0%(全甲基化 50.2%、半甲基化 49.8%)、愈伤组织60.0%(全甲基化 52.2%、半甲基化 47.8%)、苗64.3%(全甲基化 40.8%、半甲基化 59.2% )的CCGG/GGCC 位点发生胞嘧啶甲基化。3个不同时期甲基化的水平互有差异,依据超甲基化/去甲基化的修饰机理分析,甲基化水平的变化或许导致了长筒石蒜不同的器官发生。
长筒石蒜;MSAP;器官发生
石蒜属LycorisHerb.植物系单子叶植物纲石蒜科Amaryllidaceae植物,别名老鸦蒜、蒜头草,有些地方因多数种类花被裂片强烈反卷而称其为龙爪花,还有些地方因其鳞茎有毒性,可作土农药杀灭害虫,又称之为蟑螂花[1],为多年生草本植物[2]。石蒜属植物多生长在河岸草地、阴湿山地及溪谷中,花色丰富,花型奇特,且含有10多种生物碱,是一种具有极高药用价值和观赏价值的经济植物,在园林绿化、景观植物生物多样性研究、居室美化以及药物利用推广研究中有着极好的前景[3-6]。
中国作为石蒜属植物的主要产地,对石蒜属植物做了大量的研究工作。对石蒜属植物的相关研究主要集中在系统分类,核型分析,无性繁殖,与部分种和品种的亲缘关系,杂交育种,栽培繁殖技术,孢粉学研究,生物碱的提取,以及在园林中的应用等方面[7-11],石蒜属植物生长发育方面的研究较少。
近年来市场上对石蒜属植物的需求量日益增加,但石蒜有性杂交结实率很低,大部分是花而不实[12];其自然分球繁殖系数低、速度慢,因而它的快速繁殖成为迫切需要解决的问题[13]。组织培养是快速有效的无性繁殖技术,石蒜的组织培养研究主要集中在小鳞茎增殖、不定芽诱导、分化、生根移栽等方面。目前对石蒜属植物组织培养的研究较多,主要以鳞茎等为外植体,通过器官发生途径获得再生植株,利用种胚诱导愈伤组织,再诱导细胞分化获得完整植株是较好的获得批量石蒜球的途径。长筒石蒜Lycorislongituba原产中国东部,为我国所特有,长江中下游地区有野生种分布。在长筒石蒜中,李冬梅[14]已初步建立了这一技术体系。
DNA甲基化(DNA methylation)是表观遗传学研究的热点之一[15]。作为一种主要的表观遗传修饰,在高等植物基因组中普遍存在。它在调控基因表达、基因组印记、抑制转座子活性和保持基因组稳定等方面起着重要的作用[16-17]。在植物中,它主要在植物的生长、发育、器官分化及基因表达调控等过程中发挥重要作用[18-19]。长筒石蒜的DNA甲基化研究较少,何秋伶[20]检测到的长筒石蒜总甲基化率分别为 86.1%(二倍体),77.7%(三倍体) 和 80.2%(四倍体);其中,二倍体全甲基化率为 79.1%、半甲基化率20.9%;三倍体全甲基化率为77.6%、半甲基化率为22.4%;四倍体全甲基化率为 81.2%、半甲基化率为18.8%。甲基化敏感扩增多态性(MSAP)技术已被广泛应用于植物胞嘧啶甲基化的水平和模式的分析[21]。本研究用长筒石蒜不同发育阶段的组培材料进行了长筒石蒜的MSAP分析,旨在探讨长筒石蒜在组织培养过程中DNA甲基化参与器官发生的机理,为其快速繁殖提供理论支持。
1 材料与方法
1.1 实验材料
实验材料见图1-3。
1.2 实验方法
1.2.1 总DNA提取 本研究用DP305——植物基因组提取试剂盒(离心柱型,TIANGEN),最终提取到符合MSAP实验要求的长筒石蒜基因组DNA。所提取DNA用One drop微量紫外分光光度计测定其浓度。依据A260/A280的比值判断 DNA 样品的纯度,经w=1%的琼脂糖凝胶电泳分析,-20 ℃保存备用。
1.2.2 MSAP实验方法 参考前人的试验方法[20-25],对长筒石蒜基因组DNA进行酶切、连接、预扩增、选择性扩增、w=6%聚丙烯酰胺凝胶电泳、银染染色、读带和数据整理。试验中所用接头、预扩、选择性扩增引物序列所用引物见表1。
图1 长筒石蒜的种子胚Fig.1 Seed embryo of Lycoris longituba

图2 长筒石蒜的愈伤组织Fig.2 Callus of Lycoris longituba

图3 长筒石蒜的组培苗Fig.3 Somaclone of Lycoris longituba
表1 MSAP 接头和引物核苷酸序列1)
Table1 MSAP adapters and primer nucleotide sequences

EcoRIHpaⅡ/MspI接头15′-CTCGTAGACTGCGTACC-3′5′-GACGATGAGTCCTGAG-3′接头25′-AATTGGTACGCAGTC-3′5′-CGCTCAGGACTCAT-3′预扩引物选扩引物1选扩引物2选扩引物3选扩引物4选扩引物5选扩引物6选扩引物7选扩引物85′-GACTGCGTACCAATTCA-3′(E00)EcoRⅠ+AAC(E01)EcoRⅠ+AAG(E02)EcoRⅠ+ACA(E03)EcoRⅠ+ACG(E04)EcoRⅠ+ACC(E05)EcoRⅠ+ACT(E06)EcoRⅠ+AGG(E07)EcoRⅠ+AGC(E08)5′-GATGAGTCCTGAGCGGC-3′(HM00)HpaⅡ/MspⅠ+CAA(HM01)HpaⅡ/MspⅠ+CAC(HM02)HpaⅡ/MspⅠ+CAG(HM03)HpaⅡ/MspⅠ+CAT(HM04)HpaⅡ/MspⅠ+CTA(HM05)HpaⅡ/MspⅠ+CTC(HM06)HpaⅡ/MspⅠ+CTG(HM07)HpaⅡ/MspⅠ+CTT(HM08)
1) E01-E08、HM01-HM08共16条选择性扩增引物
2 结果与分析
2.1 DNA提取和酶切实验结果
用DP305——植物基因组提取试剂盒提取的DNA在w=1%的琼脂糖凝胶电泳后,用凝胶成像系统拍照,结果如图4,可见一条明显的带,表明其完整性较好;用One drop微量紫外分光光度计测A值如表2,表明纯度及质量浓度均较高,满足MSAP的实验要求,为后续实验奠定了良好的基础。

表2 One drop微量紫外分光光度计测得的DNA结果
DNA酶切后产物在w=1%的琼脂糖凝胶电泳后,在紫外仪上用佳能照相机拍照,结果如图5, DNA呈现弥散状态,分布于100~1 000 bp之间,表明酶切效率较高,达到了预期的结果。
2.2 预扩增和选扩增实验结果
2.2.1 预扩增实验结果 预扩增引物见表1。预扩增试验方法参照薛梅[23],使用优化后的预扩增 PCR 体系为:
10×PCR Buffer 2 μL; dNTP Mix(2.5 mmol/L) 1.5 μL; MgCl2(25 mmol/L) 1.2 μL;HpaⅡ/MspⅠ引物(25 ng/μL) 2 μL;EcoRⅠ 引物(25 ng/μL) 2 μL; Ex Taq(5 U/μL) 0.1 μL; 上一步的 DNA 模板 0.5 μL;加dd H2O至20 μL。
预扩增程序:
94 ℃ 3 min;94 ℃ 30 s;56 ℃ 30 s,30 cycles;72 ℃ 2 min 30 cycles;72 ℃ 5 min。

图4 w=1%的琼脂糖凝胶电泳Fig.4 Result of 1% Agarose gel electrophoresis
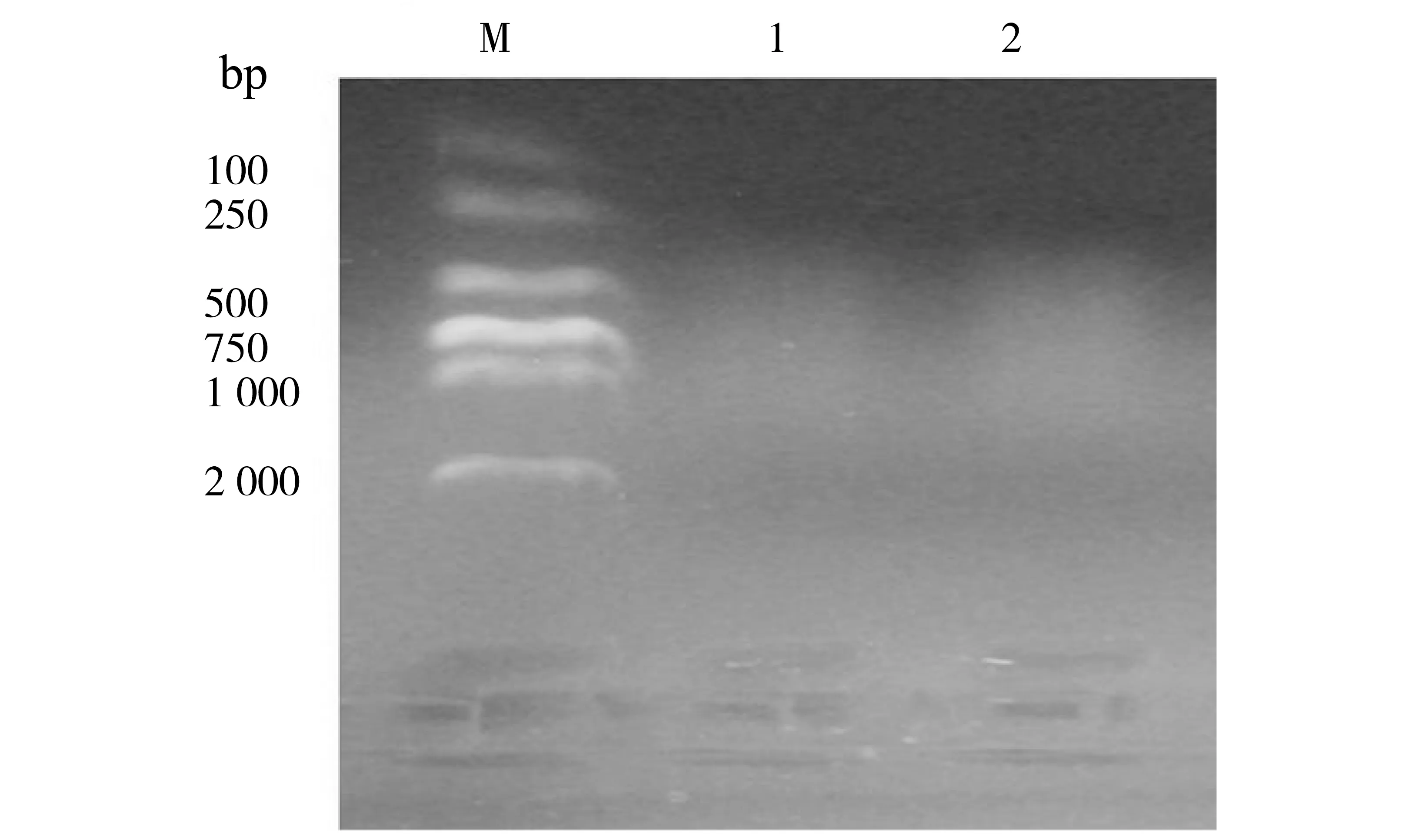
图5 EcoRⅠ、HpaⅡ/MspⅠ酶切DNA的电泳结果Fig.5 DNA digested by EcoRI and HpaⅡ/MspⅠM:DL2000;
扩增结束后将反应混合物稀释25倍用作下一步扩增的模板,进行选择性扩增。
预扩增实验结果经w=1%的琼脂糖凝胶电泳后,结果如图6,预扩增后产物为一条弥散的谱带,说明整个预扩增过程良好,内有几条较为清晰的带,预扩增产物长度集中在100~1 000 bp,表明预扩增结果较好,达到了预期的结果。

图6 预扩增电泳实验结果Fig.6 The pre-amplifying results

图7 选择性扩增实验结果Fig.7 The selective amplifying result
2.2.2 选扩增实验结果 选扩增引物见表1。选扩增实验方法参照吴春太[23],使用优化后的DNA选择性扩增程序如下:
选择性扩增体系:
10×PCR Buffer 2 μL;dNTP Mix(2.5 mmol/L) 1.6 μL;MgCl2 (25 mmol/L) 1.6 μL;HpaⅡ/MspⅠ引物(20μmol·L-1/μL) 0.4 μL;EcoRⅠ引物(20 μmol·L-1/μL) 0.4 μL;ExTaq (5 U/μL) 0.1 μL;
上一步稀释好的 DNA 模板5.0 μL,加dd H2O至20 μL。
PCR反应条件:
94 ℃ 3 min

选择性扩增实验结果经w=1%的琼脂糖凝胶电泳后,结果如图7, DNA呈现弥散状态,分布于100~1 000 bp之间,可以看到一些模糊的条带,表明选择性扩增结果较好,达到了预期的结果。
2.3 聚丙烯酰胺凝胶电泳实验结果
2.3.1 聚丙烯酰胺凝胶电泳实验结果 聚丙烯酰胺凝胶电泳实验结果如图8,选择性扩增产物经w=6%聚丙烯酰胺凝胶电泳后,产物条带清楚、多态性好,大小主要分布在50~2 000 bp之间,表明聚丙烯酰胺凝胶电泳实验结果较好,达到了预期的结果。

图8 MSAP 分析中检测到的不同 DNA 甲基化模式变化类型Fig.8 Different changes of DNA methylation patterns detected in MSAP assay
1、3和5分别表示种子胚、愈伤组织、苗的基因组 DNA 经EcoRⅠ和HpaⅡ 酶切所产生的扩增结果;2、4和 6分别表示种子胚、愈伤组织、苗的基因组 DNA经EcoRⅠ和MspⅠ 酶切所产生的扩增结果;箭头指示不同的 DNA 甲基化模式变化类型。
2.3.2 不同发育阶段的长筒石蒜的甲基化水平 由于HpaⅡ 和MspⅠ的识别序列相同(5′-CCGG-3′),但对甲基化的敏感程度不同,即HpaⅡ 对内、外侧胞嘧啶全甲基化均敏感,即不能切割双链全甲基化的5mCCGG,C5mCGG 和5mC5mCGG,但能切割单链甲基化的序列,而MspⅠ对外侧胞嘧啶甲基化敏感,能切割 C5mCGG 但不能切割5mCCGG 序列。因此在 PAGE 胶上,在任何一个特定 CCGG位点,任一材料的 E+H 和 E+M 两种酶切都可能出现4种情况的谱带:Ⅰ.E+H 和 E+M两种酶切中都有带;Ⅱ.E+H 有带,E+M 无带;Ⅲ. E+H 无带,E+M 有带;Ⅳ.E+H 和 E+M两种酶切中都无带。通过HpaⅡ 和MspⅠ 两种酶对 DNA 甲基化的敏感性差异可以反映如下信息:第Ⅰ种 CCGG 位点为非甲基化位点,第Ⅱ种是 CCGG 位点外侧胞嘧啶半甲基化,第Ⅲ种是 CCGG 位点内侧胞嘧啶全甲基化,第Ⅳ种较复杂,有3种可能性:其一是不存在 CCGG 位点;其二可能是 CCGG 位点外侧胞嘧啶全甲基化;其三是内侧和外侧胞嘧啶同时全甲基化(表3)。因此HpaⅡ 和MspⅠ 这两种酶只能准确识别前三种情况,它们的缺陷是不能识别 CCGG 位点外侧胞嘧啶的全甲基化、内外侧胞嘧啶同时全甲基化以及内侧胞嘧啶的半甲基化3种情况,因此使用 MSAP 技术分析得到的甲基化水平可能比实际的要低,但一些资料表明,两种酶所不能识别的前述甲基化类型出现的频率很低。
51个引物组合在不同倍性的长筒石蒜中可扩增出1 828条清晰可辨的条带,这些条带代表了1 828个可分辩的位点,在长筒石蒜种子胚基因组内检测到603 个,在愈伤组织中检测到527个,在苗中检测到 698个。检测到的总甲基化率分别为68.0%(种子胚),60.0%(愈伤组织)和64.3%(苗)(表4)。分析表明,在种子胚共检测到410个甲基化位点,其中 206个位点为全甲基化位点,全甲基化率为50.2%(206/410),而半甲基化率仅为 49.8%(204/410);在愈伤组织中全甲基化率和半甲基化率分别为 52.2% (165/316)和47.8%(151/316);而在苗中全甲基化率和半甲基化率分别为 40.8%(183/449)和59.2%(266/449)。可见,全甲基化和半甲基化之间差异明显。
2.3.3 不同发育阶段的长筒石蒜的甲基化模式 基于特定位点的变化模式,我们比较了种子胚与愈伤组织之间的胞嘧啶甲基化模式。在种子胚和愈伤组织中观察到的所有条带按甲基化位点的变化可以分为A、B、C、D 4大类,16 个亚类(表5)。A类:表示单态性条带,表明在种子胚和愈伤组织中察觉到相同的位点;B类:表示愈伤组织相应于种子胚甲基化减弱即发生去甲基化的位点;C类:表示愈伤组织相应于种子胚甲基化增强即发生超甲基化的位点类;D类:表示愈伤组织相应于种子胚之间的甲基化状态,在目前的分析中无法辨别。类型A 包含 4 个亚类,显示愈伤组织与种子胚相比,DNA 甲基化模式未发生改变,这样的 DNA 甲基化模式变化类型大约占所检测类型的33.53%。类型 B 包含 5 个亚类,表明愈伤组织与种子胚相比,25.38%的位点 DNA 甲基化程度升高,即发生了过甲基化(hypermethylation)。类型 C也包含 5 个亚类,该类型为愈伤组织与种子胚相比,基因组内相应位点 DNA 发生了去甲基化事件,40.02%的位点DNA 甲基化水平下降。类型 D,该种类型在目前的分析中无法辨别 DNA 甲基化的状态,因此不在分析之列,这样的位点不超过总检测位点 1.1%。

表3 根据同裂酶 Hpa Ⅱ 和 Msp Ⅰ 对 DNA 甲基化敏感性差异确定 CCGG 位点的甲基化状态1)
1)E+H:EcoRⅠ+HpaⅡ; E+M:EcoRⅠ+MspⅠ

表4 不同发育阶段的长筒石蒜基因组 DNA 经 MSAP 分析检测到的 DNA 甲基化水平
另外,相似的分析也在苗与愈伤组织的比较中进行,也检测到 4个大类,16 个亚类,详细结果见表6。所有的扩增模式也可分为 A、B、C、D 4 大类,16 个亚类。类型 A 也包含 4 个亚类,显示苗与愈伤组织相比,DNA 甲基化模式未发生改变,这样的 DNA 甲基化模式变化类型大约占所检测类型的42.74%。类型 B 也包含 5 个亚类,表明苗与愈伤组织相比,29.75%的位点 DNA 甲基化程度升高,即发生了过甲基化。类型 C也包含 5 个亚类,该类型为苗与愈伤组织相比,基因组内相应位点 DNA 发生了去甲基化事件,26.56%的位点DNA 甲基化水平下降。研究中也检测到一种类型,即类型 D,该种类型在目前的分析中无法辨别 DNA 甲基化的状态,因此不在分析之列,这样的位点不超过总检测位点 1.0%。
3 讨 论
植物 DNA 甲基化水平在植物的不同组织及不同生长时期都会有差异,这在番茄、玉米和水稻中已有过报道[26]。本研究发现,长筒石蒜种子胚基因组中有 68.0%、愈伤组织60.0%、苗64.3%的CCGG/GGCC 位点发生胞嘧啶甲基化。这一结果与何秋伶[20]检测的长筒石蒜总甲基化率为 86.1%(二倍体),77.7%(三倍体) 和 80.2%(四倍体)的结果非常相近;和半夏PinelliaTuber甲基化水平54%~58%[23]、黑麦Secalecereale甲基化比例(51.72%)结果较为相近[27];与拟南芥幼苗组织 35%~43% 的甲基化水平有一些差异[28];与毛竹[29]甲基化率24.44%(5年龄)、28.21%(31年龄)、32.12%(>60年龄)和水稻剑叶组织 16.3%的甲基化水平差异较大[30]。分析这与不同物种有关,还可能与检测方法(如引物数目、扩增条件、电泳时间和显带方法等)和实验材料(如种子,幼苗和成熟叶片等)有关。

表5 长筒石蒜愈伤组织与种子胚的DNA 甲基化模式变化
1)括号内的数字代表该甲基化模式数占总检测类型数的比率
高等植物基因组中,大约20%~50%的胞嘧啶处于甲基化状态,这对植物维持正常的生长发育所必需的[31-33]。本研究中,甲基化水平比这个数字稍高,估计是组织培养导致的。组织培养导致植物体甲基化水平升高还是降低在不同的研究者得到的结果不尽相同,如组织培养导致香蕉和豌豆甲基化水平上升[34-35];大麦、大豆和草莓FragariaananassaDuch.甲基化水平下降[36-38];油棕ElaeisguineensisJacq.甲基化水平随时间不同而变化[39]。

表6 长筒石蒜苗与愈伤组织的DNA 甲基化模式变化
1)括号内的数字代表该甲基化模式数占总检测类型数的比率
甲基化并不改变 DNA 的碱基排列顺序,但是可以抑制遗传信息的传递,从而引起形态性状的变化[40]。DNA甲基化是高等植物中普遍存在的一种常见DNA共价修饰方式,可以通过参与基因表达的调控进而调节生长发育[41]。在植物生长发育过程中,如果DNA甲基化水平非正常变化,将会导致发育异常、生活力下降等诸多表型变异[42]。在春化阶段初期,油菜籽具有广泛的DNA去甲基化[43]。DNA 去甲基化引起了转基因拟南芥植株的表型性状的巨大变异[44]。Konstantin V. Kiselev[16]对山葡萄Vitisamurensis的研究表明,DNA甲基化可能通过调节STS基因的表达参与了白藜芦醇的生物合成的控制。
组织培养中,往往会添加各种植物生长调节剂于培养基中,植物生长调节剂的作用不容忽视。已有研究表明:植物组织培养过程中培养基中一些生长调节因子,如2,4-D,奈乙酸等的应用均能使基因发生甲基化,不同的激素浓度和组成对培养物DNA甲基化水平有影响[45]。激素的刺激可导致整个基因组甲基化水平的变化[46]。
生命活动中DNA的甲基化现象与基因表达调控、胚胎发育、细胞分化、基因组印迹、性染色体失活、系统发育以及细胞记忆等诸多生物学过程密切相关[31,47-49],是当今表观遗传学研究的活跃领域。本研究结果对长筒石蒜组织培养过程中的器官发生机理研究具有一定的指导作用,具体机制有待于进一步研究。
[1] 秦卫华,周守标,汪恒英,等.石蒜属植物的研究进展[J].安徽师范大学学报(自然科学版),2003,26(4):385-390.
[2] 殷培峰,汪美英.安徽琅琊山石蒜属植物分布及开发应用[J].资源开发与市场,2008,24(9):823-833.
[3] 谢峻,谈锋,冯巍,等.石蒜属植物分类鉴别、药用成分及生物技术应用研究进展[J].中草药,2007,38(12):1902-1905.
[4] 袁菊红,胡绵好,张明霞,等.石蒜种质资源的数量分类[J].浙江林学院学报,2009,26(5):633-638.
[5] 中国科学院中国植物志编辑委员会.中国植物志(16 卷)1分册[M].北京:科学出版社,1985:16-18.
[6] 邓传良.石蒜属植物系统学及长筒石蒜遗传多样性研究[D].南京:南京林业大学博士研究生论文, 2005.
[7] 王光萍,陈英,周坚.长筒石蒜鳞片诱导和植株再生[J].植物生理学通讯,2005 ,41(4):457-460.
[8] 任秀芳,周守标,郑艳,等. 中国石蒜属植物花粉形态的研究[J].云南植物研究,1995,17(2):182-186.
[9] 张露,王光萍,曹福亮.石蒜类植物无性繁殖技术[J].南京林业大学学报:自然科学版, 2002,26(4):1-5.
[10] 柯丽霞, 孙叶根, 郑艳,等.石蒜属三种植物的核型研究[J].安徽师范大学报,1998, 21(4):343-348.
[11] 秦瑞云,邓传良.长筒石蒜的C带分析[J].江西农业大学学报,2007,29(1):156-157.
[12] 戴叶辉,张露,柳正葳,等.石蒜有性生殖败育的原因探讨[J].仲恺农业工程学院学报,2011,24(3):12-15.
[13] 朱景存,张玉琼,刘春滟,等.石蒜组织培养和植株再生的研究[J].生物学杂志,2010,27(06):46-48.
[14] 李冬梅.中国石蒜和长筒石蒜胚组织培养的初步研究[D].南京:南京林业大学硕士研究生论文, 2011.
[15] 杜亚琼,王子成.甘露醇对拟南芥基因组DNA甲基化的影响[J].植物学报,2011, 46(3):285-292.
[16] KISELEV K V, TYUNIN A P, YURI N. Involvement of DNA methylation in the regulation of STS10 gene expression inVitisamurensis[J]. Planta,2013, 237:933-941.
[17] FINNEGAN E J,GENGER R K,PEACOCK W J, et al. DNA methylation in plants[J].Annu Rev Plant Physiol Plant Mol Biol, 1998,49:223-247.
[18] FINNEGAN E J, PEACOCK W J, DENNIS E S. DNA methylation, a key regulator of plant development and other processes[J].Curr Opin Genet Dev,2000, 10(2):217-223.
[19] 刘合霞,周坚.DNA甲基化对植物发育调控的研究进展[J].安徽农业科学,2012,40(2):637-639,672.
[20] 何秋伶.长筒石蒜花色变异的分子基础[D].南京:南京林业大学,2009.
[21] 王文国,李锐,朱珈仪,等.水稻愈伤组织形成过程中甲基化对 OsMAPK2 的表达调控[J].遗传,2010,32(12):1275-1280.
[22] 盖树鹏,张风,张玉喜,等.低温解除牡丹休眠进程中基因组 DNA 甲基化敏感扩增多态性(MSAP) 分析[J].农业生物技术学报2012,20(3):261-267.
[23] 薛梅,陈成彬,陈力,等.半夏多倍体复合体基因组DNA甲基化状态的MSAP分析[J].中草药,2008,39(11):1713-1716.
[24] 吴春太,李维国,黄华孙.橡胶树 MSAP 反应体系的建立及其对无性系DNA 的甲基化分析[J].广东农业科学,2011(9):141-144.
[25] 何艳霞,王子成,曹红平,等.光暗条件下大蒜甲基化差异的初步研究[J].植物生理学通讯,2007,32:85-88.
[26] 陆光远,伍晓明,陈碧云,等.油菜种子萌发过程中 DNA 甲基化的 MSAP分析[J].科学通报, 2005,50(24):2750-2756.
[27] 张勇,邓科君,张韬,等.黑麦基因组DNA甲基化修饰位点的MSAP分析[J].麦类作物学报,2009,29(4):559-564.
[28] CERVARA M T, RUIN-GARCIA L, MARTINEZ-ZAPATER J M. Analysis of DNA methylation inArabidopsisthalianabased on methylation-sensitive AFLP markers[J].Mol Genet Genomics, 2002, 268(4):543-552.
[29] 郭广平,顾小平,袁金玲,等.不同生理年龄毛竹DNA甲基化的MSAP分析[J].遗传,2011,33(7):794-800.
[30] XIONG L Z, XU C G, SAGHAI M A, et al. Patterns of cytosine methylation in an elite rice hybrid and its parental lines detected by methylation sensitive amplification polymorphism technique[J].Mol Gen Genet, 1999, 261(3): 439-446.
[31] CHAN S W L, HENDERSON I R, JACOBSEN S E. Gardening the genome: DNA methylationArabidopsisthaliana[J].Nature Reviews Genetics,2005,6:351-360.
[32] ZHANG X Y, YAZAKI J, SUNDARESAN A,et al. Genome-wide high resolution mapping and functional analysis of DNA methylation inArabidopsis[J].Cell,2006,12:1189-1201.
[33] ZILBERMAN D, GEHRING M, TRAN R K, et al. Genome-wide analysis ofArabidopsisthalianaDNA methylation uncovers an interdependence between methylation and transcription [J]. Nature Gnetics,2007,39:61-69.
[34] PERAZA-ECHEVERRIA S,HERRERA-VALENCIA V A,JAMES-KAY A.Detection of DNA methylation changes in micropropagted banana plants using methylation-sensitive amplification polymorphism (MSAP) [J].Plant Sci, 2001,161:359-367.
[35] SMYKAL P,VALLEDOR L,RODRIGUEZ R, et al. Assessment of genetic and epigenetic stability in long-term in vitro shoot culture of pea(PisumsativumL.) [J].Plant Cell Rep, 2007,26:1985-1998.
[36] LI X L,YU X M,WANG N N, et al. Genetic and epigenetic instabilities induced by tissue culture in wild barley (Hordeumbrevisubulatum(Trin.)Link) [J].Plant Cell Tiss Organ Cult, 2007,90:153-168.
[37] QUEMADA H, ROTH E J,LARK J K.Changes in mythylation of tissue cultured soybean cells detected by digestion with the restriction enzymesHpaⅡ andMspⅠ[J].Plant Cell Rep, 1987,6:63-66.
[38] 韩柏明,赵凯,李贺,等.组织培养导致的草莓DNA甲基化变异[J].植物生理学通讯,2010,46(8): 797-802.
[39] RIVAL A, ILBERT P, LABEYRIE A, et al. Variations in genomic DNA methylation during the long-term in vitro proliferation of oil palm embryogenic suspension cultures[J].Plant Cell Reports, 2013, 32( 3):359-368.
[40] HOLLIDAY R. The inheritance of epigenetic defects[J]. Science, 1987,238(4824): 163-170.
[41] 袁金玲,郭广平,岳晋军,等.孝顺竹开花过程中DNA甲基化水平动态研究[J].西北植物学报,2012,32(1):0060-0066.
[42] VAUGHN M W, TANURD I C M, LIPPMAN Z, et al. Epigenetic natural variation inArabidopsisthaliana[J].Plos Biology,2007,5:174.
[43] GUZY WROBELSKA J, FILEK M, KALICIAK A,et al. Vernalization and photoperiod-related changes in the DNA methylation state in winter and spring rapeseed[J]. Acta Physiologiae Plantarum[J]. 2013, 35(3): 817-827.
[44] RONEMUS M J,GALBIATI M, TCHNOR C, et al. Demethylation-induced developmental pleiotropy in Arabidopsis[J]. Science, 1996,273(5275): 654-657.
[45] LOSCHIAVO F, PITTO L, GIULIANO G, et al. DNA methylation of embryogenic carrot cell cultures and its variations as caused bymutation, differentiation, hormones and hypomethylating drugs[J].Theor Appl Genet,1989,77: 325-331.
[46] VANYUSHIN B F, KIRNOS M D. DNA methylation in plants[J].Gene, 1988, 74(1): 117-121.
[47] GUIMIL S, DUNAND C. Patterning ofArabidopsisepidermalcells:epigenetic factors regulate the complex epidermal cell fate pathway [J].Trends Plant Science,2006,11:601-609.
[48] HENDERSON I R, JACOBSEN S E. Epigenetic inheritance in plants[J].Nature,2007,447:418-424.
[49] SAZE H, SHIRAISHI A, MIURA A,et al. Control of genic DNA methylation by a jmjC domain-containing protein inArabidopsisthaliana[J].Science,2008,319:462-465.
MSAP analysis ofLycorislongitubaorganogenesis in tissue culture
LIUHexia1,LIBo2,ZHOUJian3
(1.Center for Gardens and Horticultural Studies, Guangxi Institute of Botany, Guangxi Zhuang Autonomous Region and the Chinese Academy of Sciences, Guilin 541006,China;2.Department of Chemistry and Engineering Technology,Guilin Normal College, Guilin 541001,China;3.College of Biology and the Environment, Nanjing Forestry University, Nanjing 210037,China)
In this study, DNA cytosine methylation modification level and MSAP amplification graphs ofLycorislongitubawere obtained from seed embryo, callus and seedling via methylation sensitive amplification polymorphism technology. We found that 51 pairs of MSAP selective amplifying primer combinations were good in 64 pairs of the MSAP selective amplifying primer combinations.The results showed that the cytosine methylation rates were 68.0% in seed embryo (full methylation:50.2% and half methylation:49.8%), 60.0% in callus(full methylation:52.2% and half methylation:47.8%) and 64.3% in seeding(full methylation:40.8% and half methylation:59.2%).The level of methylation differed with each other in the three different statges. So, it is suggested that changes of the level of methylation may had led to their different organs ofLycorislongitubabased on the modification mechanism of super methylation/demethylation analysis.
Lycorislongituba;MSAP;organogenesis
10.13471/j.cnki.acta.snus.2016.02.019
2015-08-31
广西植物研究所基本科研业务费资助项目(桂植业14003);国家林业公益性行业科研专项资助项目(201004056);江苏省研究生培养创新工程资助项目(CXZZ12-0519)
刘合霞(1984年生),女;研究方向:药用植物与植物发育学;通讯作者:周坚;E-mail:zhiwu@njfu.edu.cn
Q78
A
0529-6579(2016)02-0102-09

