类光-芬顿体系PW11O39Fe(Ⅲ)(H2O)4-/H2O2可见光催化降解罗丹明B*
陈 艳,黎杜雷,杨金曼,高文凯,华英杰, 王崇太
(海南师范大学化工学院,海南 海口 571158)
类光-芬顿体系PW11O39Fe(Ⅲ)(H2O)4-/H2O2可见光催化降解罗丹明B*
陈 艳,黎杜雷,杨金曼,高文凯,华英杰, 王崇太
(海南师范大学化工学院,海南 海口 571158)
以Keggin型铁取代杂多阴离子PW11O39Fe(Ⅲ)(H2O)4-(PW11Fe)为可见光活性组分构建了一个类光-芬顿体系(PW11Fe/H2O2),并用于模型污染物罗丹明B(RhB)的可见光催化降解,同时考察了H2O2浓度、PW11Fe浓度、RhB初始浓度及溶液pH值对RhB可见光催化降解速率的影响,讨论了RhB光催化降解的动力学性质。实验结果表明,当溶液pH=4.5时,由0.6 mmol·L-1PW11Fe和 4 mmol·L-1H2O2构成的体系对RhB的光催化降解效果最佳,0.01 mmol·L-1的 RhB在250 W金卤灯照射下反应60 min, 其降解率达到100%,反应240 min,总有机碳(TOC)去除率约48%。羟基自由基猝灭和电子顺磁共振(EPR)实验表明,PW11Fe/H2O2体系在可见光照射下产生羟基自由基,从而导致RhB的快速降解,降解反应的表观速率常数k为(6.2±2)×10-2mmol·L-1·min-1。
Keggin型铁取代杂多阴离子;过氧化氢;罗丹明B;均相光催化;电子顺磁共振
罗丹明B (RhB)属三苯甲烷类染料,广泛应用于纺织、印刷、食品和化妆品行业,但其产生的废水已成为主要的水体污染源之一,如何去除这类染料污染物一直是一个重要的研究课题[1-5]。普通的化学法和常规的絮凝、树脂吸附法存在着二次污染问题。生化法则存在处理速率慢、周期长等缺点[2]。

为了评估PW11Fe/H2O2体系在可见光下催化降解有机染料污染物的效果,本文选择RhB作为模型污染物,通过测定RhB降解的动力学曲线和矿化度,探讨反应的动力学机理,同时考察H2O2、PW11Fe、RhB浓度和溶液pH值对光催化降解反应速率的影响,从而为PW11Fe/H2O2体系的实际应用提供实验基础及科学依据。
1 材料与方法
1.1 试剂
钨酸钠(北京化工厂);磷酸氢二钠(天津市化学试剂一厂);硫酸亚铁(天津市福晨化学试剂厂);丙酮、过氧化氢、硝酸铁、硫酸氢钠和罗丹明B(广州化学试剂厂),以上试剂均为分析纯。Keggin型缺位杂多酸盐Na7PW11O39和铁取代杂多酸盐Na7PW11O39Fe(Ⅲ)按参考文献的方法合成[26-27],并经红外光谱、紫外光谱和循环伏安表征。
1.2 实验仪器与方法
光催化降解反应在XPA-7型系列光化学反应仪(南京胥江机电厂)中进行,光源为250 W金卤灯(λ>400 nm),用滤光片滤去紫外部分;RhB浓度用TU-1901型紫外-可见分光光谱仪(北京普析通用仪器有限责任公司)测定; 溶液pH在pHs-3C型酸度计(上海康仪仪器有限公司)上调节,溶液中的总有机碳(TOC)用TOC-VCPH型TOC分析仪(日本岛津)测定;羟基自由基的检测在A320型顺磁共振波谱仪(德国Bruker公司)上完成。
典型的光催化降解反应步骤如下:PW11Fe光催化降解RhB的实验在光催化反应仪中进行,以250 W金卤灯(λ>400 nm)模拟太阳可见光作为光源。在整个反应过程中,每隔一定的时间间隔,每次抽取4 mL反应液用于测定RhB浓度。除非指明,实验温度为室温,实验用水为二次蒸馏水,不同pH溶液用稀NaOH溶液和0.1 mol/L NaHSO4溶液在酸度计上进行调节。
2 结果与讨论
2.1 PW11Fe/H2O2对RhB降解的光催化作用
图1为不同条件下RhB降解的相对浓度c/c0与反应时间t的关系曲线。从图中可以看到,在可见光下比较稳定的RhB(曲线a),在其水溶液中加入PW11Fe后,RhB降解的速率明显增加,但增加的幅度不大,光照120 min,RhB的降解率约20%(曲线c);但当溶液中同时加入H2O2时,RhB降解的速率急剧增加,光照60 min,其降解率几乎达到100% (曲线d)。而同样含有PW11Fe和H2O2的RhB溶液若放置在暗处,即使120 min,RhB也没有发生降解(曲线e)。上述结果表明,PW11Fe在可见光照射下对RhB的降解产生了催化作用。在没有H2O2存在的情况下,PW11Fe受光激发,原位产生了H2O2,H2O2与还原态的PW11Fe继续反应则产生羟基自由基HO·,由于HO·的强氧化性,最终导致RhB降解[23]。在本实验条件下,由于所用的金卤灯经滤光片滤光后,余下的可见光强度较弱,原位生成的H2O2浓度较低,产生HO·的量较少,因此,RhB降解的速率较慢。外加H2O2后,光催化产生HO·的量大大增加,因而RhB降解的速率急剧增大。

图1 不同条件下RhB降解的相对浓度c/c0与反应时间t曲线Fig.1 c/c0~t curves of RhB degradation[RhB]=0.01 mmol·L-1,[H2O2] =4 mmol·L-1,[PW11Fe]=0.6 mmol·L-1, pH=4.5, 250 W metal halide lamp
为了证实导致RhB降解的氧活性物质是HO·,用甲醇作为猝灭剂进行了羟基自由基猝灭实验,并进一步用二甲基吡啶N-氧化物(DMPO)作为羟基自由基的电子捕获剂,进行了电子顺磁共振实验,结果如图2所示。从图中可以看到,当RhB的降解反应进行到10 min后,向体系中加入甲醇,RhB降解的速率立即变慢乃至终止(图2A曲线b),从而间接证明了HO·的存在。电子顺磁共振信号为一个强度比为1∶2∶2∶1的四重峰(图2B),更是HO·存在的强有力证据[28]。测定光催化反应120min后RhB溶液的总有机碳(TOC)含量(图3),结果显示,TOC 的去除率为48%,表明羟基自由基不仅导致 RhB 开环降解,而且使RhB矿化为CO2和H2O。

图2 (A)甲醇对羟基自由基的猝灭作用:(a) RhB + PW11Fe,(b) a体系反应10 min后加入甲醇; (B) DMPO-HO·的EPR信号Fig.2 (A) Quenching effect on the methanol on hydroxyl radicals: (a) RhB + PW11Fe; (b) Methanol was added to (a) system after reaction of 10 min; (B) The EPR signal of the DMPO-HO· adducts

图3 RhB降解过程TOC的变化Fig.3 Changes in solution TOC during RhB degradation [RhB]=0.01 mmol·L-1,[PW11Fe]=0.6 mmol·L-1,[H2O2]=4 mmol·L-1,pH=4.5, 250 W metal halide lamp
对于上述实验结果,我们认为,在没有H2O2存在的情况下,PW11Fe的光催化活性主要是通过Od→dFe(Ⅲ)荷移跃迁来实现的,因为PW11Fe在可见光区有两个吸收带,峰位置分别为400和460 nm,归属于Od→dFe(Ⅲ)和Ob,c→dFe(Ⅲ)荷移跃迁[19]。在本实验条件下,光源的主波长为420 nm,在Od→dFe(Ⅲ)荷移跃迁的光吸收带范围内。PW11Fe吸收光子后,使配位在Fe(Ⅲ)上的H2O分子被氧化而产生羟基自由基。Od→dFe(Ⅲ)荷移跃迁产生的还原态Fe(Ⅱ)被溶液中溶解的分子氧(O2)或反应产生的HOO· 及HO·氧化后又转化为Fe(Ⅲ)[23]。当体系中存在H2O2时,Fe(Ⅲ)第六配位位置的H2O被H2O2置换,从而生成PW11Fe(Ⅲ)(H2O2),在光激发下其HOMO轨道的电子(即H2O2成键轨道σ2p上的一个电子)跃迁至Fe(Ⅲ)的3d轨道,然后转移给H2O2的σ*2p反键轨道,导致H2O2分解产生羟基自由基HO·,从而使RhB降解和矿化[21]。显然,外加H2O2时,HO·生成的速率更快,因而RhB降解的速率也更快。
2.2 H2O2浓度对RhB降解速率的影响
在外加H2O2的情况下,氧化降解RhB的羟基自由基HO·主要来源于H2O2的催化分解,因此,H2O2的浓度必然对RhB的降解速率产生影响。图4为不同H2O2浓度下RhB光催化降解的动力学曲线。由图可知,在H2O2浓度达到4 mmol·L-1之前,RhB降解的速率随H2O2浓度的增加而增大,然而,当H2O2的浓度超过4 mmol·L-1之后,RhB降解的速率反而下降。导致这种现象的原因,主要是由于较高浓度的H2O2易发生歧化反应并对羟基自由基产生“抑制”作用[10,19,29]。因此,RhB的光催化降解对H2O2浓度有一个最佳值,在本实验条件下,该值为4 mmol·L-1。

图4 H2O2浓度对RhB光降解速率的影响Fig.4 Effect of H2O2 concentration on RhB photo-catalytic degradation[PW11Fe]= 0.2 mmol·L-1,[RhB]=0.01 mmol·L-1,250 W metal halide lamp
2.3 PW11Fe浓度对RhB降解速率的影响
PW11Fe作为RhB光降解的催化剂,其浓度对RhB降解速率的影响如图5所示。当RhB和H2O2的浓度分别为0.01 mmol·L-1和4 mmol·L-1时,随着PW11Fe浓度的增加,RhB降解的速率随之增大,当PW11Fe的浓度为0.6 mmol·L-1时,RhB降解的速率达到最大(100%),之后PW11Fe浓度的增加,RhB降解的速率却有所下降,这是PW11Fe对羟基自由基产生猝灭作用的结果[21]。因此,RhB的光催化降解对PW11Fe的浓度也有一个最佳值,在本实验条件下,PW11Fe的最佳浓度为0.6 mmol·L-1。

图5 PW11Fe浓度对RhB光降解速率的影响Fig.5 Effect of PW11Fe concentration on the RhB photo-catalytic degtadation[H2O2]=4 mmol·L-1,[RhB]=0.01 mmol·L-1,250 W metal halide lamp
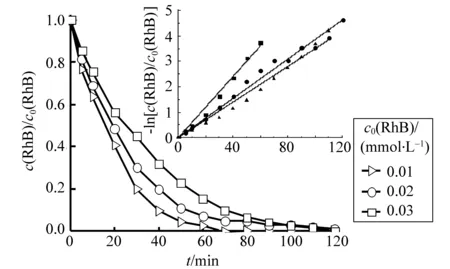
图6 RhB初始浓度对光催化降解速率的影响Fig.6 Influence of the initial RhB concentration on the photo-catalytic degradation rate[PW11Fe]= 0.6 mmol·L-1,[H2O2]= 4 mmol·L-1,250 W metal halide lamp
2.4 RhB初始浓度对其光降解速率的影响
图6为不同初始浓度下RhB光催化降解的相对浓度随反应时间变化的关系曲线。由图可知,尽管初始浓度不同,RhB浓度衰减的趋势却是相同的,只是RhB的初始浓度越高,其衰减到相同c/c0所需时间越长,也就是RhB降解的表观速率越慢。取-ln(c/c0) 对反应时间t做图,得到通过坐标原点的直线(图6插图),表明RhB的可见光催化降解服从准一级动力学方程。由直线斜率估算的准一级表观速率常数kobs和表观速率常数k列于表1中。

表1 RhB光催化降解的准一级表观速率常数kobs和表观速率常数k1)
1)k=kobs×c0(RhB)[27]
2.5 溶液pH对RhB降解速率的影响
pH对RhB光催化降解速率的影响如图7所示。RhB降解的速率先随溶液pH值的增大而增大,当pH=4.5时达到最大,反应50 min,RhB 的降解率约为100%;当pH>4.5后,RhB降解的速率反而下降。因为在溶液酸性较强(pH较小)的情况下, PW11Fe主要以PW11O39Fe(H2O)4-的形式存在,RhB与PW11Fe之间除了静电吸引作用之外,RhB分子结构中的胺基(C2H5)N—易取代PW11O39Fe(H2O)4-中的配位H2O,形成RhB→PW11Fe配合物,降低了PW11Fe的催化活性,因而RhB的降解速率较慢。但溶液酸性较弱(pH值较大)时,PW11Fe主要以PW11O39Fe(OH)5-的形式存在,不利于生成PW11O39Fe (H2O2)的配体交换反应,因而不利于光电子从H2O2的成键轨道向反键轨道转移,降低了羟基自由基产生的速率[21,23]。

图7 溶液pH对RhB光降解速率的影响Fig.7 Influence of the solution pH on the photo-catalytic degradation rate of RhB[PW11Fe]= 0.6 mmol·L-1,[H2O2]= 4 mmol·L-1,[RhB]= 0.01 mmol·L-1,250 W metal halide lamp
3 结 论
由PW11Fe构成的类光-芬顿体系在可见光照射下能有效地将光能转换为羟基自由基形式的化学能,并在较宽的pH范围内有效降解染料污染物RhB,克服了传统光-芬顿体系工作pH值低的缺陷,有可能在去除水体有机污染物方面获得应用。
[1] VINOD K N, PUTTASWAMY, GOWDA K N N. Oxidative decolorization of triphenylmethane dyes by chloramine-T in alkaline medium catalyzed by Pd(Ⅱ): a comparative spectrophotomeric kinetic and mechanistic approach [J]. J Mole Catal A: Chem, 2009, 298(1/2): 60-68.
[2] AYED L, CHAIEB K, CHEREF A, et al. Biodegradation of triphenylmethane dye malachite green by sphingomonas paucimobilis [J]. World J Microbiol Biotechnol, 2009, 25(4): 705-711.
[3] WEBER E J, ADAMS R L. Chemical-and sediment-mediated reduction of the azo dye disperse blue 79 [J]. Environ Sci Technol, 1995, 29(5): 1163-1170.
[4] GANESH R, BOARDMAN G D, MICHELSEN D. Fate of azo dyes in sludges [J]. Water Research, 1994, 28(6): 1367-1376.
[5] ZHANG F L, ZHAO J C, SHEN T, et al. TiO2-assisted photodegradation of dye pollutants II. adsorption and degradation kinetics of eosin in TiO2dispersions under visible light irradiation [J]. Appl Catal B: Environ, 1998, 15(1/2): 147-156.
[6] BRILLAS E, SIRÉS I, OTURAN M A. Electro-fenton process and related electrochemical technologies based on fenton’s reaction chemistry [J]. Chem Rev, 2009, 109(12): 6570-6631.
[7] BRILLAS E, BOYE B, SIRÉS I, et al. Electrochemical destruction of chlorophenoxy herbicides by anodic oxidation and electro-fenton using a boron-doped diamondelectrode [J]. Electrochim Acta, 2004, 49(25):4487-4496.
[8] OTURAN M A, PEIROTEN J, CHARTRIN P, et al. Complete destruction ofp-nitrophenol in aqueous medium by electro-Fenton method [J]. Environ Sci Technol, 2000, 34(16): 3474-3479.
[9] SANCHEZ-SANCHEZ C M, EXPOSITO E, CASADO J, et al. Goethite as a more effective iron dosage source for mineralization of organic pollutants by electro-fenton process [J]. Electrochem Commun, 2007, 9(1): 19-24.
[10] ZHAO X K, YANG G P, WANG Y J, et al. Photochemical degradation of dimethyl phthalate by fenton reagent [J]. Photochem Photobiol A: Chem, 2004, 161(2/3): 215-220.
[11] FUKUSHIMA M, TATSUMI K, MORIMOTO K. The fate of aniline after a photo-fenton reaction in an aqueous system containing iron(Ⅲ), humic acid, and hydrogen peroxide [J]. Environ Sci Technol, 2000, 34(10): 2006-2013.
[12] WU K Q, XIE Y D, ZHAO J C, et al. Photo-Fenton degradation of a dye under visible light irradiation[J]. J Mole Catal A: Chem, 1999, 144:77-84.
[13] KAMBLE S P, SAWANT S B, SCHOUTEN J C, et al. Photocatalytic and photochemical degradation of aniline using concentrated solar radiation [J]. J Chem Technol Biotechnol, 2003, 78(8): 865-872.
[14] KASSINOS D, VARNAVA N, MICHAEL C, et al. Homogeneous oxidation of aqueous solutions of atrazine and fenitrothion through dark and photo-fenton reactions [J]. Chemosphere, 2009, 74(6): 866-872.
[15] HORI H, ISHIDA K, INOUE N, et al. Photocatalytic mineralization of hydroper fluorocarboxylic acids with heteropolyacid H4SiW12O40in water [J]. Chemosphere, 2011, 82(8):1129-1134.

[17] HISKIA A, ECKE M, TROUPIS A, et al. Sonolytic, photolytic, and photocatalytic decomposition of atrazine in the presence of polyoxometalates[J]. Environ Sci Technol, 2001, 35(11):2358-2364.
[18] HORI H, YAMAMOTO A, KOIKE K, et al. Photocatalytic decomposition of a perfluoroether carboxylic acid by tungstic heteropolyacids in water [J]. Appl Catal B: Environ, 2008, 82(1/2):58-66.
[19] 王崇太, 孙振范, 华英杰, 等. Keggin 型铁取代杂多阴离子PW11O39Fe(Ⅲ)(H2O)4-光催化降解硝基苯[J]. 化学学报, 2010, 68(11): 1037-1042.
[20] 王崇太,华英杰, 刘希龙, 等.铬取代杂多阴离子PW11O39Cr(Ⅲ)(H2O)4-可见光催化降解罗丹明B[J]. 化学学报, 2012, 70(4): 399-404.
[21] 华英杰, 王崇太, 孙振范, 等.新颖的PW11O39Fe(Ⅲ)(H2O)4-/H2O2类光-芬顿体系光催化降解苯胺[J]. 应用化学, 2012, 29(1):63-68.
[22] 吴春燕, 刘希龙, 沈国英, 等. Keggin型铜取代磷钨杂多阴离子可见光催化降解罗丹明B[J]. 应用化学, 2012, 29(9):1030-1035.
[23] HUA Y J, WANG C T, LIU J Y, et al. Visible photocatalytic degradation of rhodamine B using Fe(Ⅲ)-substituted phosphotungstic heteropolyanion [J]. J Mole Catal A: Chem, 2012, 365: 8-14.
[24] HUA Y J, CHEN G L, XU X N, et al. Comparative study of homogeneous and heterogeneous photocatalytic degradation of RhB under visible light irradiation with Keggin-type manganese-substituted catalysts [J]. J Phys Chem C, 2014, 118(17): 8877-8884.
[25] 华英杰,徐孝南,邹晓梅,等.PW11O39Co(Ⅱ)(H2O)5-的均相及异相体系可见光催化性能研究[J]. 无机化学学报, 2014, 30(8):1895-1903.
[26] BREVARD C, SCHIMPF R, TOURNÉ G, et al. Tungsten-183NMR : A complete and unequivocal assignment of the tungstentungsten connectivities in heteropolytungstates via two-dimensional183W NMR Techniques [J]. J Am Chem Soc, 1983, 105(24): 7059-7063.
[27] WANG C T, HUA Y J, TONG Y X. A novel electro-fenton-like system using PW11O39Fe(Ⅲ)(H2O)4-as an electrocatalyst for wastewater treatment [J]. Electrochim Acta, 2010, 55(22):6755-6760.
[28] LUO Y, WANG X R, JI L L, et al. EPR detection of hydroxyl radical generation and its interaction with antioxidant system in carassius auratus Exposed to pentachlorophenol [J]. J Hazard Mater, 2009,171(1/2/3):1096-1102.
[29] AN J J, ZHU L H, ZHANG Y Y, et al. Efficient visible light photo-fenton-like degradation of organic pollutants using in Situ Surface-modified BiFeO3as a Catalyst [J]. J Environ Sci, 2013, 25(6): 1213-1225.
Visible photocatalytic degradation of rhodamine B by a photo fenton-like system consisting of PW11O39Fe(Ⅲ)(H2O)4-/H2O2
CHENYan,LIDulei,YANGJinman,GAOWenkai,HUAYingjie,WANGChongtai
(School of Chemistry and Chemical Engineering, Hainan Normal University, Haikou 571158, China )
A photo-Fenton-Like system (PW11Fe/H2O2) using Keggin-type Fe(Ⅲ)-substituted heteropolyanion PW11O39Fe(Ⅲ)(H2O)4-(PW11Fe) as the visible light activity component was studied, which was employed for the photocatalytic degradation of model pollutant rhodamine B (RhB) under an artificial VIS irradiation. Influences of the H2O2concentration, the PW11Fe concentration, the initial RhB concentration and the solution pH on the photocatalytic degradation rate of RhB was also examined, together with a discussion on the kinetics of RhB degradation. The results showed that the degradation ratio of 100% was obtained at 60 min for 0.01 mmol·L-1RhB with the optimum conditions of pH 4.5, 0.6 mmol·L-1PW11Fe and 4 mmol·L-1H2O2under the irradiation of 250 W metal halide lamp. The total organic carbon (TOC) removal was about 48% at 240 min. The hydroxyl radical quenching and electron paramagnetic resonance (EPR) experiments revealed that hydroxyl radicals generated by PW11Fe/H2O2system under visible light irradiation were the main reactive oxygen species, resulting in the rapid degradation of RhB. The apparent rate constant of RhB degradation was estimated to be (6.2±2) 10-2mmol·L-1· min-1.
iron-substituted heteropolyanion; hydrogen peroxide; rhodamine B; homogeneous photocatalysis; electron paramagnetic resonance
10.13471/j.cnki.acta.snus.2016.04.014
2016-02-25
国家自然科学基金资助项目(21161007);海南省国际科技合作重点资助项目(KJHZ 2014-08);海南省应用技术研究与开发专项资助项目(ZDXM20130088; ZDXM2014099);海南省大学生创新训练资助项目(201511658017);海南师范大学研究生校级创新科研资助项目(Hsyx2015-54)
陈艳(1990年生),女;研究方向:无机功能材料与光电催化性能;通讯作者:王崇太,华英杰;E-mail: wct581@sina.com,521000hua282@sina.com
O643.3
A
0529-6579(2016)04-0081-06

