金银花和山银花抗急性口腔炎症作用比较*
李泮霖,贺利利,李楚源,白 杨,王德勤,廖弈秋,李沛波,吴 忠,苏薇薇
(1. 中山大学生命科学学院,广东 广州510275;2. 广州白云山和记黄埔中药有限公司,广东 广州510515)
金银花和山银花抗急性口腔炎症作用比较*
李泮霖1,贺利利1,李楚源2,白 杨1,王德勤2,廖弈秋1,李沛波1,吴 忠1,苏薇薇1
(1. 中山大学生命科学学院,广东 广州510275;2. 广州白云山和记黄埔中药有限公司,广东 广州510515)
采用香烟烟雾提取物刺激KB细胞,构建急性口腔炎症模型;用Elisa法测定炎症因子TNF-α、IL-6、IL-8和IL-10的表达量;以考察金银花、山银花抗炎活性的差异。结果显示,与空白组相比,模型组促炎因子TNF-α、IL-6、IL-8水平显著升高,抗炎因子IL-10水平显著降低,属急性炎症表现,说明造模成功。金银花提取物或山银花提取物处理后,均可抑制TNF-α、IL-6、IL-8表达水平的升高,改善IL-10分泌减少,且呈剂量依赖关系,提示金银花和山银花对口腔炎症均具有一定的治疗作用。对二者的药效结果比较,山银花对各炎症因子的调控作用均强于金银花,尤其对TNF-α、IL-6和IL-10的调控作用具有显著差异。本研究从药效角度对金银花和山银花进行比较研究,为合理利用金银花和山银花药材提供了依据。
金银花;山银花;KB细胞;急性口腔炎症
从《中华人民共和国药典》2005版开始,金银花和山银花分列为两种药材[1]。二者原植物种属相近、药材外观形态相似,市场上金银花和山银花药材品种混乱、来源不清、质量良莠不齐的现象极为突出,直接影响到药材及其制剂的疗效。已有研究采用外观形态鉴别、化学成分分析、DNA分子鉴定等方法,对金银花和山银花的不同品种进行区分和鉴定[2-5],这些方法虽然可以明确药材的种属来源,但无法直接体现药效的优劣。
金银花和山银花属清热解毒类中药材,临床广泛应用于抗炎、抗病毒[6];金银花、山银花及其制剂应用于口腔疾病的预防和治疗,具有良好的疗效[7]。本研究选用急性口腔炎症模型,考察相关炎症因子的表达差异,从药效角度对金银花、山银花进行评价和区分,为临床合理使用金银花和山银花药材提供了依据。
1 实验材料
1.1 实验药品与试剂
金银花药材(产地:山东)、山银花药材(产地:湖南),由广州白云山和记黄埔中药有限公司提供,经廖文波教授鉴定,分别为忍冬科植物忍冬LonicerajaponicaThunb.和灰毡毛忍冬LoniceramacranthoidesHand.-Mazz.。
椰树牌香烟[广东中烟工业有限公司,含有w(一氧化碳) 13 mg,w(焦油) 11 g,w(烟碱) 1 mg];KB细胞(广州弗尔博生物科技有限公司);TNF-α、IL-8、IL-6、IL-10 Elisa试剂盒(武汉优尔生公司,货号:SEA133Hu,SEA080Hu,SEA079Hu,SEA056Hu);RPMI-1640培养基(美国 GIBCO,货号:C11875500BT);胎牛血清(美国 GIBCO,货号:1420768);MTT(美国Sigma Aldrich,货号:M2128);地塞米松(中国药品生物制品检定所,批号:100129-201105);二甲基亚砜(上海凌峰化学试剂有限公司,批号:20140909);磷酸盐缓冲溶液(美国Hyclone,货号:SH30256.01B)。
1.2 实验仪器
细胞培养瓶(德国Corning公司,货号:430639);6孔细胞培养板(广州JET BIOFIL,货号:TCP001006);96孔细胞培养板(广州JET BIOFIL,货号:TCP001096); 0.22 μm 无菌过滤器(美国密理博,货号:SLGP033RB)。
2 实验方法
2.1 金银花浸膏、山银花浸膏制备
分别取各药材1.5 kg,加水煎煮二次,第一次2 h,第二次1.5 h,合并煎液,滤过,滤液浓缩至相对密度为1.26~1.29(80 ℃),加入乙醇使含醇量达50%,充分搅拌,静置12 h以上,取上清液,滤过,滤液回收乙醇并浓缩成稠膏;制得金银花浸膏405 g、山银花浸膏435 g,得膏率分别为27%和29%。
2.2 细胞培养
将KB细胞培养于含φ=10%胎牛血清的RPMI-1640完全培养基(pH 7.2,青霉素100 U/mL,链霉素100 μg/mL)中,在37 ℃、φ=5% CO2培养箱中孵育。用吸管吸弃旧培养基,更换吸管,于非细胞培养面加入等量磷酸盐缓冲液(PBS),轻轻摇晃使其覆盖整个瓶底,吸弃PBS,更换吸管,重复洗涤一次;加入少量细胞消化液,37 ℃镜下观察消化;当细胞明显回缩后,加入少量新鲜细胞培养基终止消化,轻柔吹打底面2~3次后收集所有液体入新离心管中;1 200 r/min离心8 min,弃上清,细胞沉淀用适量新鲜培养基悬浮;加入到新培养瓶中,标记瓶号与细胞批次。MTT测定时用完全培养基调整细胞密度为1×104个/mL,并铺96孔板,每孔200 μL; Elisa测定时用完全培养基调整细胞密度为4×105个/mL,并铺24孔板,每孔0.5 mL。细胞培养24 h后,待密度至80%给药。
2.3 香烟烟雾提取物的制备及药物的配制
2.3.1 香烟烟雾提取物制备 制备香烟烟雾提取物装置时,将1.5 mL离心管接上香烟,将其底部剪开,然后套上橡胶软管,同时橡胶软管的另一端连接上50 mL注射器。将10 mL无血清RPMI-1640培养基转移至50 mL注射器中,并将注射器中剩余空气完全排出后待用。将香烟点燃,将装置连接设置好,并确保装置不漏气即可开始实验:先连接一只空的50 mL注射器,反复抽取3次,观察抽取的香烟烟雾,确保香烟已充分燃烧,然后连接装有10 mL无血清RPMI-1640的50 mL注射器,抽取50 mL充分燃烧的香烟烟雾到注射器中,充分震荡,确保烟雾与培养基充分混匀,反复抽取6次,共计300 mL香烟烟雾,待烟雾完全溶于培养基后用0.22 μm滤膜过滤后除菌即可得到100%香烟烟雾提取物母液(100% CSE)。为验证CSE母液的稳定性,设置6组平行重复,检测320 nm下的吸光度值A,得到RSD 值为1.68%,说明该方法所制备的CSE母液质量稳定可靠,可用于下一步实验。
将100%的CSE溶液用RPMI-1640培养基(无血清)稀释到需要的体积分数后加入细胞,使CSE终体积分数为1%、5%、10%、15%、20%、25%、50%、75%,30 min内用于实验。
2.3.2 药物的配制 药物用RPMI-1640培养基(无血清)配制,DEX配成终浓度1 μmol/L的溶液;金银花浸膏配成终质量浓度为0.153 2,1.532,15.32,153.19,306.38,612.77 μg/mL生药量的溶液;山银花浸膏配成终质量浓度为0.164 5,1.645,16.45,164.54,329.08,658.16 μg/mL生药量的溶液;经0.22 μm微孔膜过滤后使用。
2.4 考察不同含量的药物及CSE的细胞毒性
取生长状态良好的KB细胞,用含φ=10%胎牛血清的培养液配成单个细胞悬液,以每孔1 000~10 000个细胞接种到96孔板,每孔体积200 μL,在37 ℃、φ=5% CO2条件下培养1~2 d;实验前,将培养板中旧的培养基移除,换成新鲜的无血清RPMI-1640培养基处理过夜。将100%香烟烟雾提取物用无血清RPMI-1640培养基稀释成一系列梯度的CSE溶液(φ, 1%、5%、10%、15%、20%、25%、50%、75%);金银花浸膏及山银花浸膏配制成一系列梯度溶液(1、10、100、1 000 μg/mL)后加入96孔板的细胞中,37 ℃、φ=5% CO2条件下孵育24 h;每孔加入MTT溶液(5 mg/mL,用pH=7.4的PBS配制)20 μL,37 ℃培养箱中继续孵育4 h,弃去上清后每孔加入200 μL DMSO,然后将96孔板置于摇床上轻微摇动5 min使紫色结晶充分溶解,用超微量紫外/可见光分光光度计于490 nm波长下检测96孔板的A值。考察浓度梯度的CSE对KB细胞的毒性,根据公式:存活率=(给药组A值/空白组A值)×100%,可计算出相应的存活率。
2.5 细胞急性炎症实验
2.5.1 细胞培养及药物处理 根据细胞毒性检测结果,在对细胞无毒性作用的安全浓度范围内设置CSE和药物的浓度。实验共设置空白对照组、模型组(5%CSE)、阳性对照组(1 μmol/L地塞米松)、金银花浸膏不同剂量组(0.153 2,1.532,15.32,153.19,306.38,612.77 μg/mL)、山银花浸膏不同剂量组(0.164 5,1.645,16.45,164.54,329.08,658.16 μg/mL)。
将KB细胞培养于含φ=10%胎牛血清的RPMI-1640完全培养基(pH 7.2,青霉素100 U/mL,链霉素100 μg/mL)中,在37℃、φ=5% CO2培养箱中孵育;用含φ=10%胎牛血清(FBS)的培养液配成单个细胞悬液,以每孔5 000个细胞接种到24孔板;培养24 h,待细胞长至80%密度时,以含各药物的无FBS培养基替换原培养基,空白对照组和模型组给予等量的无血清培养基,预处理30 min后用φ=5%CSE刺激KB细胞造模,空白对照组给予等量的无血清培养基。
2.5.2 样品中IL-6、IL-8、TNF-α和IL-10含量检测 细胞给药24 h后收集细胞上清,4 ℃下1 500 r/min离心5 min后,弃去底部沉淀留上清,按试剂盒说明采用Elisa法测定IL-6、IL-8、TNF-α和IL-10含量,实验具体方法为:首先,设标准曲线蛋白孔,每孔依次加入不同质量浓度的标准蛋白溶液(1 000、500、250、125、62.5、31.2、15.6 pg/mL,以及标准蛋白稀释液)100 μL;其次,加样孔中每孔加入100 μL样品蛋白,每个样品设置6个重复孔,加样后标记,酶标板覆膜,37 ℃下孵育2 h;弃去孔内液体,甩干,不用洗涤;每孔加100 μL提前配好的检测工作液A,孵育1 h;弃去孔内液体,用自动洗板机重复洗板3次,洗完后把孔内的洗涤液尽量甩干;每孔加100 μL提前配好的检测工作液B,温育30 min;弃去孔内液体,甩干,洗板5次;酶标板内每孔加入底物反应溶液90 μL,37 ℃避光待其标准蛋白溶液显色(反应时间在15~25 min之间),当标准蛋白孔的前4个孔颜色出现明显梯度,后4个孔也出现明显蓝色时,即可终止;每孔小心加入反应终止液50 μL,避免产生气泡影响光密度测量,此时蓝色的溶液转变为黄色;立即用多孔酶标仪测量450 nm下的的光密度(A值)。
2.6 数据分析方法
使用SPSS 19.0统计软件分析实验结果,采用方差分析法对不同给药组间差异进行统计分析,各组实验结果均以平均数±标准差(mean±S.D.)表示,P<0.05说明两者间有显著性差异,P<0.01 说明两者间有极显著性差异。
3 实验结果
3.1 CSE及各样品对KB细胞存活率的影响
研究结果显示,φ=1% CSE刺激KB细胞24 h后与空白组没有显著区别,存活率为0.98;φ=10% CSE条件下,KB细胞的存活率下降至0.79,与空白组有极显著差异;更高φ(CSE)刺激下细胞存活率持续降低(图1),因此选择φ(CSE)为5%。各样品的系列梯度溶液对KB细胞的存活率并无明显影响(图2、3)。说明金银花、山银花样品对KB细胞均无毒性。
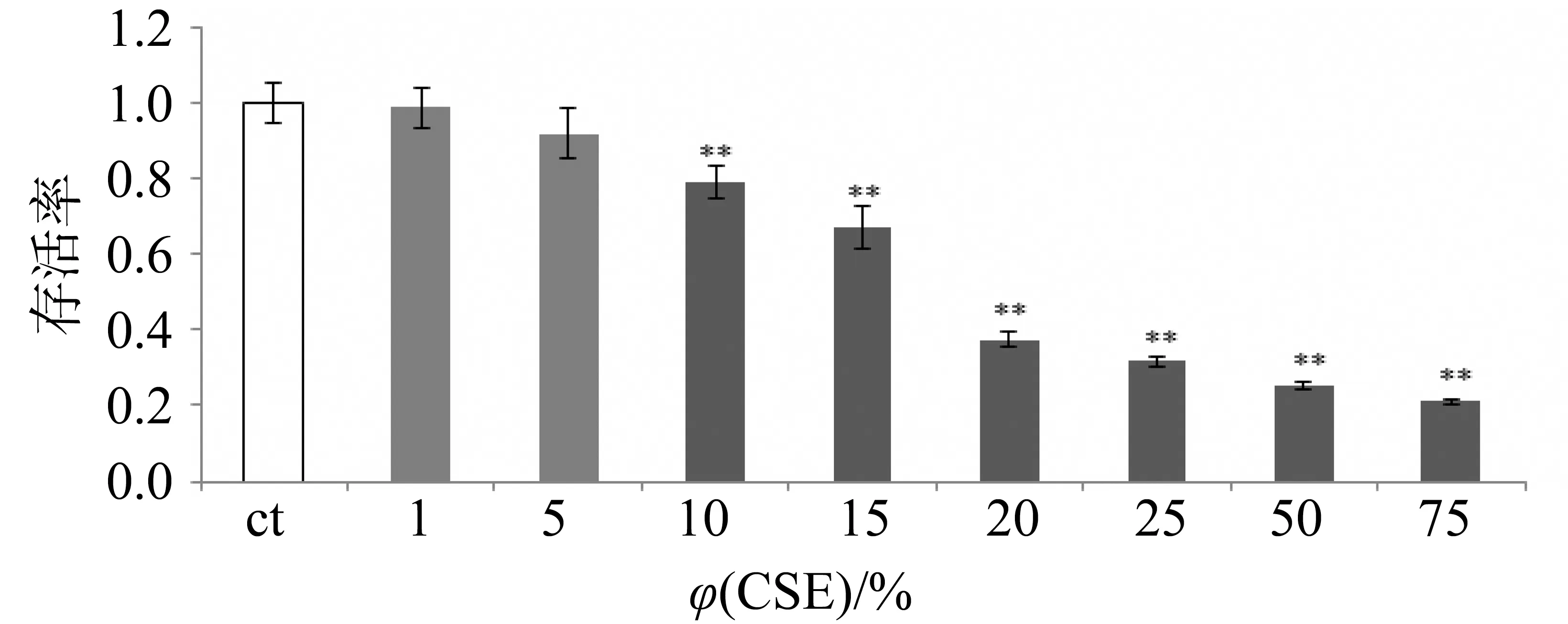
图1 CSE对KB细胞存活率的影响(n=6,mean±S.D.)Fig.1 KB cell viability in different concentrations of CSE(n=6, mean±S.D.) 与空白对照组比较,**P<0.01
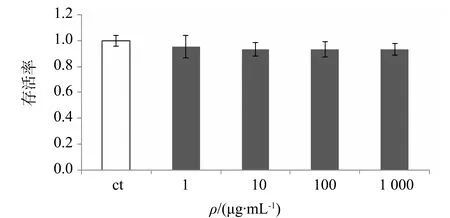
图2 金银花对KB细胞存活率的影响(n=6,mean±S.D.)Fig.2 KB cell viability in different concentrations of LJF与空白对照组比较,P>0.05

图3 山银花对KB细胞存活率的影响(n=6,mean±S.D.)Fig.3 KB cell viability in different concentrations of LF与空白对照组比较,P>0.05
3.2 金银花、山银花对CSE诱导急性口腔炎症的作用
TNF-α、IL-8、IL-6和IL-10是参与炎症反应的重要介质,可促进炎性反应进程,在许多炎性反应性疾病、免疫性疾病的发生和发展中起着重要作用。许多资料表明,口腔炎症疾病,包括复发性口腔溃疡(ROU)、口腔黏膜炎(OM)、口腔扁平苔癣(OLP)等的发病过程中涉及多种细胞因子分泌紊乱,如促炎因子TNF-α、IL-8、IL-6的增加及抗炎因子IL-10的减少[8-9]。
3.2.1 促炎因子TNF-α水平 结果显示,在φ=5% CSE刺激24 h后,KB细胞促炎因子TNF-α蛋白表达量显著增加(图4),模型组蛋白表达量是空白组的5倍,说明造模成功。金银花、山银花对TNF-α的分泌都具有抑制作用,且呈剂量依赖关系。整体看来,山银花对TNF-α升高的抑制作用强于金银花,在浓度3、4、5、6组中二者的抑制作用具有显著性差异(P<0.01,P<0.05)。
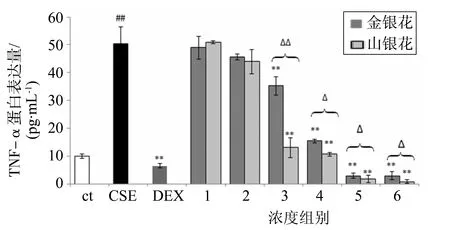
图4 KB细胞炎性因子TNF-α蛋白表达量(n=6,mean±S.D.)**P<0.01;两组之间比较,ΔP<0.05,ΔΔP<0.01Fig.4 Protein expression level of TNF-α in KB cells (n=6, mean±S.D.)
3.2.2 抗炎因子IL-10水平φ=5% CSE刺激24 h后,KB细胞抗炎因子IL-10分泌量显著降低。而金银花、山银花对CSE刺激引起的IL-10分泌减少都具有改善作用,且呈剂量依赖关系(图5)。山银花对IL-10分泌的促进作用均强于金银花,在浓度6组中二者的作用具有显著性差异(P<0.05)。

图5 KB细胞炎性因子IL-10蛋白表达量(n=6,mean±S.D.)Fig.5 Protein expression level of IL-10 in KB cells (n=6, mean±S.D.)
3.2.3 促炎因子IL-6水平φ=5% CSE刺激24 h后,KB细胞促炎因子IL-6分泌量显著升高。而金银花、山银花对CSE诱导的IL-6分泌都具有抑制作用,且呈剂量依赖关系(图6)。并且山银花的抑制作用均强于金银花,在浓度6组中二者的作用具有极显著差异(P<0.01)。
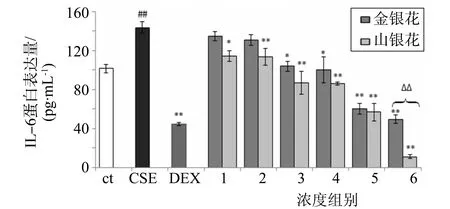
图6 KB细胞炎性因子IL-6蛋白表达量(n=6,mean±S.D.)Fig.6 Protein expression level of IL-6 in KB cells (n=6, mean±S.D.)
3.2.4 促炎因子IL-8水平φ=5% CSE刺激24 h后,KB细胞促炎因子IL-8蛋白水平显著升高。而金银花、山银花都能抑制CSE诱导的IL-8表达水平上升(图7)。浓度5、浓度6组对IL-8升高有显著抑制作用(P<0.05)。
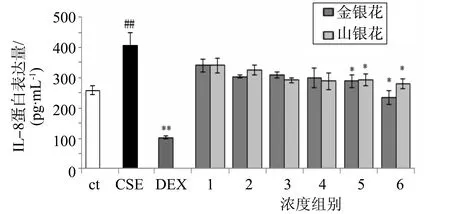
图7 KB细胞炎性因子IL-8蛋白表达量(n=6,mean±S.D.)Fig.7 Protein expression level of IL-8 in KB cells (n=6,mean±S.D)
4 讨 论
本实验用φ=5% CSE刺激KB细胞24 h后,可观察到细胞内促炎因子TNF-α、IL-6、IL-8分泌显著上升,抗炎因子IL-10分泌下降;这些指标均为炎症反应免疫应答过程中的重要细胞因子,表明KB细胞急性口腔炎症模型具有一定的临床代表性。
本研究利用此模型对金银花、山银花的抗炎作用进行了考察和比较,结果表明两种样品对TNF-α、IL-8、IL-6的升高和IL-10的降低均可起到明显改善作用,且呈剂量依赖关系。提示金银花、山银花对口腔炎症疾病具有一定疗效。同时品种间的比较结果显示,金银花和山银花对TNF-α、IL-6和IL-10的调控作用均具有显著差异,但山银花的作用强于金银花。
金银花作为抗菌、抗病毒的常用药材,市场需求紧张。据2011年统计全国金银花需求在2 万t左右,而金银花的实际产量仅7 000 t,缺口巨大[10]。山银花产量大、价格低,但其资源尚未得到充分利用。本研究从抗炎药效方面对金银花、山银花进行考察,为合理利用金银花和山银花药材提供了科学依据。
[1] 王芳, 高松. 金银花、山银花药理学研究现状[J]. 辽宁中医药大学学报,2013,15(4): 237-239.
[2] 苟占平, 万德光. 金银花品种及其鉴定研究概述[J]. 中药材, 2004, 27(3): 229-232.
[3] GAO W, YANG H, QI L W, et al. Unbiased metabolite profiling by liquid chromatography-quadrupole time-of-flight mass spectrometry and multivariate data analysis for herbal authentication: Classification of sevenLoniceraspecies flower buds[J]. Journal of Chromatography A, 2012, 1245: 109-116.
[4] 李萍, 蔡朝晖. 5S-rRNA 基因间区序列变异用于金银花药材道地性研究初探[J]. 中草药, 2001, 32(9): 834-837.
[5] 彭维, 黄琳, 关倩怡, 等. 红腺忍冬的质量研究[J]. 中山大学学报(自然科学版), 2010, 49 (6): 142-144.
[6] 何显忠, 兰荣德. 金银花的药理作用与临床应用[J]. 时珍国医国药, 2004, 15(12): 865-867.
[7] 王迎菊, 王凯, 梁文红. 金银花在口腔医学中的应用[J]. 中国医药指南, 2013, 11(14): 68-71.
[8] GUPTA P, ASHOK L, NAIK S R. Assessment of serum interleukin-8 as a sensitive serological marker in monitoring the therapeutic effect of levamisole in recurrent aphthous ulcers: A randomized control study[J]. Indian Journal of Dental Research, 2014, 25(3): 284-289.
[9] TOBITA T, IZUMI K, FEINBERG S E. Development of an in vitro model for radiation-induced effects on oral keratinocytes[J]. International Journal of Oral and Maxillofacial Surgery, 2010, 39(4): 364-370.
[10] 薛红卫, 周超凡. 金银花和山银花的合理使用[J]. 中国新药杂志,2011,20(22):2211-2220.
Comparison of anti-inflammatory effects between Lonicerae Japonicae Flos and Lonicerae Flos using an acute stomatitis model
LIPanlin1,HELili1,LIChuyuan2,BAIYang1,WANGDeqin2,LIAOYiqiu1,LIPeibo1,WUZhong1,SUWeiwei1
(1. School of Life Sciences, Sun Yat-sen University, Guangzhou 510275, China;2. Hutchison Whampoa Guangzhou Baiyunshan Chinese Medicine Limited Company,Guangzhou 510515, China)
The acute stomatitis model in KB cells induced by cigarette smoke extract (CSE) has been established to study the anti-inflammatory effects between Lonicerae Japonicae Flos (LJF) and Lonicerae Flos (LF),and the protein expression levels of TNF-α, IL-6, IL-8 and IL-10 were detected by Elisa method after treatments of LJF or LF extracts. The results showed that the extracts of LJF or LF could both reduce the protein expression levels of TNF-α, IL-6, IL-8, improve the low expression of IL-10 in a dose dependent manner, suggesting their certain anti-inflammatory effects.LF presented significant better anti-inflammatory effects than LJF in the regulation of TNF-α, IL-6 and IL-10. These results provided a basis for the rational utilization of LJF and LF herbs.
Lonicerae Japonicae Flos; Lonicerae Flos; KB cells; acute stomatitis model
10.13471/j.cnki.acta.snus.2016.04.019
2015-10-30
国家科技支撑计划资助项目(2012BAI29B00);广州开发区科技领军人才资助项目(2015P-158)
李泮霖(1989年生),女;研究方向:中药学;通讯作者:苏薇薇;E-mail:lsssww@126.com
R969
A
0529-6579(2016)04-0118-05

