松果体区神经节细胞胶质瘤伴有神经母细胞瘤成分1例并文献复习
宋贵东 高之宪
(首都医科大学附属北京天坛医院神经外科,北京 100050)
松果体区神经节细胞胶质瘤伴有神经母细胞瘤成分1例并文献复习
宋贵东高之宪*
(首都医科大学附属北京天坛医院神经外科,北京 100050)
神经节细胞胶质瘤是一种少见的中枢神经系统肿瘤,国外文献[1]报道其发病率约占脑肿瘤的0.4%~0.9%,原发于松果体区的神经节细胞胶质瘤极其罕见。迄今报道了两例松果体区神经节细胞瘤复发后伴有神经母细胞瘤成分的病例[2],未有原发性病例报道。现报道1例松果体区神经节细胞胶质瘤伴有神经母细胞成分的病例,并结合文献回顾分析,探讨其临床表现、影像学特征、病理改变,希望对临床医师加深该病的理解与认识有所帮助。
1临床资料
患者女性,41岁,既往体健,因头晕伴恶心呕吐2月余就诊于首都医科大学附属北京天坛医院,术前查体无明显阳性体征。磁共振扫描(magnetic resonance imaging,MRI)示:松果体区占位。可见松果体区一类圆形混杂信号团块状影,边界较清晰,体积约14 mm×12 mm×11 mm,病灶内可见斑点状短T1长T2信号影,局部边缘见线状短T2信号环绕,中脑顶盖受压向前移位。注射对比剂后,病灶明显不均匀强化(图1)。入院行右额经胼胝体-透明隔-穹窿入路肿瘤切除术,术中可见肿瘤位于中间块后方、三脑室内及其后部,阻塞中脑导水管上口,肿瘤实型,质地软脆,灰黄色,血供中等,边界欠清,内含暗红色陈旧性出血,体积14 mm×12 mm×11 mm,切除后,中脑导水管上口恢复通畅。术后两周,患者出现持续嗜睡,轻度头晕。经计算机断层扫描(computed tomography, CT)证实,患者为幕上梗阻性脑积水。考虑为术后瘢痕粘连,中脑导水管上口堵塞所致,急诊行右侧脑室腹腔分流术,术后脑室恢复正常大小,嗜睡头晕症状消失,患者病情平稳,恢复佳。术后病理回示:神经节细胞胶质瘤,黏液样变性,局灶性神经母细胞瘤样形态(图2)。
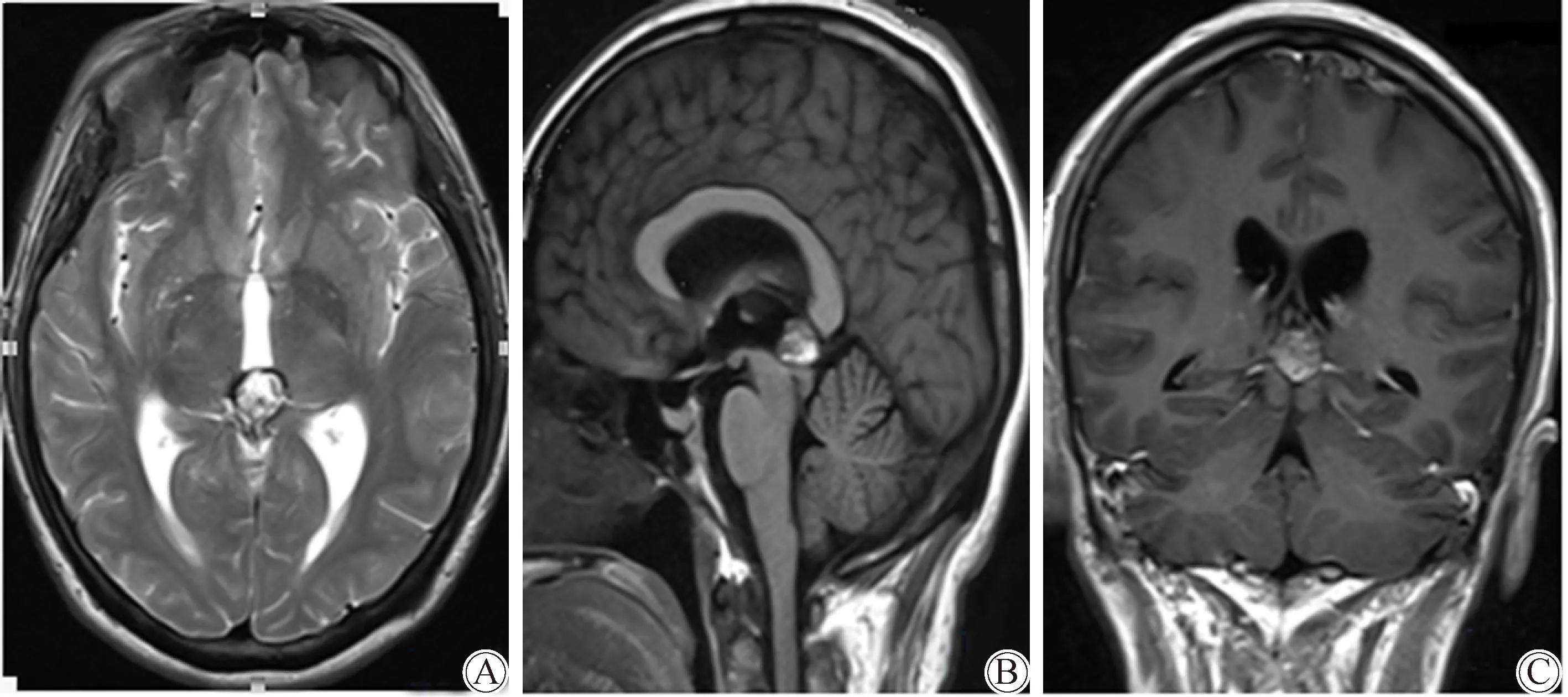
图1 患者术前MRI

图2 患者术后病理
2讨论
2.1神经节细胞胶质瘤的组织学特性以及世界卫生组织(world health organization,WHO) 分级
神经节细胞胶质瘤属于混合性神经-胶质肿瘤的一种,大多数属于WHO Ⅰ级。有一小部分肿瘤中胶质成分发生恶变,为间变性神经节细胞胶质瘤,属于WHO Ⅲ级。神经节细胞胶质瘤包含不同分化程度的神经元及胶质细胞成分,神经细胞成分呈多形性,形态、大小、分布不均,胶质细胞成分以星型成分为主,少枝星型成分少见。免疫组织化学检查:胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)、神经微丝蛋白(neurofilament protein,NF)、突触素等可以用于区别神经元细胞以及胶质细胞[3]。
2.2神经节细胞胶质瘤的发病特点及临床表现
神经节细胞胶质瘤可发生于各个年龄段,但大多数发生于30岁以下的青年人及儿童[4]。发病率无性别、种族差异。其好发部位为大脑半球,以颞叶常见,其余散发于视神经、视交叉、视束、下丘脑、脑干、小脑、丘脑、脊髓等,松果体区罕见[5]。神经节细胞胶质瘤最常见的临床表现是进行性的癫痫发作,其病史可为几月到几年。其他症状和体征主要与患者的年龄、肿瘤的部位、侵袭性等因素相关。其他临床症状主要与占位效应引起的临床症状有关[6]。原发于松果体区的神经节细胞胶质瘤,与其他松果体区占位性病变一样,常引起患者视力、眼球运动障碍,后期会造成脑积水症状。因神经节细胞胶质瘤一般为非侵袭特性肿瘤,患者的病史一般较长。
2.3神经节细胞胶质瘤的影像学特点
神经节细胞胶质瘤影像学表现多样,并无特征性的CT、MRI征象。肿瘤边界一般比较清楚,大多无瘤周水肿,肿瘤可为囊性、囊实性、实型。囊性神经节细胞胶质瘤呈长T1 长T2 信号,液体衰减反转恢复序列(fluid attenuated inversion recovery, FLAIR)低信号,增强MRI囊壁可强化[7-8]。实性神经节细胞胶质瘤呈稍长T1、T2信号,FLAIR高信号,增强MRI示肿瘤均匀或不均匀增强。神经节细胞胶质瘤常发生钙化,在CT上可表现为结节状、斑点状高密度影[9]。神经母细胞瘤在影像学表现为境界清楚的长T1、长T2占位性病变,可为点片状、斑片状、结节样,瘤周水肿少见。
2.4鉴别诊断
1)生殖细胞瘤:生殖细胞瘤在CT上表现为等密度或稍高密度,注射造影剂后中度至明显增强。MRI T1加权像上与周围白质等信号,T2加权像为高信号,增强像可见肿瘤均匀一致的明显增强[10]。
2) 畸胎瘤:CT上表现为境界清楚的低密度或者混杂密度,MRI 上含有多种混杂信号,CT或MRI增强可见不均一环形强化[7]。
3)松果体细胞瘤:MRI T1加权像表现为低信号或等信号,T2加权像为高信号,增强可见均一强化[7]。
2.5病理及免疫组织化学特点
大体上看,神经节细胞胶质瘤为灰色囊性或实性肿瘤。光镜下可见肿瘤含有胶质以及神经元性成分,细胞大小中等,少量多形性,细胞分裂像少,细胞可见微小钙化点。瘤性节细胞免疫组织化学呈神经元特异性烯醇化酶、神经微丝蛋白、髓鞘蛋白、嗜铬蛋白A、突触素阳性,胶质细胞以及胶质瘤成分GFAP呈阳性[11]。神经母细胞瘤为多囊性或实性,与周围组织分界清楚。光镜下可见细胞核为圆形或椭圆形,细胞核染色质浓染,胞质丰富,可见核分裂像,胞内可见特征性的Homer Wright 菊型团。免疫组织化学:神经微丝蛋白、突触素、β-微管蛋白阳性,GFAP阴性[3]。本例患者病理切片可见大量神经元性及胶质细胞成分,局灶可见神经母细胞瘤样成分,细胞形态与免疫组织化学指标与神经母细胞瘤相同,但无核分裂像。
2.6神经节细胞胶质瘤治疗
神经节细胞胶质瘤首选手术切除,应尽量全切肿瘤。对于位于脑干、视神经的肿瘤可以做次全或部分切除[12]。术后对于肿瘤是否进行放射治疗(以下简称放疗)仍存有争议,放疗可以降低患者的复发率,不过放射也可能造成肿瘤进一步恶变。对于肿瘤复发以及肿瘤次全切除的患者,可以考虑放射治疗。一项由梅奥诊所开展的单中心研究[13]显示,肿瘤次全切除的患者的无进展生存期要显著低于行完全切除的患者。且对于肿瘤次全切除的患者行术后辅助放疗可以减少患者的复发率。两个独立的研究[14-15]表明,对肿瘤全切后低级别与高级别节细胞瘤患者的复发率差异无统计学意义,提示对高级别节细胞瘤行放射治疗可能无效。一项应用立体定向置入碘125治疗神经节胶质瘤的研究[16]表明,使用此种方法放疗可以达到控制肿瘤生长的目的。而由于该研究仅有8例患者,其有效性有待大规模临床实验证实。该例患者术中全切肿瘤,考虑不予以放射治疗,患者术后3个月后复查头部增强MRI,密切监测肿瘤变化。关于化学药物治疗治疗神经节细胞胶质瘤的文献报道少见,有研究[17]使用顺式维甲酸治疗恶性神经节细胞胶质瘤,治疗后肿瘤消退,而化学药物治疗的有效性有待进一步临床研究证实。关于神经节细胞瘤伴有神经母细胞瘤成分的病例少见,治疗方案仍未明确。
2.7预后
神经节细胞胶质瘤的预后一般良好,全切肿瘤后患者可以长期存活,术后患者癫痫症状大多可以得到很好的控制。 有文献[2]报道节细胞胶质瘤术后,患者进行放疗后复发时,肿瘤发生了神经母细胞瘤变,然而对于此类病例的治疗仍不明确,需要更多的临床病例数据以及随机对照试验进行研究。
3参考文献
[1]Zhang D, Henning T D, Zou L G, et al. Intracranial ganglioglioma: clinicopathological and MRI findings in 16 patients[J]. Clin Radiol,2008,63(1):80-91.
[2]Tarnaris A, O’Brien C, Redfern R M. Ganglioglioma with anaplastic recurrence of the neuronal element following radiotherapy[J]. Clin Neurol Neurosurg,2006,108(8):761-767.
[3]Brat D J, Parisi J E, Kleinschmidt-Demasters B K, et al. Surgical neuropathology update: a review of changes introduced by the WHO classification of tumours of the central nervous system, 4th edition[J]. Arch Pathol Lab Med,2008,132(6):993-1007.
[4]Safavi-Abbasi S, Di Rocco F, Chantra K, et al. Posterior cranial fossa gangliogliomas[J]. Skull Base,2007,17(4):253-264.
[5]Kim S D, Kim J H, Lee C Y, et al. Ganglioglioma in brainstem : case report and a review of literatures[J]. J Korean Neurosurg Soc,2014,55(3):164-166.
[6]Im S H, Chung C K, Cho B K, et al. Intracranial ganglioglioma: preoperative characteristics and oncologic outcome after surgery[J]. J Neurooncol,2002,59(2):173-183.
[7]孙晓东,丁怀银,白卓杰,等. 颅内节细胞胶质瘤的影像学表现及鉴别诊断[J]. 临床放射学杂志,2011,30(7):1065-1067.
[8]李晓菲,凌雪英,王颖,等. 27例神经节细胞胶质瘤的MRI表现[J]. 暨南大学学报,2012,33(2):194-197.
[9]Kumabe T, Shimizu H, Sonoda Y, et al. Thallium-201 single-photon emission computed tomographic and proton magnetic resonance spectroscopic characteristics of intracranial ganglioglioma: three technical case reports[J]. Neurosurgery,1999,45(1):183-187.
[10]Tender G C, Smith R D. Pineal ganglioglioma in a young girl: a case report and review of the literature[J]. J La State Med Soc,2004,156(6):316-318.
[11]雷冬梅,尹先印,刘爱军,等. 中枢神经系统节细胞胶质瘤28例病理分析[J]. 中国实用神经疾病杂志,2013,16(19):9-11.
[12]王湘连,王国民,付美娜,等. 颅内神经节细胞胶质瘤诊治分析[J]. 肿瘤学杂志,2012,18(7):553-554.
[13]Compton J J, Laack N N, Eckel L J, et al. Long-term outcomes for low-grade intracranial ganglioglioma: 30-year experience from the Mayo Clinic[J]. J Neurosurg,2012,117(5):825-830.
[14]Liauw S L, Byer J E, Yachnis A T, et al. Radiotherapy after subtotally resected or recurrent ganglioglioma[J]. Int J Radiat Oncol Biol Phys,2007,67(1):244-247.
[15]Zorlu F, Selek U, Onal C, et al. Postoperative radiotherapy in cranial ganglioglioma[J]. J Neurooncol,2006,77(3):321-324.
[16]El Maidoub F, Rezk E, Hunsche S, et al. Intracranial ganglioglioma WHO I: results in a series of eight patients treated with stereotactic interstitial brachytherapy[J]. J Neurooncol,2014,118(2):345-350.
[17]Karremann M, Pietsch T, Janssen G, et al. Anaplastic ganglioglioma in children[J]. J Neurooncol,2009,92(2):157-163.
编辑孙超渊
(收稿日期:2015-01-23)
[doi:10.3969/j.issn.1006-7795.2016.01.020]
* Corresponding author, E-mail:zhixian-g@hotmail.com
网络出版时间:2016-01-2718∶00网络出版地址:http://www.cnki.net/kcms/detail/11.3662.R.20160127.1800.014.html
· 病例报告 ·

