幽门螺杆菌临床菌株的分离培养和鉴定*
刘正美, 周建奖, 赵 艳, 熊 林, 龙妮娅, 谢 渊*
(贵州医科大学 分子生物学重点实验室, 贵州 贵阳 550004)
幽门螺杆菌临床菌株的分离培养和鉴定*
刘正美**, 周建奖, 赵艳, 熊林, 龙妮娅, 谢渊***
(贵州医科大学 分子生物学重点实验室, 贵州 贵阳550004)
[摘要]目的: 建立一种幽门螺杆菌(H.pylori)临床菌株的分离培养的方法。方法: 取临床胃黏膜组织标本88株,接种于10%绵羊全血的哥伦比亚选择性培养基上,37 ℃、 5% O2 、10% CO2 、85% N2培养3~5 d后,挑取血平板上透明细小可疑菌落进行革兰氏染色和尿素酶试验,对阳性菌落进行扩大纯培养,提取细菌DNA,PCR扩增H.pylori 16sRNA、CagA基因,电泳并进行测序鉴定。结果: 成功从临床胃黏膜组织中分离培养出H.pylori,88例胃黏膜组织标本中分离培养并鉴定出H. pylori 19株,阳性率为22%;对16sRNA及CagA基因进行扩增,电泳可见目的条带,并对16sRNA扩增产物测序,与H.pylori国际标准菌株26695比对,同源性为95%~99%。结论: 37 ℃、 5% O2 、10% CO2 、85% N2条件下10%绵羊全血的哥伦比亚选择性培养基上能成功分离培养出H.pylori临床株。
[关键词]幽门螺杆菌; 分离培养; 临床菌株; 革兰染色; CagA基因
幽门螺杆菌(Helicobacterpylori,H.pylori)是一种呈螺旋状或S形、微需氧的革兰氏阴性杆菌,由澳大利亚科学家Mashall和Warren于1983年从慢性胃炎病人的胃黏膜中首次分离并成功培养[1-2]。H.pylori是全球最常见的感染性病原菌之一,是慢性胃炎、胃溃疡的主要致病因素[3-4],与胃癌的发生发展密切相关[5]。近年来的许多研究发现,H.pylori感染与心血管疾病、血液系统疾病、皮肤疾病以及口腔疾病等的发生密切相关[6-8]。目前流行病学研究显示,发达国家H.pylori的感染率为30%~50%,中国作为人口众多的发展中国家,是H.pylori的高感染区,H.pylori感染率高达40%~90%,平均为59%[9]。H.pylori临床菌株的分离培养是诊断H.pylori感染的“金标准”[10-11],亦是H.pylori基础及临床研究的一项基本技术。成功分离培养的临床菌株可用于细菌分型、致病机制研究、构建动物模型及确定致病因子等基础研究[12]。随着H.pylori耐药菌株的日益增加,培养H.pylori还能提供细菌耐药性的资料,这对指导临床用药极为重要。本文旨建立一种从临床胃黏膜组织中分离培养出H.pylori培养和鉴定方法。
1材料与方法
1.1材料
在病人知情同意的原则下,从胃镜中心收取2014-2015年就诊患者88例的胃黏膜组织标本,其中男42例,女46例,年龄为26~71岁。微需氧培养罐及微需氧产气袋(850 mL/L N2, 100 mL/L CO2,50 mL/L O2)购自Mitsubishi, Japan。恒温培养箱,一次性接种环,哥伦比亚琼脂(OXOID,英国),幽门螺杆菌选择剂(OXOID,英国),布氏肉汤,革兰氏染液(安徽巢湖弘慈医疗公司),尿素酶试纸(广东珠海克迪科技公司),超净工作台;脱纤维绵羊全血(友康生物科技有限公司, 北京)。
1.2方法
1.2.1H.pylori运送液、冻存液以及哥伦比亚血琼脂平板的配制H.pylori运送液:称取改良布氏肉汤粉末2.81 g,加热搅拌溶解于100 mL蒸馏水中,分装三角瓶,121 ℃高压灭菌,冷却后无菌分装200 μL/管,再于每管内加入2.5 μLH.pylori选择剂,置于4 ℃冰箱。H.pylori冻存液的配制:配制10%蔗糖溶液,高压灭菌后,与胎牛血清按1∶1比例进行配制。哥伦比亚血琼脂平板:称取哥伦比亚琼脂3.9 g,加入双蒸水90 mL,121 ℃高压灭菌,冷却至50 ℃左右时,于超净工作台加入10 mL脱纤维绵羊全血,0.4 mLH.pylori选择剂,混匀后倒入平板。
1.2.2标本采集和转运胃镜下于胃窦部用无菌活检钳(用750 mL/L 乙醇火烧灭菌, 冷却处理)取黏膜组织, 将组织取下置于装有0.3 mLH.pylori运送液的EPP管中, 4 ℃ 2 h内送于分子生物重点实验室进行分离。
1.2.3标本接种与培养在超净工作台内,将组织用高压灭菌的组织剪剪碎,机械研磨60 s,将其全部倒入已铺制好的哥伦比亚血琼脂平板上,用L型玻璃棒涂抹开,将接种好的血平板置于放有产气袋的厌氧罐内或三气培养箱(5% O2、10% CO2、85% N2)37 ℃培养3~5 d。
1.2.4H.pylori鉴定(1)革兰氏染色,取一环生理盐水置于洁净的载玻片上,挑取血平板上透明细小可疑菌落于生理盐水上涂开,待干后,于酒精灯上固定,结晶紫初染1 min,碘液媒染1 min,酒精脱色30 s,复红复染30 s,显微镜下观察,见革兰氏染色阴性的细小、弯曲状杆菌为H.pylori阳性。(2)尿素酶试验,挑取血平板上透明细小可疑菌落致尿素酶试纸上,1 min后试纸由黄色变为红色则为H.pylori阳性。(3)H.pylori阳性菌落16sRNA鉴定,对H.pylori阳性菌落进行传代扩大培养,提取细菌DNA,设计H.pylori16sRNA引物(上游引物5′-CTT GCT AGA GTG CTG ATTA-3′ ,下游引物5′-TCC CAC ACT CTA GAA TAGT -3′)进行PCR扩增,扩增条件为95 ℃ 5 min, 94 ℃ 30 s、55 ℃ 30 s、72 ℃ 1 min,25个循环,72 ℃ 7 min,4 ℃保温,目的条带为550 bp。 PCR产物以1.5%琼脂糖凝胶电泳,若有目的条带,则将扩增产物纯化后测序,将测序结果与H.pylori国际标准株26695进行序列比对。(4)H.pylori阳性菌落CagA鉴定,对H.pylori阳性菌落进行传代扩大培养,提取细菌DNA,设计CagA引物(上游引物5′-ACA ATGA CTA ACG AAA CCA-3′,下游引物5′-TTT TGG TAT TCC TTA TCC T-3′)进行PCR扩增,扩增条件为95 ℃ 5 min, 98 ℃ 60 s、55 ℃ 15 s、72 ℃ 4 min 25个循环,72 ℃ 10 min,4 ℃保温,目的条带为3 500 bp。 PCR产物以1.0%琼脂糖凝胶电泳,若有目的条带,则将扩增产物纯化后测序。(5)H.pylori菌株的冻存,扩大培养经鉴定的H.pylori菌株,将细菌用接种环刮取放置在2 mL冻存管(500 uL冻存液)中,每管置入2~3环细菌。迅速放置于-80 ℃冰箱中,过夜后转入液氮罐长期保存。
2结果
2.1H.pylori阳性率
本研究从临床所取88例组织标本中分离培养并鉴定出H.pylori阳性菌19株,阳性率为22%。H.pylori在哥伦比亚血琼脂培养基上微需氧培养3 d后呈灰白色针尖样菌落(图1A),尿素酶试验为阳性(图1B);经革兰氏染色后在显微镜下观察可见革兰阴性(紫红色)的细小、弯曲状、螺旋状杆菌(图1C);
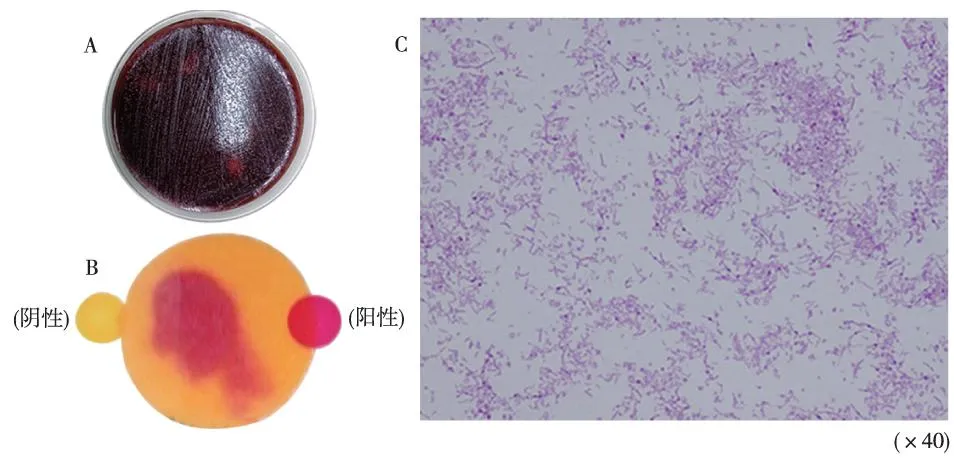
注:A为H. pylori在哥伦比亚血琼脂培养基上微需氧培养3 d后呈灰白色针尖样菌落,B为尿素酶试验阳性,C为H. pylori经革兰染色后在显微镜下表现图1 H.pylori菌落、尿素酶试验及革兰氏染色Fig.1 H.pylori colony, urease test and the microscopic morphology of gram staining
2.2H.pylori阳性菌落16sRNA鉴定
对H.pylori的16sRNA基因进行扩增,约在550 bp处可见目的条带(图2),并对扩增产物测序,与H.pylori国际标准菌株26695比对,同源性为95%~99%(图3)。
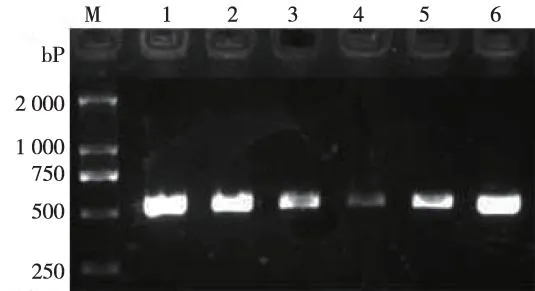
注:M为 DNA Marker(DL2000),1为标准菌株26695,2~6为分离培养的H.pylori菌株图2 H.pylori16sRNA基因PCR扩增产物Fig.2 Electrophoresis map of PCR products of 16sRNA of H.pylori
2.3H.pylori阳性菌落CagA鉴定
对H.pylori的cagA基因进行扩增,约在3 500 bp处可见目的条带(图4),并对扩增产物测序(图5)。
3讨论
H.pylori对营养条件要求较高,一般培养条件很难生长,要求与体内胃黏膜下层条件相似,即微需氧(5% O2)环境,37 ℃,湿度达 98%以上。目前,H.pylori培养多采用固体培养基,常用的有脑心浸液琼脂、布氏琼脂、哥伦比亚琼脂等。本次H.pylori临床菌株的分离培养采用的培养基为哥伦比亚琼脂培养基,于病人胃窦部取材后,将组织剪碎涂抹于已配置好的哥伦比亚血琼脂平板上,前期有36株于厌氧罐内,放入产气袋进行培养,后52株培养于三气培养箱内,结果发现于三气培养箱内的H.pylori生长较好。众多研究培养H.pylori采用的哥伦比亚固体培养基,其中常加入10%的胎牛血清,本研究加入的是10%的脱纤维绵羊全血,营养更充分,且后期纯培养时均采用三气培养箱进行培养,培养条件较稳定,利于H.pylori的生长。
本研究分离培养88株临床组织标本,阳性株有19株,其阳性率为22%。且H.pylori临床菌株的培养阳性率与入选病人性别、年龄无关。这与国内外报道的H.pylori临床菌株培养阳性率相比明显较低。针对H.pylori分离阳性率较低,可能存在以下原因:(1)钳取患者胃组织标本未能及时放入运送液,转运时间太长;正常情况下将组织分离后转运至实验室分离培养的时间一般不超过3~4 h,转运时间太长或温度过高会导致细菌死亡;(2)在接种菌的过程中暴露在空气中时间过长,导致分离阳性率降低;(3)实验前期在普通实验操作台分离H.pylori,导致杂菌污染而致H.pylori分离失败,之后在超净工作台分离,于三气培养箱中培养,阳性率略提高;(4)钳取胃组织的部位也存在H.pylori分布的差异,有文献报道称,H.pylori多寄生在胃窦部,但在宿主因素和环境因素的共同作用下,极有可能向胃底部及贲门部移行,因此钳取的胃窦部标本可能不存在H.pylori感染或数量极少,不能分离到H.pylori,导致阳性率低[13]。
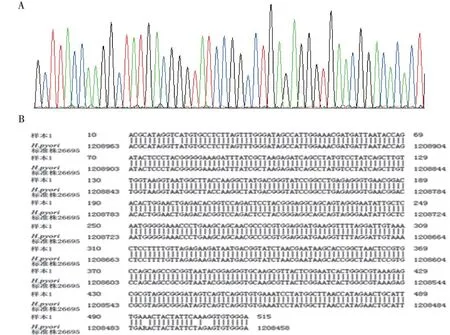
注:A 为分离培养所得的H.pylori菌株的测序峰图,B为与国际标准株26695的比对结果图3 分离培养所得的H.pylori菌株的测序峰图及与标准株26695的比对结果Fig.3 Sequencing map of sample and the blast result compared to international standard 26695 strain
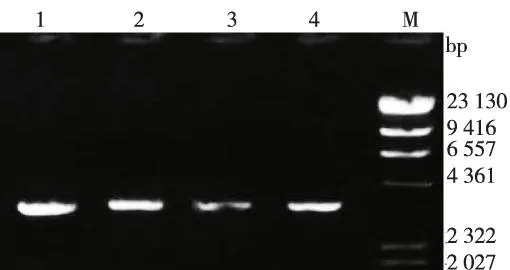
注:M为PNA Marker,1~4为分离培养菌株图4 H.pylori cagA基因PCR扩增产物Fig.4 Electrophoresis map of PCR products of H.pylori CagA gene
H.pylori的最佳培养时限是3 d,此时菌落的肉眼形态与镜下菌体形态均很典型,细菌处于对数生长期,可以进行传代、保存或药物敏感性试验等研究[14]。本次分离培养H.pylori临床株也证实了这一点,传代培养3 d的H.pylori平板上菌落形态典型,经革兰氏染色后镜下可见呈S形、螺旋状,培养约5 d后经革兰氏染色后镜下可见细菌开始球形变,呈短杆状,延长培养至7 d时,此时可能由于培养基营养成分缺失等原因,H.pylori形态呈球形变,且低温保存后难以复苏成功。所以,本研究把纯培养后生长良好H.pylori菌落保存于小牛血清和蔗糖的等体积混合液中,-80 ℃过夜保存后转入液氮长期保存,其复苏成功率较高,说明该方法可以很好地用于H.pylori临床菌株的保存。
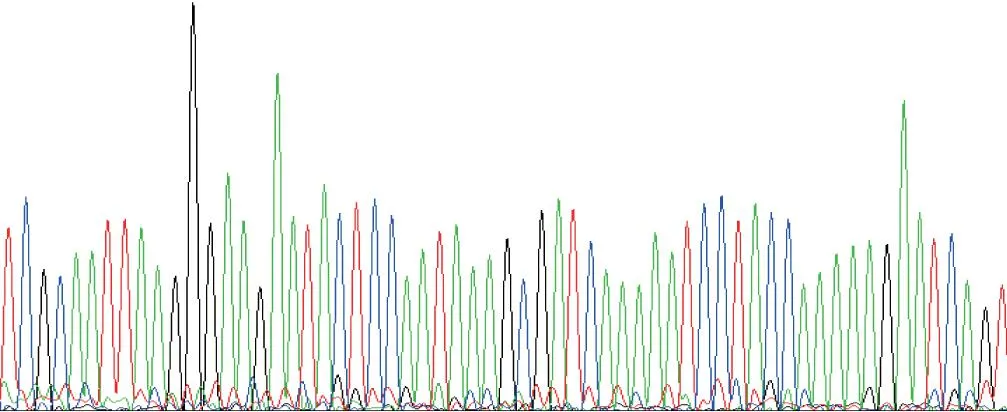
图5 cagA基因部分序列峰Fig.5 The partial sequencing diagram of CagA
4参考文献
[1] Warren JR, Barry M.Unidentified curved bacilli on gastric epithelium in active chronic gastritis[J]. Lancet, 1983(8336): 1273-1275.
[2] Marshall BJ, Warren JR. Unidentified curved bacilli in the stomach of patients with gastritis and peptic ulceration[J]. Lancet, 1984(8390): 1311-1315.
[3] Zhang L, Wang P, Wei SL, et al. Advances in relationship between gastric disease and polymorphisms in both helicobacter pylori virulence factors and host genetics[J]. Hereditas, 2011(6): 558-566.
[4] Ahmad A, Govil Y, Frank BB. Gastric mucosa-associated lymphoid tissue lymphoma[J]. Am J Gsatroenterol, 2003(5): 975-986.
[5] Furuta Y, Yahara K, Hatakeyama M, et al. Evolution ofcagAoncogene ofHelicobacterpylorithrough Recombination[J]. PLoS ONE, 2011(6):1-11.
[6] Izzotti A, Durando P, Ansaldi F, et al. Interaction between Helicobacter pylori,diet, and genetic polymorphisms as related to non-cancer diseases[J]. Mutat Res, 2009(667): 142-157.
[7] Isomoto H, Kawazoe K, Inoue K, et al. Usefulness of the immunological rapid urease test for detection ofHelicobacterpyloriin patients who are reluctant to undergo endoscopic biopsies[J]. Dig Dis Sci, 2006(51): 2302-2305.
[8] Yang CS, Cao SY. Study of correlation betweenHelicobacterpyloriinfection and hyperammonemia and hepatic encephalopathy in cirrhotic patients[J]. Zhongguo Weizhongbing Jijiu Yixue, 2007(19): 422-424.
[9] 胡伏莲.中国幽门螺旋杆菌研究现状[J].胃肠病学, 2007(9):516-518.
[10]Yin Y, He LH, Zhang JZ. Successful isolation ofHelicobacterpyloriafter prolonged incubation from a patient with failed eradication therapy[J]. World J Gastroenterol, 2009(15): 1528-1529.
[11]Koido S, Odahara S, Mitsunaga M, et al. Diagnosis ofHelicobacterpyloriinfection: comparison with gold standard[J]. Rinsho Byori, 2008(56): 1007-1013.
[12]Schreiber S, Bücker R, Groll C, et al. Rapid loss of motility ofHelicobacterpyloriin the gastric lumen in vivo[J]. Infect Immun, 2005(73): 1584-1589.
[13]吴友山,李秀青.不同部位胃癌Hp感染的比较[J].山西医科大学学报, 2009 (11):1011-1013.
[14]郝庆. 幽门螺杆菌对克拉霉素耐药的分子基础[D]. 沈阳:中国医科大学, 2002.
(2016-01-07收稿,2016-03-22修回)
中文编辑: 周凌; 英文编辑: 刘华
Isolation and Culture and Identification of Clinical Strains ofHelicobacterpylori
LIU Zhengmei, ZHOU Jianjiang, ZHAO Yan, XIONG Lin, LONG Niya, XIE Yuan
(KeyLaboratoryofMolecularBiology,GuizhouMedicalUniversity,Guiyang550004,Guizhou,China)
[Abstract]Objective: To isolate and culture the clinical strains of Helicobacter pylori (H. pylori) from patients in the Affiliated Hospital of Guizhou Medical University, and to master the methods of isolation, culture and identification of clinical isolates. Methods: 88 samples of specimens were collected from clinical gastric mucosal tissue and inoculated on columbia selective medium with 10% sheep blood, then cultured on the condition of 37 ℃, 5% O2, 10% CO2, 85% N2 for 3~5 days. The transparent small suspicious colonies on blood agar were picked out to undergo Gram staining and rapid urease test. The positive colonies were expanded by pure culture. DNA of bacterial was extracted and 16sRNA of H. Pylori was amplified by PCR. Electrophoresis and sequencing were conducted for identification. Results: 19 strains of H. Pylori from 88 samples of specimens collected from clinical gastric mucosal tissue were successfully isolated, cultured and identified. The positive rate was 22%. 16sRNAand CagA of H. Pylori were amplified by PCR and their electrophoresis strips were clearly visible. The sequenced 16sRNA amplification products were compared with H.pylori international standard strain 26695, and their homology was 95%~99%. Conclusion: H.pylori clinical strains are successfully isolated and cultured, and the method of isolation, culture and identification of H.pylori clinical isolates was skillfully mastered.
[Key words]Helicobacter pylori; isolation and culture; clinical strains; Gram stain; CagA gene
[中图分类号]R378.99
[文献标识码]A
[文章编号]1000-2707(2016)04-0402-05
*[基金项目]国家自然科学基金(No.81260303)
**贵州医科大学2013级硕士研究生
***通信作者 E-mail:xieyuan1974@163.com
网络出版时间:2016-04-20网络出版地址:http://www.cnki.net/kcms/detail/52.5012.R.20160420.1808.020.html

