同源重组与Gibson Assembly方法构建腺病毒载体*
邓楚钟, 潘耀振
(贵州医科大学附院 肝胆外科, 贵州 贵阳 550001)
同源重组与Gibson Assembly方法构建腺病毒载体*
邓楚钟, 潘耀振*
(贵州医科大学附院 肝胆外科, 贵州 贵阳550001)
[摘要]目的: 对比同源重组与Gibson Assembly两种方法构建腺病毒载体的效率。方法: 增殖并提取AD4 DNA,分别用同源重组与Gibson Assembly两种方法,将AD4 DNA镶嵌入pBR322质粒,构建出携带有全长AD4 DNA的腺病毒载体,并进行PCR和测序鉴定,对比两种方法构建腺病毒载体的筛选效率。结果: 两种方法均能构建出正确的腺病毒载体;筛选同源重组法1 000个菌落中,鉴定360个,仅有1个菌落;Gibson Assembly法112个菌落数中,鉴定其中10个,有3个阳性。结论: Gibson Assembly方法比传统同源重组方法在构建腺病毒载体时更有效。
[关键词]腺病毒; 疫苗; 重组载体; Gibson Assembly
腺病毒是一种无包膜的双链DNA病毒,分子量为150 MDa,直径约为950 Å,它是已知最大和最复杂的无包膜DNA病毒之一[1]。腺病毒广泛存在于自然中,能通过呼吸道、消化道、眼黏膜等途径感染动物和人,无论增殖和非增殖细胞均可以被感染,但对人类的致病性低。由于腺病毒和人类基因组同源,感染后不会整合到人染色体中,不会导致染色体突变。因此,将腺病毒作为抗原呈递载体构建疫苗,具有高效、安全、给药方便的优点,可以激发机体天然免疫反应,同时便于保存及成本易控[2-9],这些优势使得腺病毒载体成为疫苗研究的热点。同源重组方法构建腺病毒载体是目前公认的效率较高的方法,但由于受到36 Kd腺病毒DNA碱基数量过大影响,实际效率不高。Gibson Assembly方法是近些年由Dr. Daniel Gibson发明了一种新的方法,可以容易的将多个线性DNA片段组合到一起。本研究采用传统同源重组与Gibson Assembly两种方法对腺病毒载体进行构建,并做出对比与评价。
1材料和方法
1.1主要材料
质粒pBR322、大肠杆菌DH5α、大肠杆菌DY330、E1区、E3区、蛋白IX缺损的4型腺病毒以及Hela229细胞由中国军事医学科学院8所提供,经PCR及酶切鉴定无误。质粒提取试剂购买于威格拉斯公司,电击仪、1 mL电击杯购于Bio-Rad Micro pulserTM公司,Gibson Assembly Mix试剂购买于NEB公司,Q5 Taq酶购买于NEB公司,限制性内切酶购买于宝生物公司。
1.2实验方法
1.2.1腺病毒感染繁殖和DNA提取E1区、E3区、蛋白IX缺损的Ad4感染入Hela229细胞, 10%胎牛血清 EMEM 37 ℃温箱培养72 h,使病毒在细胞内增殖。反复冻融数次,破坏细胞壁后收集至20 mL超滤管5 000 g离心30 min,使含有病毒的培养液浓缩。加入Baffer A 2 mL(100 mmol/L Tris、150 mmol/L NaCl、12.5 mmol/L EDTA)到20 mL超滤管5 000 g离心,反复洗涤4次后加入等体积Baffer B(100 mmol/L Tris、150 mmol/L NaCl、12.5 mmol/L EDTA、2%SDS)及1/50体积蛋白酶K,50 ℃反应30 min。酚氯仿抽提及乙醇沉淀得到纯净的DNA。-80 ℃冰箱保存备用。
1.2.2同源重组方法构建腺病毒载体
1.2.2.1腺病毒载体质粒骨架(pBR-4VLR)构建pBR322质粒用限制性内切酶HindIII切成线性。用PCR扩增两条同源壁,一端(40 bp)与pBR322同源,另一端与AD4两端同源。左臂长974 bp,上游引物CTATCTATATAATATACCTTATTTTTTTTGTG,下游引物GACGAGCAGGCGATTCAGAAC;右臂长853 bp,上游引物GCCTCAGGAACAACGATGGAA,下游引物CACAAAAAAAATAAGGTATATTATTGATGA。在DY330中同源重组,使同源臂链接在pBR322上。
1.2.2.2打靶感受态制备取5 μL DY330细胞接于5 mL无抗性培养液中,30 ℃摇床增殖12~16 h。取增殖后的菌液300 μL加入15 mL LB,30 ℃摇床培养2 h,42 ℃水浴摇床培养12 min,冰浴30 min,用离心机7 500 r/min和无菌水在4 ℃条件下洗涤3次。10%甘油重悬1 mL,4 ℃ 12 000 r/min离心机中再洗涤1次, 10%甘油200 μL重悬。
1.2.2.3同源重组取40μL感受态细胞、AD4 DNA10 ng和pBR-4VLR 1.5 ng于电击杯中,电击仪电击。电击打靶条件:电压1.5 kV,电阻300 Ω,电容2.5 μF。加入无抗LB1 mL稀释,取出500 μL涂琼脂平板,置入30 ℃温箱培养过夜,挑平板中单菌落作鉴定。见图1。
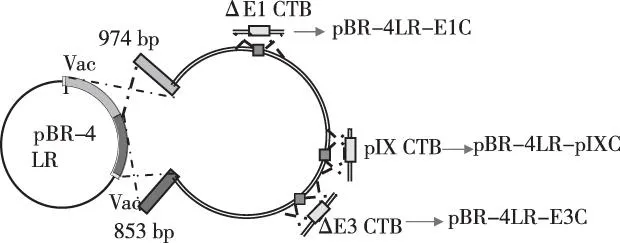
图1 同源重组法构建腺病毒载体方法Fig.1 Illustration of homologous recombination in constructing adenovirus vector
1.2.3Gibson Assembly方法构建腺病毒载体1.2.3.1原料扩增pBR322为载体骨架,将3.6 kb的AD4 DNA分成AD-1、AD-2、AD-3、AD-4 4段,均用PCR方法扩增,5段原料两侧均设计30 bp左右的同源臂。pBR 322段(2 kb):Q5Taq,上游引物ATTATTGATGATGCGATCGCCATCGGTATCATTACCCCCATG,下游引物TATATTATTGATGATGCGATCGCGAATTCTTGAAGACGAAAGGGCC;条件为98 ℃预变性 5 min,98 ℃ 30 s、64 ℃ 30 s、72 ℃ 1 min, 3个循环; 98 ℃ 10 s、72 ℃ 1 min, 27个循环; 最后 72 ℃延伸2 min。PCR 产物胶回收纯化。AD-1段(8.6kb):Q5Taq,上游引物CTATCTATATAATATACCTTATTTTTTTTGTGTGAGTTAATATGC,下游引物TGAGTTTGAACCTGAAAGACAGTTCGACAGAATCAATCTCGGTATC。AD-2段(10 kb)DNA模板AD4 DNA,Q5酶,上游引物ATTGACGGCGGCCTGCCGCAGAATCTCTTGCACGTCGCCCGAGTTG,下游引TGCCTAACAGACCCAACTACATTGGCTTCAGAGACAATTTTATCGG。AD-3段(10 kb)DNA模板AD4 DNA,Q5Taq,上游引物GCTCATGTACTACAACAGCACTGGCAATATGGGGGTGCTGGCCG,下游引物TTAGTGATTCTGAGGGGTATTATACCCAACATACTTTTATCT。AD-4段(7.4 kb)DNA模板AD4 DNA,Q5Taq,上游引物ATGACATTAAGGTCATACCATTGCCAACACCCAGCCCACCTAGCA,下游引物TTGCATATTAACTCACACAAAAAAAATAAGGTATATTATATAGATAG。条件为98 ℃预变性3 min; 98 ℃ 10 s、64 ℃ 30 s、72 ℃ 4 min, 30个循环; 72 ℃延伸2 min。PCR 产物胶回收纯化。
1.2.3.2PCR产物链接在充分预冷前提下,快速以每种产物0.2~1 pmol/L浓度配备好溶液,再加无菌水至10 mL,并加入Gibson Assembly Mix酶10 μL,50 ℃反应60 min,电击转化法转入DH5α。置入37 ℃温箱培养过夜。挑平板中单菌落作鉴定。见图2。
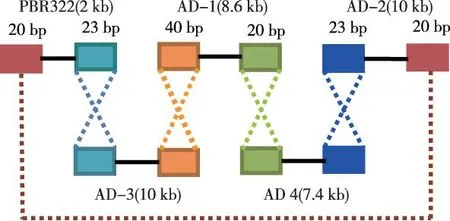
图2 Gibson Assembly方法构建腺病毒载体方法Fig.2 Illustration of Gibson Assembly method in constructing adenovirus vector
2结果
2.1AD4 DNA制备
AD4感染Hela229细胞24 h后,显微镜下观察见细胞变形、萎缩、凋亡,见图3,转染效率达到80%以上。用超滤管浓缩后提取,可以从>20 mL的Ad4上清中提取DNA,产物浓度600~800 mg/L,产物体积每管20 μL。经NotI、EcoRV、EcoRI、KpnIBamHI、HindIII、SmaI、XbaI酶切定酶切鉴定,证实DNA序列没有出现大量断裂和损伤,见图4。

图3 Ad4病毒培养(Hela229)Fig.3 Cultivation of Ad4 virus
2.2腺病毒载体鉴定
PCR鉴定,扩增片段大小为750 bp(图5),同源重组及Gibson Assembly方法测序鉴定见图6,结果正确。
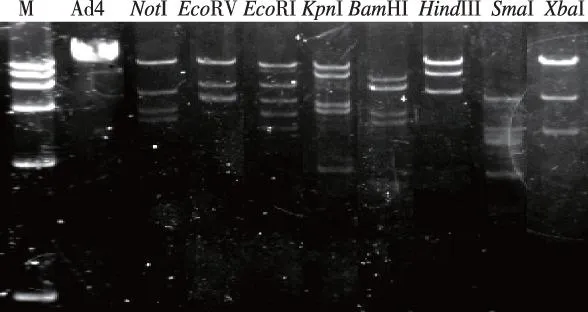
图4 NotI、EcoRV、EcoRI、KpnI BamHI、HindIII、SmaI、XbaI酶切鉴定Fig.4 Enzyme digestion of AD4 DNA by NotI,EcoRV,EcoRI, KpnI BamHI, HindIII, SmaI, XbaI
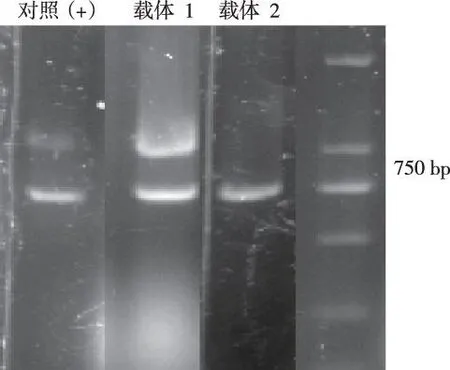
注:载体1为同源重组法,载体2为Gibson Assembly法图5 PCR鉴定同源重组与Gibson Assembly方法构建的腺病毒载体Fig.5 PCR identification of homologous recombination and Gibson Assembly method

注:A为同源重组法,B为Gibson Assembly法图6 同源重组及Gibson Assembly方法构建的腺病毒载体测序结果Fig.6 Sequence outcome of homologous recombination and Gibson Assembly method
2.3筛选效率
如表1所示,同源重组方法的筛选效率低于Gibson Assembly方法。
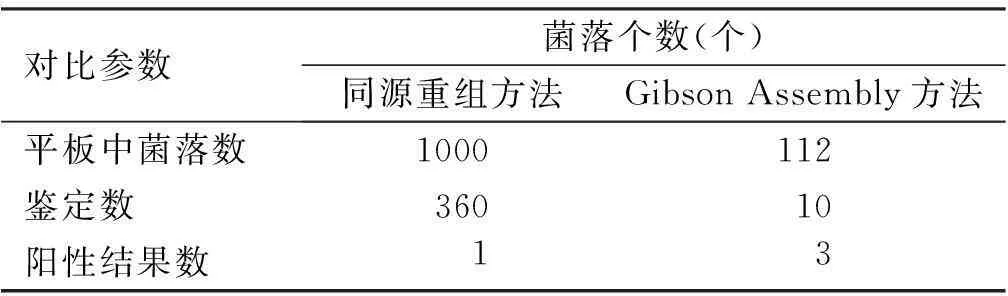
表1 同源重组方法与Gibson Assembly方法
3讨论
基因治疗是近几十年来发展起来的一种治疗疾病的手段,已经成功地应用于临床[10]。它通过基因的转移来预防和治疗疾病,尤其在疫苗、肿瘤及遗传性疾病方面, 应用前景十分突出。基因治疗中,基因传递系统是研究的重点,如何把特异性基因快速、高效的导入相应的靶细胞,不仅是研究特定基因的结构、功能及表达调控的重要手段,也是基因治疗的关键[11]。基因传递系统中应用的载体分为非病毒方式和病毒方式[12]。非病毒方式载体在基因治疗中应用较少,它的优点在于没有病毒的致病性,因此机体不会导致明显的免疫反应,相对安全 ,缺点在于目的DNA转染效率低,即使转入细胞内,也容易被细胞内DNA酶降解,导致为数不多的目的基因无法稳定存在于细胞内并高效表达。目前,绝大多数的基因治疗的方案中都使用病毒载体介导目的基因,主要优点是转染效率高,目的基因表达稳定;病毒载体可剪除一些致病基因序列,改造成低致病性的缺陷型病毒,使得用病毒载体的基因治疗更加安全。用于基因治疗的常用载体有逆转录病毒载体、腺病毒载体 、腺病毒相关病毒载体 、单纯疱疹病毒载体以及嵌合病毒载体等[13]。
腺病毒载体构建完成,只需将目的基因插入到病毒基因组中预先缺损的E1区、E3区、蛋白IX三个区域,感染到细胞内,就可使用能表达目的基因的重组腺病毒制成的药物,发挥作用。如插入CTB(霍乱弧菌肠毒素的B亚基),构建出霍乱疫苗,插入HBsAg(乙肝病毒表面抗原)构建出乙肝疫苗。具体效果取决于抗原类型和插入的区域。从目前临床应用来看,由正常人p53肿瘤抑制基因和改构的5型腺病毒基因重组而成的世界上第一个上市的肿瘤基因治疗药物,即重组人p53腺病毒注射液(国药准字S20040004)已于2012年在中国生产[14]。重组人p53腺病毒中p53基因是发挥肿瘤治疗作用的主体结构,腺病毒为载体,腺病毒载体承载p53治疗基因进入肿瘤细胞内发挥作用。实践证实腺病毒载体承载基因效果明显,而且相对其它手段还具有安全、给药方便等特点。可用于制药、基因工程疫苗、基因治疗以及肿瘤治疗等领域,有很高的科研和临床应用价值,前景非常宽广。
同源重组方法是目前使用很多的方法,它是基于pBR322通过PCR引物在质粒的两端加上同源臂构建出质粒骨架pBR-4VLR,利用DY330的Red重组酶(由Gam、Bet、Exo 3个亚基组成),使E1区、E3区、蛋白IX缺损的线性的AD4 DNA在大肠杆菌内与质粒发生序列特异的发生同源重组,制作成腺病毒载体。同源重组法利用Red重组酶,能快速、精确的将AD4 DNA引入质粒骨架中,但筛选时易出现出现假阳性结果,背景值很高。考虑原因为腺病毒DNA序列较长,使质粒骨架对其捕捉时效率降低。
Gibson Assembly方法不用考虑片段的长度或者末端的互补性,将多个具有重合区的DNA片段放在一个单温反应管里就可以实现片段的连接。在T5外切酶、Phusion DNA聚合酶、Taq DAN连接酶的作用下,用PCR扩增的5段DNA片段连接成一个完全的双链DNA分子,制作成相同的腺病毒载体。制作中不仅减少了同源重组方法中的很多工序,降低了操作难度还节约时间。腺病毒载体的鉴定中,只有较少菌落,并且很容易就得到了正确的菌落。最重要的是同源重组等方法构建出腺病毒载体后需要将目的基因采用双质粒共转染等方法插入腺病毒载体中,而 Gibson Assembly方法则只需将目的基因和其它DNA片段一起用PCR扩增出来,再共同一管反应,直接连接在一起。非常高效、灵活。
从载体筛选来说,同源重组的假阳性结果非常多,背景值较高,筛选很困难。而Gibson Assembly方法让我们获得了满意的效率。从载体的构建方面看Gibson Assembly方法明显比传统的同源重组更加简单、快捷和方便,由于可以将多条DNA片段同时连接,Gibson Assembly更加灵活多变。Gibson Assembly这种新方法的简单、高效、多变,在腺病毒载体构建方面表现出了非常好的前景。本实验针对腺病毒疫苗载体构建方法做了构想、设计、实际操作、对比及评论,利用目前应用最多的同源重组方法和近年来开发但并未应用于腺病毒载体构建中的Gibson Assembly方法进行实际操作、评估,得到了Gibson Assembly方法相比其他方法更具优势的理论和数据支持。希望能为此领域的研究提供依据,为下一步的研究和改进工作提供数据和经验。
4参考文献
[1] Smith JG, Wiethoff CM, Stewart PL, et al. Curr Top Microbiol Immunol[J],Adenovirus, 2010(16): 195-224.
[2] Wei CJ, Boyington JC, McTamney PM, et al. Induction of broadly neutralizing H1N1 influenza antibodies by vaccination [J]. Science, 2010 (27): 1060-1064.
[3] Hashem AM, Jaentschke B, Gravel C, et al. Subcutaneous immunization with recombinant adenovirus expressing influenza A nucleoprotein protects mice against lethal viral challenge [J]. Hum Vac Immunother, 2012 (4): 425-430.
[4] Song K, Bolton DL, Wei CJ, et al. Genetic immunization in the lung induces potent local and systemic immune responses [J]. PNAS, 2010 (51): 22213-22218.
[5] Roy CJ, Ault A, Sivasubramani SK, et al. Aerosolized adenovirus-vectored vaccine as an alternative vaccine delivery method [J]. Resp Res, 2011 (1): 153-159.
[6] Frenkel VM, Lengagne R, Gaden F, et al. Adenovirus hexon protein is a potent adjuvant for activation of a cellular immune response [J]. J Virol, 2002 (1): 127-135.
[7] Croyle MA, Cheng X, Wilson JM. Development of stable liquid formulations for adenovirus-based vaccines[J]. J Pharmacol Sci, 2001 (10): 2458.
[8] Tang DC, Zhang JF, DVM HT, et al. Adenovirus as a carrier for the development of influenza virus-free avian influenza vaccines [J]. Expert Rev Vaccines, 2009 (4): 469-481.
[9] Kovesdi I, Hedly SJ. Adenoviral Producer Cells [J]. Viruses, 2010(2): 1681-1703.
[10]Kim SY, Peng ZH,Kaneda F,et al. Current status of gene therapy in Asia. Mo Ther, 2008(2):237-243.[11]胡朝全,孙诚谊,孙连生,等.重组腺病毒载体含人抑瘤素的扩增及纯化[J].贵阳医学院学报, 2004(1):14-17
[12]Robbins PD, Tahara H, Chivizzani SC. Viral vector for gene therapy[J] . Trend in Biotechnology, 1998(16): 35-40.
[13]Smith KT, Shepherd AJ, Boyed JE, et al. Gene delivery system for use in gene therapy: an overview of quality assurance and safety issues[J] . Gene ther, 1996(3): 190
[14]王建功,王晓红,杨俊泉,等. 重组人p53腺病毒联合放化疗治疗局部晚期非小细胞肺癌[J]. 贵阳医学院学报, 2014(2):225-228.
(2016-01-05收稿,2016-03-28修回)
中文编辑: 文箐颍; 英文编辑: 刘华
Comparison between Homologous Recombination and Gibson Assembly Method in Constructing Adenovirus Vectors
DENG Chuzhong, PAN Yaozhen
(DepartmentofHepatobiliarySurgery,theAffiliatedHospitalofGuizhouMedicalUniversity,Guiyang550001,Guizhou,China)
[Abstract]Objective: To compare the efficiency of traditional homologous recombination method with Gibson Assembly method in constructing adenovirus vector. Methods: AD4 DNA was proliferated and extracted, and inlaid AD4 into the pBR322 DNA plasmid and constructed adenovirus vector with total length of the AD4 DNA by homologous recombination method or Gibson Assembly method, which was amplified by PCR and sequenced for identification. Then, the efficiency of two methods was compared. Results: Both methods could construct the adenovirus vector of right sequence. There were over 1 000 colonies in the plate using homologous recombination method, among which 360 colonies were identified and there was only one positive result. Although there were only 112 colonies in the plate using Gibson Assembly, 10 colonies among then were identified and there were three positive results. Conclusion: Gibson Assembly method is more efficient than traditional homologous recombination method in constructing adenovirus vector.
[Key words]adenovirus; vaccine; recombination vector; Gibson Assembly
[中图分类号]R346
[文献标识码]A
[文章编号]1000-2707(2016)04-0430-06
*通信作者E-mail:527089839@qq.com
网络出版时间:2016-04-20网络出版地址:http://www.cnki.net/kcms/detail/52.5012.R.20160420.1825.032.html

