循环半乳糖凝集素3水平预测慢性肾脏病患者心血管事件风险的价值
张志宏 张丽华 郑春霞 安 玉 王金泉 章海涛 刘志红
·论 著·
循环半乳糖凝集素3水平预测慢性肾脏病患者心血管事件风险的价值
张志宏1*张丽华2*郑春霞2安 玉2王金泉2章海涛2刘志红2
目的:分析循环半乳糖凝集素3(Gal-3)水平在预测慢性肾脏病(CKD)患者心血管事件风险中的价值。 方法:将2013年12月~2015年3月住院的CKD 2~5期患者纳入观察,另纳入70例年龄、性别匹配的健康体检者为对照组。分析患者临床表现,入院24h后完善相关实验室检查,双抗体夹心法检测血清Gal-3浓度。心脏超声测定左心室舒张末期内径(LVEDD)、左心室后壁厚度(PWTd)、室间隔厚度(SWTd),计算相对室壁厚度(RWT)和左心室质量(LVM)、左心室质量指数(LVMI),描述瓣膜钙化情况。冠脉CT检查行冠脉钙化评分(CAC)、腹部侧位平片检查行腹主动脉钙化评分(AAC)。分析循环Gal-3水平与心血管危险因素、心血管塑形及钙化的关系。 结果:共纳入436例CKD患者,CKD 2期患者Gal-3水平显著高于对照组(P<0.001);随肾功能减退,该升高趋势愈加显著(P均<0.001)。Gal-3水平与CKD患者多项心血管危险因素有相关性(P<0.05);与心超测量参数LVEDD/BSA、PWTd、LVM和LVMI均相关(P<0.05)。血清Gal-3 水平与心血管钙化无相关性。 结论:Gal-3水平在CKD早期即显著升高,升高的Gal-3水平不仅与患者多项心血管事件危险因素相关,亦与左心室重塑相关。将Gal-3纳入CKD患者心血管事件风险的评价体系中可能具有特殊价值。
慢性肾脏病 半乳糖凝集素3 心血管事件 风险
慢性肾脏病(CKD)已是全球公共卫生问题[1-2]。据估计,在我国约有1.19亿CKD患者[3]。随肾功能减退,CKD患者发生心力衰竭、急性心肌梗死、脑卒中和外周动脉栓塞等心血管事件的风险显著升高。近期一项纳入超过100万病例随访为期2年的观察性研究发现,CKD患者发生心血管事件的风险显著高于同期肾功能正常的糖尿病患者,全因死亡风险是后者的2.18倍[4]。对无症状的CKD患者进行心血管事件危险分层具有重要的临床意义。
现阶段评估心血管事件风险的生物标志物主要有脑钠肽[B型利钠肽(BNP)与N末端B型利钠肽原(NT-proBNP)]和肌钙蛋白[肌钙蛋白T(TnT)与肌钙蛋白I(TnI)][5-6]。NT-proBNP主要经肾脏清除[7],肾功能减退显著影响其预测心血管事件风险的价值[8]。近年来,凝集素家族成员半乳糖凝集素3(Gal-3)备受临床关注。Gal-3是一种对含有β-半乳糖苷残基具有很高亲和力的糖蛋白,在激活的巨噬细胞中高表达,通过一种类似细胞胞吐的机制转移至细胞外并进入全身循环。Gal-3在器官炎症反应与纤维化进程中发挥特殊作用。CKD患者常见心血管重塑及钙化现象,两者皆为心血管事件的重要预测因子[9-10]。目前,以CKD人群为研究对象,应用Gal-3评估心血管事件风险的研究仍非常有限。本文报告CKD 2~5期非透析患者循环Gal-3水平与心血管危险因素、左心室重塑及心血管钙化的相关关系。
对象和方法
研究人群 研究对象为2013年12月~2015年3月在南京军区南京总医院肾脏科住院患者。纳入标准:CKD 2~5期,年龄16~65岁,男女不限。排除标准:重度水肿、心功能不全(NYHA分级Ⅲ~Ⅳ级)、恶性肿瘤、近期严重外伤或接受大手术、明显肥胖或消瘦[体质量指数(BMI)>30 kg/m2或<18 kg/m2]、任何形式的肾脏替代治疗。另纳入年龄、性别匹配的健康体检者70例设为对照组。所有研究对象均签署书面知情同意书,本研究符合医学伦理准则。
研究方法 收集患者年龄、性别、既往病史、吸烟史等临床信息,清晨空腹检测患者BMI、体表面积(BSA)、血压、24h尿蛋白定量、血红蛋白(Hb)、血清白蛋白(Alb)、尿酸(UA)、胱抑素C(Cys C)、总胆固醇(TC)、钙(Ca)、磷、全段甲状旁腺素(iPTH)、TnT、NT-proBNP、Gal-3水平。估算的肾小球滤过率(eGFR)计算采用2009年CKD-EPI公式。校正Ca(mmol/L)=血清Ca(mmol/L)+0.2×[40-Alb(g/L)]。血清Gal-3浓度采用双抗体夹心法检测。经胸心脏超声测量左心室舒张末期内径(LVEDD)、左室后壁厚度(PWTd)、室间隔厚度(SWTd)和左心室射血分数(LVEF)。计算相对室壁厚度(RWT)和左心室质量(LVM)、左心室质量指数(LVMI)[11]。根据RWT与LVMI分为四组,即结构正常组[RWT≤0.42和LVMI≤115 g/m2(男)或≤95 g/m2(女)];结构重塑组[RWT>0.42和LVMI≤115 g/m2(男)或≤95 g/m2(女)];向心性肥厚组[RWT>0.42和LVMI>115 g/m2(男)或>95 g/m2(女)];离心性肥厚组[RWT≤0.42和LVMI>115 g/m2(男)或>95 g/m2(女)],超声检查由固定1位医师完成。本研究将上述结构重塑与向心性肥厚和离心性肥厚统称为左心室塑形改变(LVRM)。冠状动脉钙化积分(CACS)采用双源CT平扫胸部,进行Agaston 评分;腹主动脉钙化积分(AACS)采用侧位腹部平片,进行Kauppila 评分。
统计方法 采用SPSS 13.0软件进行统计学分析。正态分布计量资料以均数±标准差表示,Gal-3为偏态分布,以中位数(四分位间距)表示,计数资料采用列联表表示。计量资料组间比较采用t检验或方差分析,计数资料组间比较采用χ2检验或Fisher精确检验,等级资料多组间比较采用Kruskal-Wallis H检验。P<0.05为差异有统计学意义,P<0.01为统计学差异显著。
结 果
CKD患者临床与实验室资料 共纳入436例患者,其中男性272例(62.3%),平均年龄42.3±15.8岁,合并糖尿病181例(41.5%),高血压291例(66.7%),吸烟79例(18.1%)。所有患者Gal-3水平(Median,IQR)41.02(27.44,58.90) ng/ml,NT-proBNP水平(Median,IQR)37.1(8.9,133.7) pmol/L。对照组Gal-3水平16.69(13.94,19.75) ng/ml。CKD 2期Gal-3水平即高于对照组(P<0.01)随肾功能减退,该升高趋势愈加显著(P均<0.001)。NT-proBNP至CKD 4期方显著高于正常参考值53.1 pmol/L(P<0.001)。随Gal-3水平升高,CKD患者中吸烟比例、合并糖尿病或高血压比例、收缩压(SBP)、血清UA、Cys C、磷、PTH、NT-proBNP和cTnT水平及尿蛋白水平均有升高,而Hb、Alb、eGFR水平均有下降(P<0.001)(表1)。

表1 CKD患者循环Gal-3水平与临床症状及实验室参数的关系
CKD:慢性肾脏病;Gal-3:半乳糖凝集素3;eGFR:估算的肾小球滤过率;iPTH:甲状旁腺激素;NT-proBNP:N末端B型利钠肽原;cTnT:心肌肌钙蛋白T
Gal-3水平与心血管危险因素的相关关系 以年龄和性别校正后,Gal-3水平与患者吸烟、合并糖尿病、SBP、血清UA、Cys C、磷、PTH、NT-proBNP和cTnT浓度及尿蛋白水平均呈正相关(P<0.05),与患者Hb、Alb水平及肾功能(eGFR)均呈负相关(P<0.001);进一步以NT-proBNP校正后,Gal-3水平仍与多项心血管危险因素相关;对数转换后线性分析显示LnGal-3水平与患者eGFR、合并糖尿病、性别及尿蛋白水平显著相关(P均<0.05)(表2)。
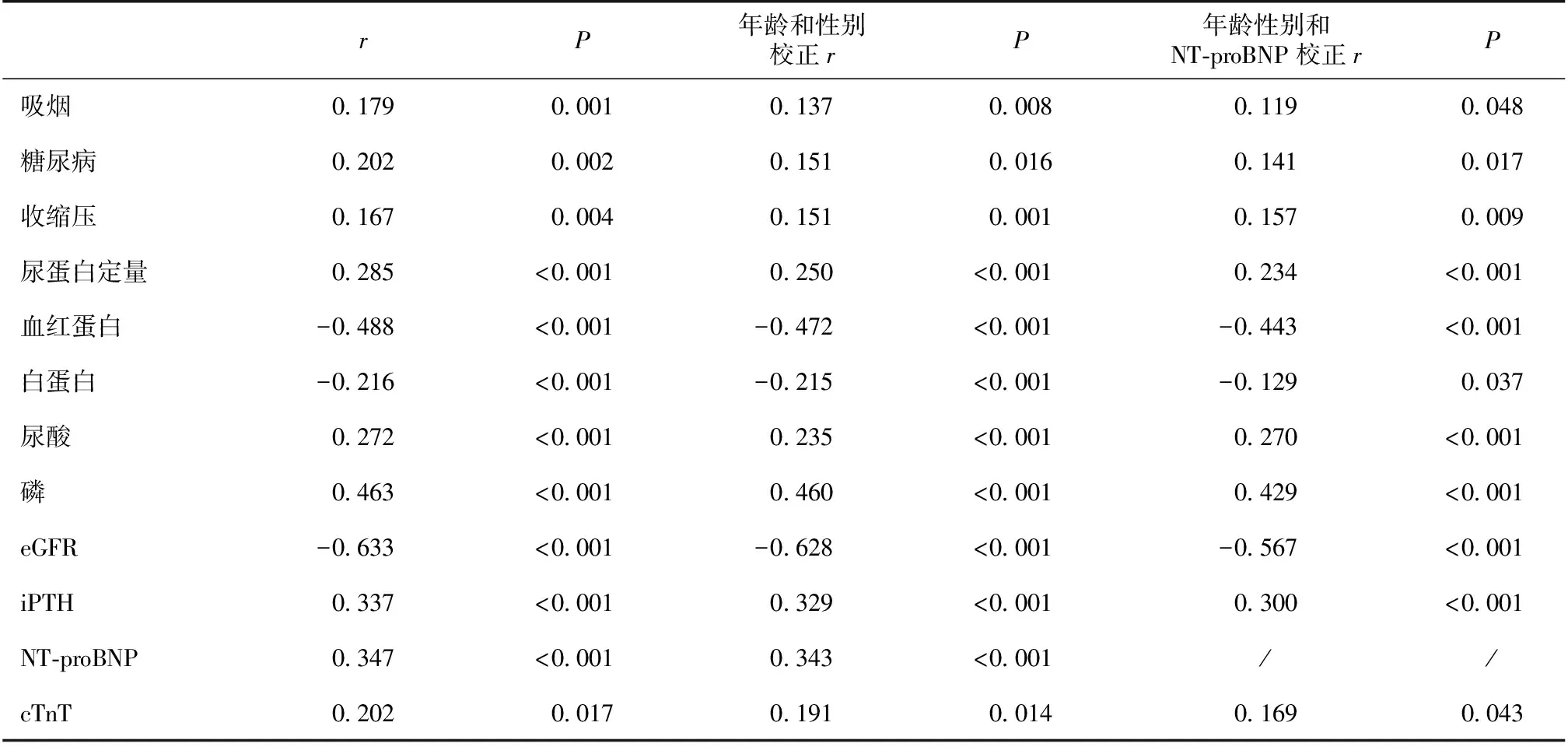
表2 Gal-3水平与心血管危险因素的相关关系
Gal-3:半乳糖凝集素3;eGFR:估算的肾小球滤过率;iPTH:甲状旁腺激素;NT-proBNP:N末端B型利钠肽原;cTnT:心肌肌钙蛋白T
Gal-3水平与左心室塑形变化及心血管钙化关系 Gal-3水平与患者LVEDD/BSA、PWTd、LVM和LVMI水平均相关(P<0.05),以年龄和性别校正后该相关性仍存在(P<0.05)。以RWT、LVMI将患者分为4组,向心性肥厚组和离心性肥厚组Gal-3与NT-proBNP水平均显著高于结构正常组(P均<0.001),结构重塑组Gal-3水平较结构正常组有升高趋势(P=0.043)。以LVRM行NT-proBNP、Gal-3及两者联合的操作者受试曲线(ROC),Gal-3可轻度提高NT-proBNP判断LVRM的曲线下面积(AUC)(P>0.05)。此外,检查发现冠状动脉钙化102例(23.3%),CAC评分0~1 733.50;腹主动脉钙化81例(18.6%),AAC 评分0~24;瓣膜钙化38例(8.7%)。以心血管钙化与否将患者分组,组间Gal-3 水平的差异均无统计学意义(P>0.05)(表3、4,图1)。

表3 CKD患者Gal-3水平与左心室重塑及心血管钙化的关系
CKD:慢性肾脏病;Gal-3:半乳糖凝集素3

表4 不同心脏塑形患者血清Gal-3与NT-proBNP水平
CKD:慢性肾脏病;Gal-3:半乳糖凝集素3;NT-proBNP:N末端B型利钠肽原;与结构正常组比较,*:P=0.043,**:P<0.001

图1 NT-proBNP、Gal-3及两者联合判断LVRM的ROC曲线Gal-3:半乳糖凝集素3;NT-proBNP:N末端B型利钠肽原;LVRM:左心室塑形改变,NT-proBNP、Gal-3及两者联合的AUC分别为0.680、0.661和0.691
讨 论
既往研究提示循环Gal-3水平与一些人群的心血管事件风险独立相关[12-13]。弗明翰心脏研究[14]提出基线Gal-3水平对一般人群10年后肾功能快速减退、心力衰竭和全因死亡的风险具有独立预测价值。路德维希港风险和心血管健康研究(LURIC研究)[15]纳入2 578例接受冠脉成形术的心血管病患者;该研究以eGFR水平将患者分为3组,即≥90 ml/(min·1.73m2)、60~89 ml/(min·1.73m2)和<60 ml/(min·1.73m2),随访10年发现,Gal-3水平升高与CKD 2期及以上分期患者的全因死亡、心血管事件死亡及感染相关死亡均独立相关。但是,LURIC研究纳入分析的患者皆存在心血管疾病,且肾功能不全病例(CKD 3期及以上)仅占13.8%,其中CKD 4期39例,CKD 5期仅10例。因此,上述研究结果需要在CKD患者中进一步的验证。
本研究纳入对象为无心血管基础疾病史的CKD患者,在NT-proBNP与TnT等传统心血管风险评价指标的基础上,结合影像学检查评价Gal-3预测价值。我们的研究发现:(1)无心血管基础疾病史的CKD患者早期即出现循环Gal-3水平升高,而NT-proBNP水平的变化较为迟滞。本组患者在CKD 2期Gal-3平均水平已显著高于健康对照组,随着肾功能减退,Gal-3水平升高愈加明显;而NT-proBNP平均水平直至CKD 4期方显著高于正常参考值53.1 pmol/L。美国慢性肾功能不全队列研究(CRIC研究)[16]提出NT-proBNP对于CKD患者心力衰竭风险具有一定预测价值;CRIC研究共纳入3 483例CKD 2~4期患者,平均随访5年,在校正包括eGFR在内的各项心血管危险因素后,发现与NT-proBNP≤47.6 pg/ml的对照组相比,随着基线NT-proBNP水平的升高,患者发生心力衰竭的风险比例为2.71~9.57。不过,CRIC研究也承认仅以NT-proBNP水平升高难以鉴别患者出现心力衰竭或肾功能下降。Gal-3升高机制有别于NT-proBNP。肾脏纤维化是CKD的特征性标志之一,炎症阶段活化的M2型巨噬细胞,通过所谓Gal-3反馈环路是循环Gal-3重要来源[17]。更重要的是,Gal-3水平升高不仅指示风险,还可直接作用于心血管。Sharma等[18]发现给予野生型大鼠心包腔内连续灌注低剂量的重组Gal-3,4周后大鼠出现心肌纤维化及左心室功能障碍。结合其他研究,我们认为Gal-3可视为NT-proBNP评估CKD患者心血管事件风险的重要补充,尤其对CKD 2~3期患者意义更大。
(2)本研究发现升高的Gal-3水平与CKD患者多项心血管危险因素相关,包括传统与非传统因素。CKD患者除暴露于吸烟、血脂紊乱、高血压与糖尿病等传统危险因素外,与肾功能减退有关的尿毒症毒素潴留、矿物质代谢紊乱与贫血等非传统危险因素亦显著增加其心血管事件风险。Gal-3水平与这些因素相关,在一定程度上反映了CKD患者的心血管危险因素暴露程度。事实上,不同的研究人群均发现Gal-3水平与一定心血管危险因素相关。
弗明翰心脏研究[14]与预防肾脏与血管终点研究(PREVEND研究)[19]纳入的均是肾功能正常的一般人群,前者发现Gal-3水平与肾功能及血高密度脂蛋白水平相关,后者发现Gal-3水平与血压、血脂、BMI、肾功能和NT-proBNP水平均相关。LURIC研究[15]纳入的为接受冠脉成形术的心血管病患者,也发现循环Gal-3水平与患者年龄、C反应蛋白、糖化血红蛋白及NT-proBNP相关。总之,无论观察对象肾功能如何、基础疾病如何,循环Gal-3水平均被发现与暴露的心血管病危险因素关联,提示动态监测Gal-3水平变化的意义。
(3)本研究发现循环Gal-3水平在左心室重塑阶段即已升高,并在心脏塑形不同分期间的差异显著。CKD心肌结构与功能改变随访研究(CASCADE研究)[20]表明CKD患者左心室重塑不仅发生率高,而且是进行性发展的。本研究观察表明Gal-3水平与CKD患者左心室塑形具有相关性,进一步支持前述Gal-3在左心室肥厚与心力衰竭中的病理生理作用;监测Gal-3水平可为左心室重塑提供线索。此外,尽管本研究未发现循环Gal-3水平与CKD患者心血管钙化存在相关性,但我们注意到循环Gal-3水平与患者钙磷代谢指标包括血磷、PTH及成纤维细胞因子23浓度均存在相关性(FGF-23数据本文省略)。新近Calvier等[21]利用Gal-3基因敲除小鼠实验证明Gal-3在醛固酮介导的血管平滑肌纤维化进程中发挥关键性作用。因此,有关Gal-3在心血管重塑及钙化中的作用尚待深入研究。
本研究为单中心横断面观察性研究,存在样本量较少、未观察到临床终点事件等不足。但本研究纳入的CKD各分期患者基线信息对称,性别、年龄、糖尿病比例、吸烟比例相近,预先排除高龄、既往冠状动脉粥样硬化性心脏病病史、合并感染等影响心血管事件风险的因素,研究结果具有良好的代表性与可比性。有必要在此基础上进行前瞻性研究,深化对Gal-3与CKD患者心肾事件风险关系的认识。
小结:Gal-3水平在CKD早期即显著升高,升高的Gal-3水平不仅与患者多项心血管事件危险因素相关,亦与左心室重塑相关。将Gal-3纳入CKD患者心血管事件风险的评价体系中可能具有特殊价值。
致谢 血清标本来自于国家肾脏疾病临床医学研究中心生物样本库。血清半乳糖凝集素3由康圣环球医学特检集团进行检测。
1 Remuzzi G,Benigni A,Finkelstein FO,et al.Kidney failure:aims for the next 10 years and barriers to success.Lancet,2013,382(9889):353-362.
2 Liu ZH.Nephrology in China.Nat rev nephrol,2013,9(9):523-528.
3 Zhang L,Wang F,Wang L,et al.Prevalence of chronic kidney disease in China: a cross-sectional survey.Lancet,2012,379(9818):815-822.
4 Foley RN,Murray AM,Li S,et al.Chronic kidney disease and the risk for cardiovascular disease,renal replacement,and death in the United States Medicare population,1998 to 1999.J Am Soc Nephrol,2005,16(2):489-495.
5 Yancy CW,Jessup M,Bozkurt B,et al.2013 ACCF/AHA guideline for the management of heart failure:a report of the American College of Cardiology Foundation/American Heart Association Task Force on practice guidelines.Circulation,2013,128(16):e240-327.
6 Ostermann M,Lo J,Toolan M,et al.A prospective study of the impact of serial troponin measurements on the diagonsis of myocardial infarction and hospital and six-month mortality in patients admitted to ICU with non-cardiac diagnoses.Crit Care,2014,18(2):R62.
7 Linssen GC,Damman K,Hillege HL,et al.Urinary N-terminal prohormone brain natriuretic peptide excretion in patients with chronic heart failure.Circulation,2009,120(1):35-41.
8 Kidney Disease:Improving Global Outcomes (KDIGO) CKD Work Group.KDIGO 2012 Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease.Kidney Int Suppl,2013,3:1-150.
9 Wang S,Xue H,Zou Y,et al.Left ventricular hypertrophy,abnormal ventricular geometry and relative wall thickness are associated with increased risk of stroke in hypertensive patients among the Han Chinese.Hypertens Res,2014,37(9):870-874.
10 Bourantas CV,Zhang YJ,Garg S,et al.Prognostic implications of coronary calcification in patients with obstructive coronary artery disease treated by percutaneous coronary intervention:a patient-level pooled analysis of 7 contemporary stent trials.Heart,2014,100(15):1158-1164.
11 Lang RM,Badano LP,Mor-Avi V,et al.Recommendations for cardiac chamber quantification by echocardiography in adults:an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging.J Am Soc Echocardiogr,2015,28(1):1-39.e14.
12 Zhou K,Zhou Y,Zhao Y,et al.The Relationship between Galectin-3 and Different Patterns of Ventricular Geometry Remodelling in Aortic Valve Stenosis.Heart Lung Circ,2015,25(4):371-377.
14 O′Seaghdha CM,Hwang SJ,Ho JE,et al.Elevated Galectin-3 Precedes the Development of CKD.J Am Soc Nephrol,2013,24(9):1470-1477.
15 Drechsler C,Delgado G,Wanner C,et al.Galectin-3,Renal Function,and Clinical Outcomes:Results from the LURIC and 4D Studies.J Am Soc Nephrol,2015,26(9):2213-2221.
16 Park M,Hsu CY,Li Y,et al.Chronic Renal Insufficiency Cohort (CRIC) Study Group.Associations between kidney function and subclinical cardiac abnormalities in CKD.J Am Soc Nephrol,2012,23(10):1725-1734.
17 MacKinnon AC,Farnworth SL,Hodkinson PS,et al.Regulation of alternative macrophage activation by galectin-3.J Immunol,2008,180(4):2650-2658.
18 Sharma UC,Pokharel S,van Brakel TJ,et al.Galectin-3 marks activated macrophages in failure-prone hypertrophied hearts and contributes to cardiac dysfunction.Circulation,2004,110(19):3121-3128.
19 de Boer RA,van Veldhuisen DJ,Gansevoort RT,et al.The fibrosis marker galectin-3 and outcome in the general population.J Intern Med,2012,272(1):55-64.
20 Cai QZ,Lu XZ,Lu Y,et al.Longitudinal Changes of Cardiac Structure and Function in CKD (CASCADE Study).J Am Soc Nephrol,2014,25(7):1599-1608.
21 Calvier L,Miana M,Reboul P,et al.Galectin-3 mediates aldosterone-induced vascular fibrosis.Arterioscler Thromb Vasc Biol,2013,33(1):67-75.
(本文编辑 莫 非 凡 心)
Relationship of galectin-3 and risk of cardiovascular events in chronic kidney disease patients
ZHANGZhihong1*,ZHANGLihua2*,ZHENGChunxia2,ANYu2,WANGJinquan2,ZHANGHaitao2,LIUZhihong2
1NationalClinicalResearchCenterofKidneyDiseases,JinlingHospital,NanjingClinicalSchooloftheSecondMilitaryMedicalUniversity,Nanjing210016,China2NationalClinicalResearchCenterofKidneyDisease,JinlingHospital,NanjingUniversitySchoolofMedicine,Nanjing210016,China*ZHANGZhihongandZHANGLihuaareconsideredtobefirstauthors
LIUZhihong(E-mail:liuzhihong@nju.edu.cn)
Objective:To investigate the relationship between serum galectin-3(Gal-3) levels and the risk of cardiovascular events and left ventricular geometry remodeling in chronic kidney disease (CKD)patients. Methodology:From Dec. 2013 to Mar. 2015, the patients aged 16~65 years with baseline CKD stages 2 to 5 were investigated, and a total of 436 CKD patients were enrolled in the final analysis. They were male 272 and female 164 with an average age of 42.3±15.8 years old. Baseline clinical characteristics were obtained. Serum uric acid, creatinine, albumin and C-reactive protein were measured by standard laboratory techniques. Glomerular filtration rate (GFR) was calculated using the CKD-EPI formula. Serum Gal-3 levels were measured by using enzyme linked immunosorbent assay (ELISA). N-terminal pro-hormone of brain natriuretic peptide (NT-proBNP) (Normal values 0~53.1 pmol/L) and cardiac troponin T (cTnT) was measured by an electrochemiluminescence immunoassay (ECLIA). All patients were examined by transthoracic echocardiography to measure the diameter of the left ventricle. Left ventriclar mass index (LVMI) and relative wall thickness (RWT) were obtained by chocardiography. Coronary artery calcification score (CACS) was determined by Spiral computed tomographe coronary angiography. Lateral luvbar X-ray score of the abdominal aorta was used to determine aortic artery calcification (AAC). Results:Serum Gal-3 concentrations were significantly highly in CKD stage 2 patients than that of control group [22.47(16.18, 29.40) ng/mlvs16.69(13.94, 19.75) ng/ml]. Serum Gal-3 concentrations were strongly correlated with eGFR. Other variables with moderate to strong correlations with serum Gal-3 concentration in participants were smoking, diabetes, blood pressure, levels of hemoglobin, albumin, total cholesterol, CysC, P, PTH, NT-proBNP, TnT and 24 h proteinuria. Serum Gal-3 were correlated moderately with LVEDD/BSA、PWTd、LVM and LVMI. There was no evidence of higher serum levels of Gal-3 associated with an increased risk of incident coronary artery or abdominal aorta or cardiac valve calcification. Conclusion:Serum Gal-3 concentrations were significantly highly in CKD early stage. Higher serum levels of Gal-3 were associated with several cardiovascular risk factors and left ventricular geometry remodeling in CKD patients. Serum Gal-3 can serve as potential candidates for prediction risk of cardiovascular events in CKD patients.
chronic kidney disease Galectin-3 cardiovascular events risk
10.3969/cndt.j.issn.1006-298X.2016.02.001
江苏省创新能力建设专项(BM2015004);国家科技支撑计划课题(2013BAI09B04,2015BAI12B05);江苏省临床医学中心项目(BZ2012007)
1第二军医大学金陵医院(南京军区南京总医院)肾脏科 博士研究生,2南京大学医学院附属金陵医院肾脏科 博士研究生(张丽华)国家肾脏疾病临床研究中心 全军肾脏病研究所(南京,210016);*张志宏和张丽华为共同第一作者
刘志红(E-mail:liuzhihong@nju.edu.cn)
2016-02-17
ⓒ 2016年版权归《肾脏病与透析肾移植杂志》编辑部所有

