6-氨基青霉素烷酸分子印迹固相萃取柱在牛乳青霉素药物检测中的应用
王萍,司雄元,檀华蓉*,徐慧敏
1(安徽农业大学 茶与食品科技学院,安徽 合肥,230036) 2(安徽农业大学 生物技术中心,安徽 合肥,230036)
6-氨基青霉素烷酸分子印迹固相萃取柱在牛乳青霉素药物检测中的应用
王萍1,司雄元2,檀华蓉2*,徐慧敏1
1(安徽农业大学 茶与食品科技学院,安徽 合肥,230036) 2(安徽农业大学 生物技术中心,安徽 合肥,230036)
摘要用实验室制备的分子印迹固相萃取柱完成市售牛乳样品中青霉素类药物的提取分离。以青霉素中间体6-氨基青霉烷酸(6-Aminopenicillanic acid,6-APA)为虚拟模板分子,甲酸作为致孔剂,甲基丙烯酸为功能单体,乙二醇二甲基丙烯酸酯为交联剂,合成6-APA分子印迹聚合物(molecular imprinted polymers,MIPs),并对制备条件进行了优化,确定最佳的制备条件是模板分子∶功能单体∶交联剂(摩尔比)=1∶5∶30。采用选择性吸附试验比较青霉素类药物与恩诺沙星在该MIPs的吸附情况,结果表明:MIPs对青霉素类药物及其中间体具有特异性吸附;通过红外光谱和扫描电镜对MIPs结构和形貌进行表征,红外光谱分析可知,MIPs内部具有键合氢键的位点,观察MIPs扫描电镜图发现MIPs表面具有大量孔穴。使用该MIPs装填的固相萃取柱对牛乳样品进行预处理,并采用高效液相色谱进行检测,结果显示有牛乳样品中含有较高浓度6-APA;用空白样品添加不同浓度水平的3种青霉素类药物及6-APA混合溶液进行加标回收率实验,加标回收率为83.5%~87.3%,相对标准偏差(RSDs)为1.03%~7.35%。6-APA分子印迹固相萃取柱在复杂基质如动物源食品、水体、土壤样品的检测中具有广阔前景。
关键词中间体;虚拟模板;分子印迹固相萃取;青霉素类药物;牛乳
青霉素类抗生素(penicillins,PENs)是含有6-氨基青霉烷酸(6-APA)母核结构的一类广谱抗生素[1-2],在畜牧业上广泛用于家畜的呼吸道感染、肠胃道感染等疾病的治疗和预防[3],是治疗奶牛乳腺炎的首选药物。禽畜养殖过程中不规范使用抗生素会造成动物源食品中的药物残留、进入动物体内的残留药物通过尿液、排泄物进一步污染水体及土壤[4-6]。美国FDA、欧盟及我国农业部对青霉素类药物最高残留量有做明确规定,因此确定准确、高效、灵敏度高的检测方法行之必要。目前对PENs进行检测的手段主要有微生物测定法、高效液相色谱法及LC-MS/MS[7-8]检测法。
食品基质中的青霉素药物残留往往处于痕量级,背景干扰复杂,为保障检测结果的准确性需要选择有效的前处理技术。前处理不当,不仅带来基质干扰,甚至影响仪器使用寿命[9]。分子印迹固相萃取(molecularly imprinted solid phase extraction,MISPE)是将具有专一性、高度选择性的的分子印迹聚合物(MIPs)作为萃取填料,能够选择性浓缩痕量待测物,进而提高分离效率和分析准确性。MISPE在固相萃取领域应用前景广阔,已有报道MISPE成功应用于磺胺类药物残留[10]、血清邻苯二甲酸酯残留的检测分析[11]。
本研究将所合成的对具有6-APA母核的青霉素类抗生素均有良好的识别性能的MIPs用作固相萃取填料,提高实验分析效率。用6-APA分子印迹聚合物装填的固相萃取柱成功应用于市售牛乳的预处理,具有一定的实际应用价值。
1实验部分
1.1仪器与试剂
6-氨基青霉烷酸(6-Aminopenicillanic acid,6-APA)、青霉素钾(penicillin G,PEN)、阿莫西林(amoxicillin,AMO)、氨苄青霉素(ampicillin,AMP)、恩诺沙星(enrofloxacin,ENR)均由武汉远成科技有限公司提供(纯度99%);甲酸、N,N-二甲基甲酰胺、丙酮、三氯甲烷、溴化四丁基铵、磷酸二氢钾和硼砂、甲基丙烯酸(methacrylic acid,MAA)、乙二醇二甲基丙烯酸酯(ethylene glycol dimethacrylate,EGDMA)均购自国药集团,分析纯;偶氮二异丁腈(2,2-azobisisobutyronitrile,AIBN),化学纯,使用前用甲醇重结晶;甲醇、乙腈,色谱纯;超纯水。
氮吹仪HGC-24A,江苏金坛市金城国胜实验仪器厂;紫外分光光度计UV-2501PC,日本岛津公司;高效液相色谱仪(配有Waters 600四元泵系统、Waters 2998紫外检测器和Waters 2707自动进样器,美国Waters);P/ACETMMDQ高效毛细管电泳仪(配有二极管阵列检测器、未涂层熔融石英毛细管60 cm×50 μm和色谱工作站,美国Beckman);S-4800扫描电子显微镜,日本Hitachi;Nicolette is50傅里叶红外光谱仪,美国Thermo Scientific。
1.2实验方法
1.2.16-APA MIPs的制备条件优化
精确称取一定量模板分子6-APA于30.0 mL的螺口试管中,加入10.0 mL溶剂溶解,加入一定量功能单体MAA,超声振荡30 min,再加入一定量交联剂EGDMA和引发剂AIBN于室温下超声振荡15 min,充氮除氧后密封,置60 ℃水浴中加热24 h制备印迹聚合物。将所得的白色聚合物研磨粉碎,同时过200目和250目筛,得到200~250之间目数的粉末,备用。用体积比7∶3的乙腈-水溶液洗脱聚合物中的模板分子,再依次用乙腈、去离子水洗脱至中性。收集产物于烘箱60 ℃干燥,得到以6-APA为虚拟模板的分子印迹聚合物(MIPs)。
1.2.2选择性实验
准确称取5份等量20.0 mg分子印迹聚合物放入5个规格相同的5.0 mL离心管中,分别加入2.0 mL浓度为1 mmol/L的同类药物6-APA、AMP、AMO、PEN的水溶液和不同类药物恩诺沙星(ENR)的水溶液,置于恒温摇床中室温下振荡2 h,然后将该混合液离心5 min,取1.0 mL的上清液,用高效毛细管电泳法(high performance capillary electrophoresis,HPCE)测定吸附平衡时溶液中游离底物的浓度,测定3次,取平均值,根据结合前后溶液浓度的变化,计算MIPs与底物的静态吸附分配系数KD。
1.2.3光谱实验和扫描电镜分析
称取一定量的MIPs和NMIPs粉末,用傅立叶红外光谱仪测其红外光谱,以纯的KBr为底样测试,在波数范围4 000~400 cm-1测定,光谱分辨率优于0.09 cm-1,扫描速度:0.158~6.28 cm/s。观察聚合物是否存在可以键合氢键的作用点。
采用S-4800扫描电子显微镜分别观察MIPs和NMIPs粉末的形貌粒径,测试时样品溶解在无水乙醇中,待无水乙醇挥发后,进行电镜测定,采用高真空模式,调整加速电压为5 kV,分辩率达到1.0~1.4 nm。观察粉末的孔穴分布和粒径大小。
1.2.4MISPE小柱的制备及应用
称取150.0 mg MIPs及75.0 mg硅藻土(MIPs∶硅藻土质量比=2∶1)装入3.0 mL空的固相萃取(SPE)柱中,用筛板压紧,轻敲小柱,直至筛板与聚合物结合紧密为止。6-APA MISPE柱先用2.0 mL甲醇活化;再加入5.0 mL正己烷,待正己烷没入柱填料时,取待测样品溶液,以5.0 mL/min的流速过柱;用5.0 mL正己烷淋洗,弃淋洗液;再用6.0 mL甲醇-乙酸(体积比为8∶2)溶液进行洗脱;收集洗脱液,用氮吹仪吹干,复用超纯水溶解,过0.22 μm的微孔滤膜,供HPLC检测。
1.2.5牛乳样品及处理方法
于合肥超市随机购买不同品牌不同批次的牛乳样品。准确量取10.0 mL同一牛乳样品2份,分别采用10.0 mL溴化四丁基铵乙腈溶液提取,漩涡振荡10 min,高速离心后分离上清液。下层残渣再重复提取两次,合并3次上清提取液,提取液用乙腈除蛋白,正己烷振荡萃取去除脂质。水相于50 ℃水浴蒸干后,再用0.5 mol/L KH2PO4溶液使之充分溶解。
将上述处理后的样品分别用制备的6-APA MISPE小柱按照1.2.4净化,待测。
1.2.6高效液相色谱条件
色谱柱:Xterra®MS C18柱(4.6 mm×250 mm);流动相:V(乙腈)∶V(水)=5∶95等度洗脱,流速1.0 mL/min;柱温35 ℃;进样量:10 μL。紫外检测器:检测波长210 nm。
2结果与讨论
2.1MIPs的制备与优化
考察甲酸、乙腈、N,N-二甲基甲酰胺等不同的溶剂体系对6-APA的溶解效果。实验结果表明,6-APA不溶于多数有机溶剂,微溶于水,易溶于甲酸,且遇碱易分解,因此选择甲酸作为致孔剂。
功能单体(MAA)用量对MIPs的合成有显著影响,添加量不足聚合不充分,添加量过高会自缔合形成非特异性结合位点;交联剂(EGDMA)使得聚合物具有刚性的网状空间结构。考察模板分子、功能单体及交联剂不同的比例合成的MIPs的吸附容量差异,实验结果表明,当6-APA∶MAA∶EGDMA=1∶5∶30时效果最佳。非印迹聚合物(NMIPs)的制备过程除不加模板分子,其他步骤与MIPs制备相同。
2.2聚合物的特异吸附性
为考察MIPs对青霉素类药物的吸附特异性,采用静态吸附分配系数KD来表示MIPs对底物的选择性[12]。KD=cs/cB,其中cs(μmol/mL)表示待测底物的起始浓度,cB(μmol/mL )表示吸附平衡后剩余底物在溶液中的浓度,计算结果见表1。

表1 平衡结合条件下MIPs与结合底物的KD值
由表1可见MIPs对于6-APA的KD值明显大于其他药物,其他3种青霉素类药物结构与6-APA越接近,KD值也就越大,说明以6-APA为模板分子合成的MIPs洗脱后所留下立体孔穴的结构形状能与6-APA相匹配,具有一定的识别能力;同时,MIPs对于PENs具有较高吸附容量,结合量明显高于ENR,这是由于ENR的结构与MIP中的立体孔穴相差较大,难以进入孔穴内部与识别位点发生作用。上述实验结果表明,制备的MIPs对PENs的吸附具有特异性。
2.3聚合物的光谱分析分析与形貌表征
2.3.1红外光谱分析
非印迹聚合物NMIPs和印迹聚合物MIPs的红外光谱结果如图1。

图1 NMIPs(a)和MIPs(b)的红外光谱图Fig.1 FTIR spectrum of NMIPs (a) and MIPs (b)

2.3.2扫描电镜分析
非印迹聚合物NMIPs和印迹聚合物MIPs的扫描电镜结果如图2。

图2 NMIPs(a)和MIPs(b)的SEM图Fig.2 SEM micrographs of NMIPs(a) and MIPs(b)
由图2(a)和图2(b)可见,NMIPs 微球表面光滑,平均粒径约为1.5 ~2 μm,分布较为均匀;而MIPs 微球表面粗糙,粒径分布较宽,粗糙的微球表面具有大量的一定孔径的孔穴,因此具有较大的比表面积和孔体积,有利于底物和结合位点的接触,从而有高的负载量和对底物的高识别性。
2.4市售牛奶样品检测
取6个不同品牌的牛奶样品,每个品牌选取3个批次进行检测,分别编号1-1,1-2,1-3,……,6-3。按照1.2.4和1.2.5提取、净化牛奶样品,用HPLC检测,检测结果见表2。结果显示其中2个品牌各有一个批次检出含有AMO,含量分别为0.04 mg/L和0.02 mg/L,符合《动物性食品中兽药最高残留限量》相关规定;某品牌有1个批次的牛乳样品检测出含有6-APA,根据标准曲线定量确定含量分别0.16 mg/L, 液相色谱图见图3;其他品牌牛乳样品6-APA和原药均未检出。6-APA作为青霉素药物中间体,抗菌能力弱,一般不直接应用于禽畜养殖生产中。样品中未检测到青霉素原药,而只检测出6-APA,出现这种结果的原因可能是在牛乳中添加了β内酰胺酶或青霉素酰化酶,这2种酶可以催化青霉素类药物水解成中间体6-APA[13],可进一步通过微生物法对可疑样品中的β内酰胺酶进行检测确定[14-15]。

表2 牛奶样品的检测结果 单位:mg/L
注:ND未检测出。

a-样品编号No.2-3; b-样品编号No.4-2; c-样品编号No.6-1图3 牛奶样品的HPLC图Fig.3 Chromatography of milk samples
2.5加标回收率实验
实验中以0.6、1.2和2.5 mg/L 3个质量浓度水平向空白牛乳样品中添加青霉素类(PENs)混合标准液,按照1.2.5处理样品,每个浓度水平平行测定6次,根据HPLC工作曲线进行定量,计算加标回收率,色谱图见图4。实验结果见表3,4种青霉素类(PENs)药物的平均回收率为83.5%~87.3%,相对标准偏差(RSDs)为1.03%~7.35%;根据S/N=3,计算出方法检出限(limit of detection,LOD)为8.24 ug/L。
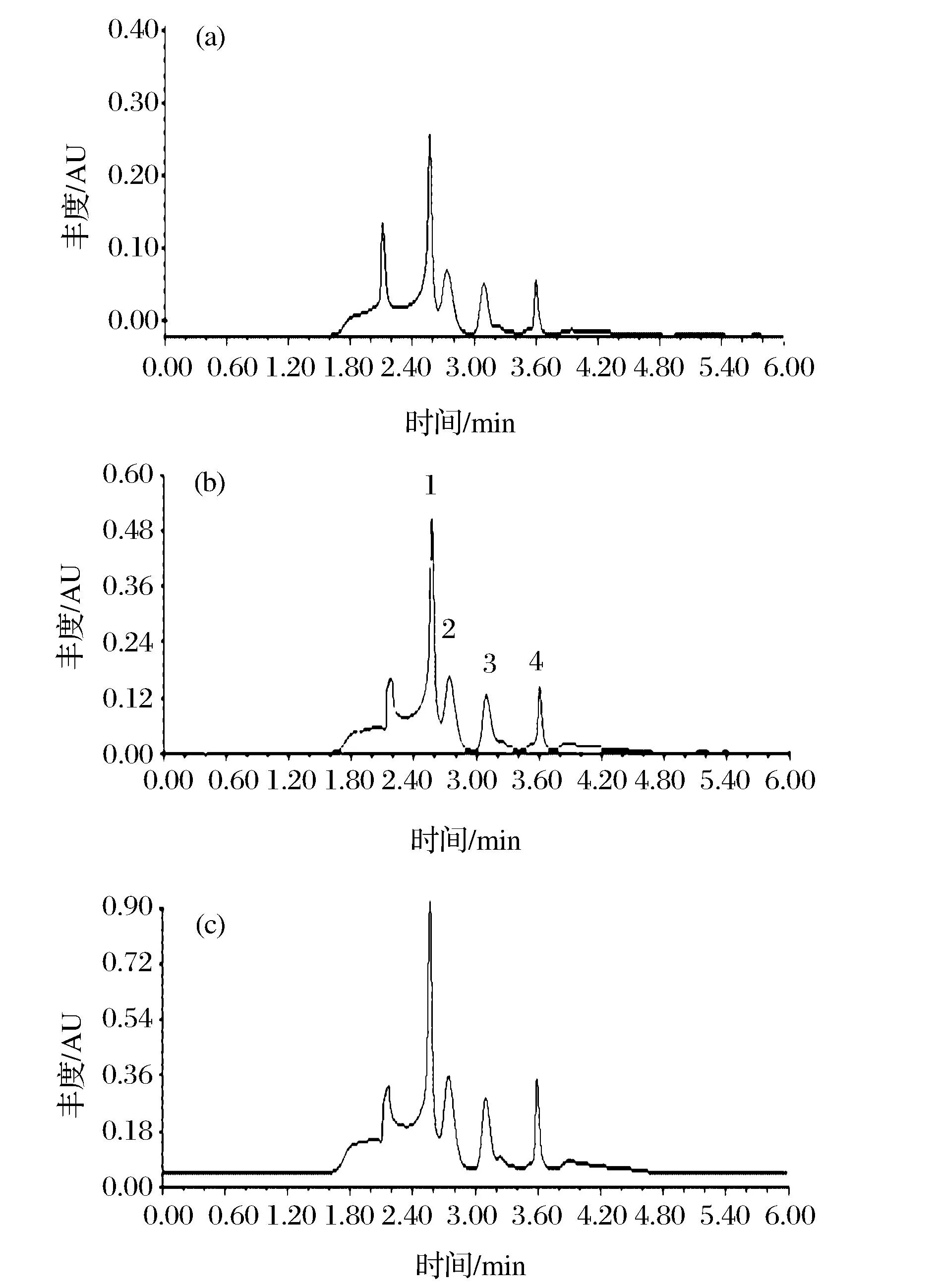
a-加标水平0.6 mg/mL; b-加标水平1.2 mg/mL;c-加标水平2.5 mg/mL图4 加标牛奶样品的液相色谱图Fig.4 Chromatography of a milk sample spiked with PENs at different level

名称添加水平/(mg·L-1)回收率/%相对标准偏差/%6-APA2.587.31.031.287.12.460.686.95.79AMO2.587.11.781.286.62.270.686.07.35AMP2.586.71.661.286.56.900.686.34.05PEN2.584.91.211.284.74.190.683.53.92
3结论
以6-APA为虚拟模板,采用本体聚合法,优化了致孔剂类型、功能单体及交联剂用量、洗脱剂体系,制备出对青霉素类药物具有选择吸附性和较大吸附容量的分子印迹聚合物。
利用该6-APA分子印迹聚合物制作的固相萃取小柱对牛乳样品进行预处理,采用HPLC法对6种市售牛乳中的青霉素药物进行检测,发现部分牛乳样品中AMO有检出,品牌2牛乳样品中有一个批次检测出较高浓度的6-APA。加标回收率实验表明,4种青霉素类药物的回收率均高于80%,满足检测要求;方法检出限(LOD)为8.24 μg/L,符合检测标准。针对市售牛乳制品中可能存在加入β内酰胺酶或青霉素酰化酶,将青霉素类药物水解成较稳定的中间体6-APA的现象,市场监察部门在牛乳青霉素类抗生素的检测中,应加强对中间体6-APA的监控。
参考文献
[1]VALENCIA P,FLORES S,WILSON L,et al. Effect of internal diffusional restrictions on the hydrolysis of penicillin G: reactor performance and specific productivity of 6-APA with immobilized penicillin acylase[J].Applied Biochemistry and Biotechnology,2011,165(2):426-441.
[2]MARTINEZ-HERNANDEZ J L,MATA-GOMEZ M A,AGUILAR-GONZALEZ C N,et al. A process to produce penicillin G acylase by surface-adhesion fermentation using mucor griseocyanus to obtain 6-aminopenicillanic acid by penicillin G hydrolysis[J].Applied Biochemistry and Biotechnology,2010,160(7):2 045-2 053.
[3]黄百芬,任一平,蔡增轩. LC-MS/MS测定牛奶中六种青霉素类抗生素残留[J].中国食品卫生杂志,2007,19(1):31-35.
[4]SUSAN S,MOSLEM J. Solid-phase extraction of florfenicol from meat samples by a newly synthesized surface molecularly imprinted sol-gel polymer[J].Food Anal. Methods,2014,7(10):2 084-2 094.
[5]WANG Xiu-pin,LI Pei-wu. Rapid screening of mycotoxins in liquid milk and milk powder by automated size-exclusion SPE-UPLC-MS/MS and quantification of matrix effects over the whole chromatographic run[J]. Food Chemistry,2015,173:897-904.
[6]李清雪,刘巨波,刘 娟. 水环境中多种磺胺类抗生素残留的HPLC同步检测[J].河北师范大学学报,2013,37(3):270-275.
[7]CHEN Jia-bin,ZHOU Xue-fei,ZHANG Ya-lei,et al. Potential toxicity of sulfanilamide antibiotic:binding of sulfamethazine to human serum albumin[J].Science of the Total Environment,2012,432(16):269-274.
[8]刘创基,王海,杜振霞,等. 超高效液相色谱-串联质谱法同时测定牛肉中青霉素类药物及其代谢产物[J].分析化学研究报告,2011,39(5):617-622.
[9]祝曙华,苏青云.四种固相萃取柱在猪肉四种氟喹诺酮类药物残留检测中的应用比较[J].食品安全质量检测学报,2014,5(2):416-420.
[10]杜碧柏,许 杨,黄运红,等.分子印迹固相萃取一高效液相色谱法测定饲料中磺胺类药物[J].分析化学研究报告,2012,40(12):1 871-1 876.
[11]赖家平,孙 慧,陈芳,等.分子印迹微米微球的合成方法及在固相萃取中的应用研究进展[J].分析测试学报,2012,31(9):1 161-1 169.
[12]尹雅楠,胡小玲,管 萍,等. 双甘氨肽分子印迹聚合物微球的吸附性能研究[J].化学通报,2012,75(1):58-62.
[13]田春秋,檀华蓉,高丽萍,等.高效毛细管电泳法检测牛奶中的青霉素中间体以及3种青霉素类药物[J].色谱,2011,29(11):1 128-1 132.
[14]孟静,王 锐,祝建华. 生鲜牛乳中抗生素检测方法的新问题[J]. 中国乳品工业,2010,38(9):42-44.
[15]崔生辉,李景云,马 越,等.“生鲜牛乳抗生素分解剂”的鉴定与检测[J]. 中国食品卫生杂志,2007,19(2):113-116.
[16]檀华蓉,司雄元,田春秋,等.一种青霉素类抗生素及其中间体的分子印迹聚合物的制备方法与应用:中国,201210475719.1[P].2014-03-26.
Application of 6-APA molecular imprinted solid-phase extraction column in the detection of penicillins in milk
WANG Ping1, SI Xiong-yuan2, TAN Hua-rong2*, XU Hui-min1
1(College of Tea&Food Science and Technology,Anhui Agricultural University,Hefei 230036,China) 2(Biotechnology Center,Anhui Agricultural University,Hefei 230036,China)
ABSTRACTThe homemade 6-APA molecular imprinted solid-phase extraction (MISPE) column was applied in the extraction and separation of penicillins in market milk, largely enhancing the analytical speed. The molecularly imprinted polymers (MIPs) was prepared using 6-aminopenicillanic acid which is the intermediate of penicillins as the virtual template, methylacrylic acid as the functional monomer and ethylene glycol dimethacrylate as the cross-linking monomer. The structure and morphology of molecularly imprinted polymers were characterized by Fourier Transform infrared spectroscopy (FTIR) and Scanning Electron Microscope (SEM). The result of FTIR showed that there was hydrogen bonding sites inside of MIPs. The result of SEM indicated that there were large amounts of holes on the surface of MIPs. The selective adsorption ability of MIPs was detected by specific adsorption experiment, and it illustrated that the MIPs had selectivity for Penicillin drugs. The solid phase extraction (SPE) column packed with MIPs was used for pretreatment of milk sample, coupled with HPLC detection. The results came out that one sample contained high content of 6-APA, without other three PENs. The recovery experiment was conducted at 3 different spiked levels, and the results showed the recovery rate was 83.5%~87.3%. The 6-APA MISPE column also has broad prospects in the detection of complex matrices like animal food, water samples and soil samples.
Key wordsintermediate; virtual template; molecularly imprinted solid-phase extraction; Penicillin antibiotic; milk
收稿日期:2015-08-20,改回日期:2015-10-19
基金项目:安徽省高等学校省级自然科学重点研究项目(No.KT2013A114);安徽农业大学2014学科骨干培训项目(No.2014XKPY-66)
DOI:10.13995/j.cnki.11-1802/ts.201604033
第一作者:硕士研究生(檀华蓉副研究员为通讯作者,E-mail:tan890112@ahau.edu.cn)。

