以氧消耗速率指导的补料培养基优化提升糖化酶发酵水平
张士杨,王泽建,王兴吉,郭美锦,储炬*,庄英萍,张嗣良
1(华东理工大学 生物反应器工程国家重点实验室,上海,200237) 2(山东隆大生物工程有限公司,山东 临沂,276410)
以氧消耗速率指导的补料培养基优化提升糖化酶发酵水平
张士杨1,王泽建1,王兴吉2,郭美锦1,储炬1*,庄英萍1,张嗣良1
1(华东理工大学 生物反应器工程国家重点实验室,上海,200237) 2(山东隆大生物工程有限公司,山东 临沂,276410)
摘要黑曲霉产糖化酶发酵过程数据显示,发酵中后期产酶速率的下降与采集的生理代谢参数氧消耗速率(oxygen uptake rate,OUR)的降低有着重要相关性,OUR的降低与某些营养元素控制的菌体生长和代谢有关。该文利用Design Expert 软件,通过单因素筛选实验、Plackett-Burman设计和中心组合设计对黑曲霉产糖化酶发酵过程中的补料培养基进行优化,确定了流加培养基:棉籽蛋白4.19 g/L,糖蜜9.01 g/L,硫酸铜0.015 g/L,由此明显改变了后期OUR快速下降和产物合成速率降低的问题。50 L反应器中的发酵验证实验表明,添加了优化的补料培养基的糖化酶酶活比未添加的罐批提升了11.35 %以上,可明显提升糖化酶生产效率。
关键词氧消耗速率(OUR);黑曲霉;糖化酶;补料培养基;优化;Plackett-Burman设计;中心组合设计
糖化酶(葡萄糖淀粉酶),又称为γ-淀粉酶或淀粉葡萄糖苷酶,是食品工业中一种需求量很高的商业生物催化剂,近年来已经变成工业酶的第二大市场[1]。随着我国淀粉糖业的快速发展,糖化酶的需求量日益增加,同时随着能源和生产原材料价格的增加,市场竞争力和利润空间越来越小,提高糖化酶的生产能力,降低生产成本,是提升该产业市场竞争力的关键。
众多研究报道显示,初始培养基的优化[2-5]、不同发酵容器的优化、分批培养连续培养的应用[6-8],以及培养条件如含水率、温度、pH、溶氧、搅拌的优化[9-10]等均可以较好地提高糖化酶的生产水平。但在工业生产过程中仍然面临发酵中后期酶增加缓慢,转化率低的普遍现象,在线生理代谢参数及相关性分析的缺乏已成为进一步优化生产控制工艺,提升发酵水平的关键。本文结合糖化酶发酵过程生理代谢参数的采集系统,利用多参数相关分析找到了氧消耗速率(oxygen uptake rate,OUR)控制与产物合成的相关性,并通过单因素筛选实验、Plackett-Burman设计和中心组合设计考察了补料培养基与生理代谢参数的变化,证明了结合统计学方法和生理代谢参数OUR进行补料培养基的优化,进而提高糖化酶在反应器水平上的产量的可行性,为进行下一步相关优化实验提供了理论基础。
1材料与方法
1.1材料
1.1.1菌株
产葡萄糖淀粉酶的黑曲霉菌株AspergillusnigerLDM3,由山东隆大生物工程有限公司提供。
1.1.2培养基
种子培养基(g/L):玉米淀粉80,玉米浆12,豆饼粉8。
发酵培养基(g/L):玉米淀粉200,玉米粉50,豆饼粉12,玉米浆18,KH2PO410,(HN4)2SO42,CaCl20.3。
补料培养基(g/L):1水葡萄糖500,CaCl20.375。
1.2实验方法
1.2.1种子培养
将茄子瓶于34 ℃的恒温培养箱中培养5 d后刮下菌苔接种于装液量为400 mL的2 L摇瓶中,然后放置于34 ℃的摇床间260 r/min培养72 h。之后接种于15 L种子罐中,通过调节转速和通气使溶氧不低于30%,待残糖质量浓度降至50 mg/mL时移种于50 L罐。
1.2.250 L罐培养
本研究采用50 L搅拌式生物反应器(上海国强生化装备有限公司),初始装液量为25 L,接种量为5 L,33 ℃,发酵过程中通过流加氨水控制pH为4.5~4.6。前期通过调节通气和搅拌控制溶氧不低于40%,直至达到最大转速(550 r/min)和最大通气量(5 500 L/min)都无法改变的氧限制阶段。分别通过溶氧电极和pH电极(梅特勒-托利多,瑞士)在线监测溶氧(DO)和pH。当发酵液中残糖浓度降至50 mg/mL时开始补料,并且在之后的发酵过程中控制DE值在35~45 mg/L。当菌体分化结束后(即溶氧回升阶段之后)将一部分发酵液转移至摇瓶中继续培养。
1.2.3摇瓶培养
本研究采用500 mL摇瓶,装液量为40 mL,在接受50 L罐转移的发酵液之后放置于34 ℃的摇床间190 r/min进行培养。
1.3分析方法
菌体浓度(以PMV表示)的测定:取发酵液10 mL于离心管中,4 000 r/min离心10 min后,沉淀物占10 mL发酵液的体积百分比即为菌体浓度。
残糖浓度的测定:按照萨氏法进行测定[11]。
NH2-N浓度测定:按照甲醛氧化法进行测定[12]。
糖化酶酶活的测定:酶活使用淀粉葡萄糖苷酶(AGI)表示。1个AGI单位定义为:在pH 4.3和温度60 ℃条件下每分钟从可溶性淀粉水解生成1 μmol葡萄糖所需的酶量。50 mg糖化酶标品对应大约2 500 AGI。糖化酶酶活量测量:230 μLp-硝基苯基-α-D-吡喃葡萄糖苷(AGIsub)试剂(37 ℃预热5 min)与20 μL发酵上清液混合,37 ℃反应20 min后加100 μL AGIsub试剂,在405 nm下测量混合液体吸光度来定量糖化酶。
尾气测定:发酵过程中的摄氧率(OUR)由过程尾气质谱仪(MAX300-LG,Extrel,USA)测得的氧气含量经软件Biostar计算得到[13]。
1.4实验设计
黑曲霉产糖化酶发酵过程OUR、溶氧及酶活变化曲线如图1。由图1可明显看出,71 h左右溶氧开始回升,OUR亦快速增加,此时菌体开始分化。当OUR达到峰值,溶氧重新回到氧限制阶段后菌体分化结束。结合酶活变化曲线可知,在菌体分化阶段,产酶速率稍有减慢(75~91 h),分化结束后OUR开始下降,产酶速率随之降低,110~130 h期间OUR下降幅度较91~110 h有所减小,产酶速率较前一阶段亦有所增加,130 h后OUR再次急剧下降,产酶速率再次变慢,由此得知中后期产酶速率的下降与OUR有着密切联系。而OUR的降低与某些营养元素控制的菌体生长和代谢有关,后期补料又仅有糖和氯化钙两种,所以本文希望通过优化补料培养基来改变中后期OUR下降的不利状况,进而提高产酶速率。
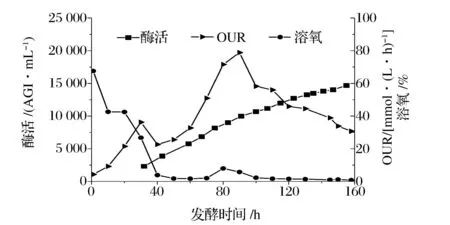
图1 OUR、溶氧和酶活变化曲线图Fig.1 Variation curves of OUR, DO and glucoamylase activity
1.4.1单因素筛选实验
根据文献及先前实验经验总结,共挑选出19个不同因素(棉籽蛋白、甜菜碱、糖蜜、硝酸钠、硫酸铵、硫酸镁、磷酸二氢钾、磷酸二氢钠、氯化锌、硫酸铜、氯化钴、硫酸亚铁、丙氨酸、谷氨酸、甘氨酸、乙酸钠和甘油)进行单因素补料培养基优化实验,其中棉籽蛋白来源于中棉紫光生物科技有限公司,糖蜜来源于沈阳糖蜜科技有限公司。
1.4.2筛选实验设计——Plackett-Burman设计
经单因素筛选实验后,选出8个主要因素应用Design Expert软件(Stat-Ease Inc, Minmeapolis, USA)进行Plackeet-Burman 设计(表1)。对补料培养基优化的8个主要因素进行筛选还需要外加3个虚拟变量,每个变量分别确定(+1)和(-1)两个水平,共进行12次实验。每次实验都重复3次并且将酶活的平均值作为最终结果。Plackeet-Burman实验设计中,因素筛选应用了线性函数,忽略交互作用,一阶线性模型方程式如公式(1):
Y=β0+∑βiXi
(1)
式中:Y为响应值,即酶活差值(酶活差值=摇瓶培养测得酶活-初始离罐测得酶活);β0是模型截距;Xi是考察因素;βi是线性回归系数,反应Xi的影响程度。

表1 Plackett-Burman设计实验中各因素水平
1.4.3优化实验设计——中心复合设计(CCD)
为了确定由Plackeet-Burman筛选出的最主要因素的最优浓度,本文又进行了中心复合设计Central Composite Design(CCD)实验。CCD是一种常用的响应面设计方法,能在进行最少的实验次数来拟合响应面模型。该模型的每个因素通常有5个水平(-1.68, -1, 0, +1,+1.68),如表3。根据Design Expert软件的实验设计,共进行20次实验,并得到一个二阶线性回归方程,如式(2)。
(2)
式中:Y代表响应值(酶活差值);X1、X2和X3代表独立变量;β0代表在中心点的回归系数;β1,β2和β3代表线性系数;β12,β13和β23代表二阶交互作用系数;β11,β22和β33代表二次项系数。
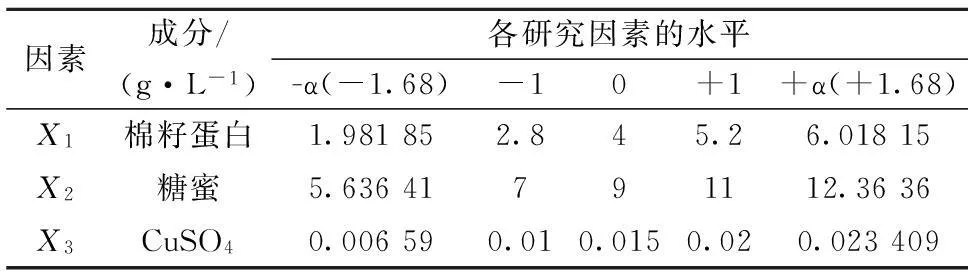
表2 中心组合设计各因素水平
1.4.450 L罐优化实验
将15 L种子罐的种子液各接5 L于2个50 L罐中,保持发酵过程中操作参数的一致性。在补料阶段,一个反应器补入原配方补料,另一反应器除补入原配方补料外,在菌体分化后(96 h)再补入最优补料培养基,分多次补入,观察OUR和酶活的差异变化。
2结果与讨论
2.1单因素筛选实验结果与分析
单因素实验结果如表3。由表3可知,经14 h的摇瓶培养后一部分影响因素对应的酶活得到提升,其中酵母膏和硫酸亚铁两因素提升幅度最大,达到了15%以上。而另一部分影响因素(主要为氮源)对应酶活均有明显下降,但培养35 h后,这部分因素中某些因子对应的酶活提高了近10%,这可能是因为在初始培养阶段,营养元素先用来合成菌体,之后才开始大量合成糖化酶。而培养35 h后各因素对应酶活相对培养14 h后的酶活增长速率,即在14 h后各因素对应酶活在每小时的增量,则表明各因素在14 h后对酶活的贡献大小,对考查各因素在较长时间培养过程中对产酶的影响有较大帮助。综合3组数据,筛选出棉籽蛋白、甜菜碱、糖蜜、硝酸钠、硫酸铵、磷酸二氢钠、硫酸铜和硫酸亚铁8个因素进行下一步的优化实验。

表3 单因素实验设计及结果
注:14 h酶活百分增量和35 h酶活百分增量均以同时段空白为对照。
2.2Plackett-Burman实验设计结果与分析
运用Design Expert软件进行Plackett-Burman设计并进行实验,得到的结果如表4。

表4 Plackett-Burman 实验设计结果
续表4

实验号X1X2X3X4X5X6X7X8X9X10X11酶活差值/(AGI·mL-1)5444441.70.30.01-1-1-13027.9706488841.70.30.03-1112315.4707448483.40.30.0311-1345.4658848843.40.60.03-1-1-1354.2159884443.40.30.031-11447.96510484881.70.60.031-1-12401.72011888441.70.60.01511-12502.97012884883.40.30.015-11-12552.970
注:X1~X11质量浓度单位均为g/L。
利用Design Expert软件对表4中的酶活差值进行计算分析后得到每个影响因素的回归系数及其显著性,如表5。
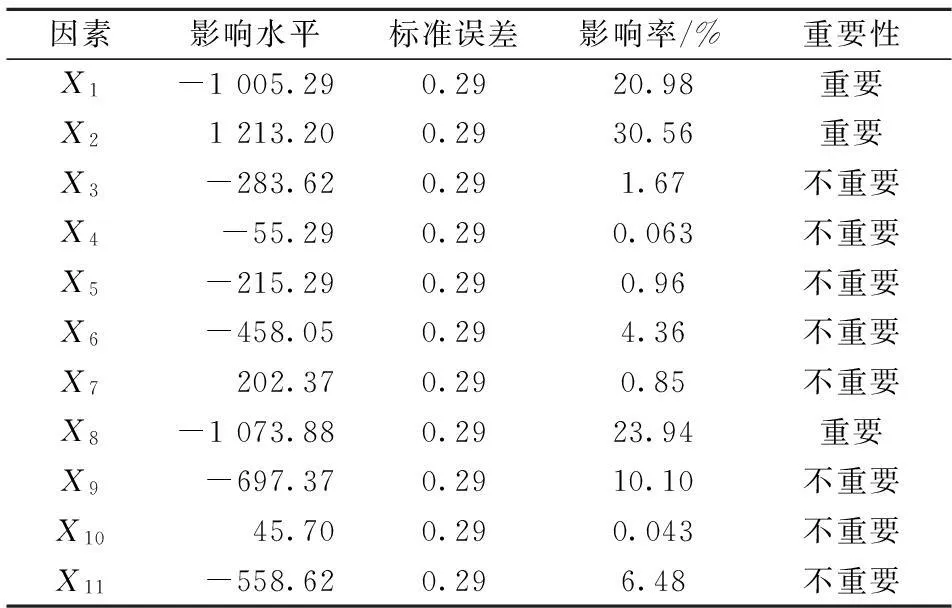
表5 Plackett-Burman实验各因素的效应表
由表5可知,标准误差为0.29,影响水平的值有正有负,正值表示正效应,负值表示负效应。以X1为例,其影响水平为-1 005.29,为负效应,即随着棉籽蛋白浓度的增加,酶活差值呈下降趋势,故在后续的因素优化实验中应减少其浓度。另由表5可明显看出,因素X1、X2及X8的影响率分别为20.98 %、30.56 %和23.94 %,较之其他因素明显增高,所以显著性分析结果为重要,即X1(棉籽蛋白)、X2(糖蜜)及X8(硫酸铜)为主要影响因子。通过影响率的筛选,得到了以酶活差值为响应值的线性回归方程,如式(3)。
Y=2 883.851 67-251.321 46X1+303.300 63X2-71 592.055 56X8
(3)
对线性回归方程进行方差分析的结果如表6,方差分析模型中的Prob>F值为0.008,远小于界定值0.05,这表示所获得的回归方程极其显著,即该模型在此回归区域的拟合性很好,故筛选出的3个因素(棉籽蛋白、糖蜜和硫酸铜)可以进行下一步的响应面优化。

表6 酶活差值回归模型方程的方差分析
2.3CCD优化设计结果与响应面分析
利用Design Expert软件对3个最主要影响因素进行响应面实验后得到的相应结果如表7,对其进行回归分析得到一个二次方程模型,如式(4)。
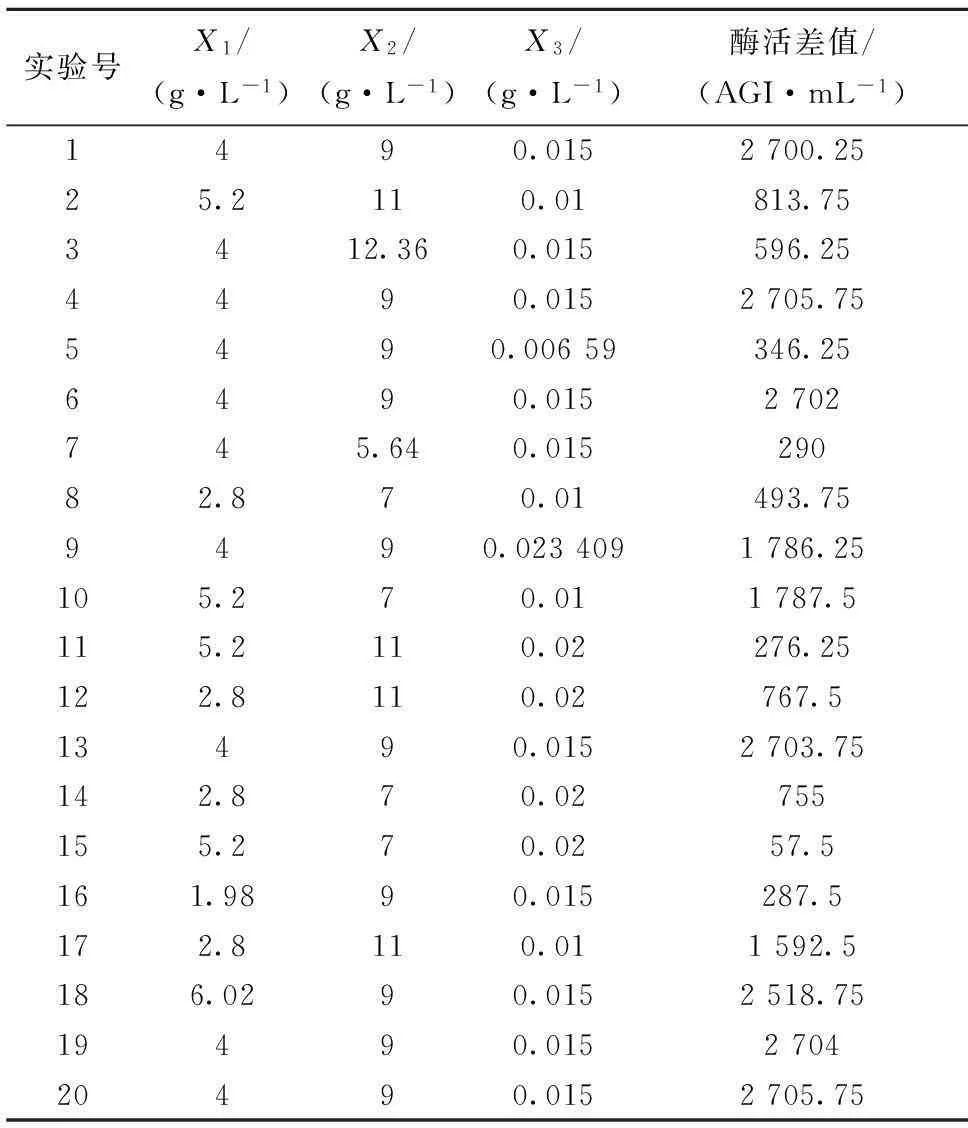
表7 CCD实验设计及结果

(4)
式中:Y表示响应值(酶活差值);X1、X2和X3分别表示棉籽蛋白、糖蜜和硫酸铜的质量浓度,g/L。
对实验结果进行响应面分析,拟合得到的二次模型方差分析如表8。由表8可知,模型的F值为4.04,多元相关系数R2=0.944 1,说明该模型的拟合情况较好。另外,精密度是有效信号与噪声的比值,大于4.0视为合理,本实验的精密度达到5.373,处于合理区。Prob>F值为0.020 1(Prob>F<0.05视为模型显著),表明该模型高度显著,可用来进行响应值预测。
通过Design Expert软件根据二次回归方程来绘制响应面分析图及其等高线(图2),利用该组图可以对影响糖化酶酶活差值的补料培养基中任何两种因素的交互效应进行分析和评价以确定最佳的影响因子浓度范围。
最终由Design expert 软件得到41组(未列出)优化条件,确定最优化(即酶活差值最大)补料培养基配方为:棉籽蛋白4.19 g/L,糖蜜9.01 g/L,硫酸铜0.015 g/L,理论计算酶活差值达到2 730.62 AGI/mL。

表8 二次多项模型及其各项的方差分析

图2 棉籽蛋白、糖蜜和硫酸铜对酶活差值的交互作用的响应面图和等高线图Fig.2 Surface and contour plots of the mutual on glucoamylase activity differenceof cottonseed protein,molasses and CuSO4
2.4验证实验
按照优化后的补料培养基配方:棉籽蛋白4.19 g/L,糖蜜9.01 g/L,硫酸铜0.015 g/L,在菌体分化后,取出一定量发酵液进行最优化补料培养基验证实验,实测酶活差值为2 765.75 AGI/mL,与理论预测值相近,证明了利用PB和CCD方法联用来优化发酵过程的补料培养基的可行性和准确性,同时对于进一步在大罐上的优化提供了一定的研究基础。
2.550 L罐优化实验结果与分析讨论
发酵160 h后得到的残糖、OUR、酶活、PMV、氨水补加量和NH2-N浓度变化曲线如图3所示。
从实验对比结果可以看出,两罐的菌浓(PMV)均在55 %左右,残糖按照工艺要求控制在相同的水平,在发酵过程OUR开始快速下降时进行补料培养基的流加,能够很好地促进菌体的氧消耗速率的维持,与对照罐相比,OUR的快速下降趋势得到了明显遏制。氧消耗速率的增加促进了碳源底物的消耗,用于调节pH的氨水流加量也呈现出高于对照罐的水平,这可能是导致补料后NH2-N浓度略高于对照组的原因。新的补料添加工艺可以明显促进糖化酶合成速率的维持,最终,优化补料罐的酶活达到18 327.5 AGI/mL,比对照罐(16 460 AGI/mL)增加了11.35 %。由此可见,利用Plackett-Burman以及CCD响应面设计进行补料培养基的优化进而提高糖化酶在反应器水平上的产量是可行的。
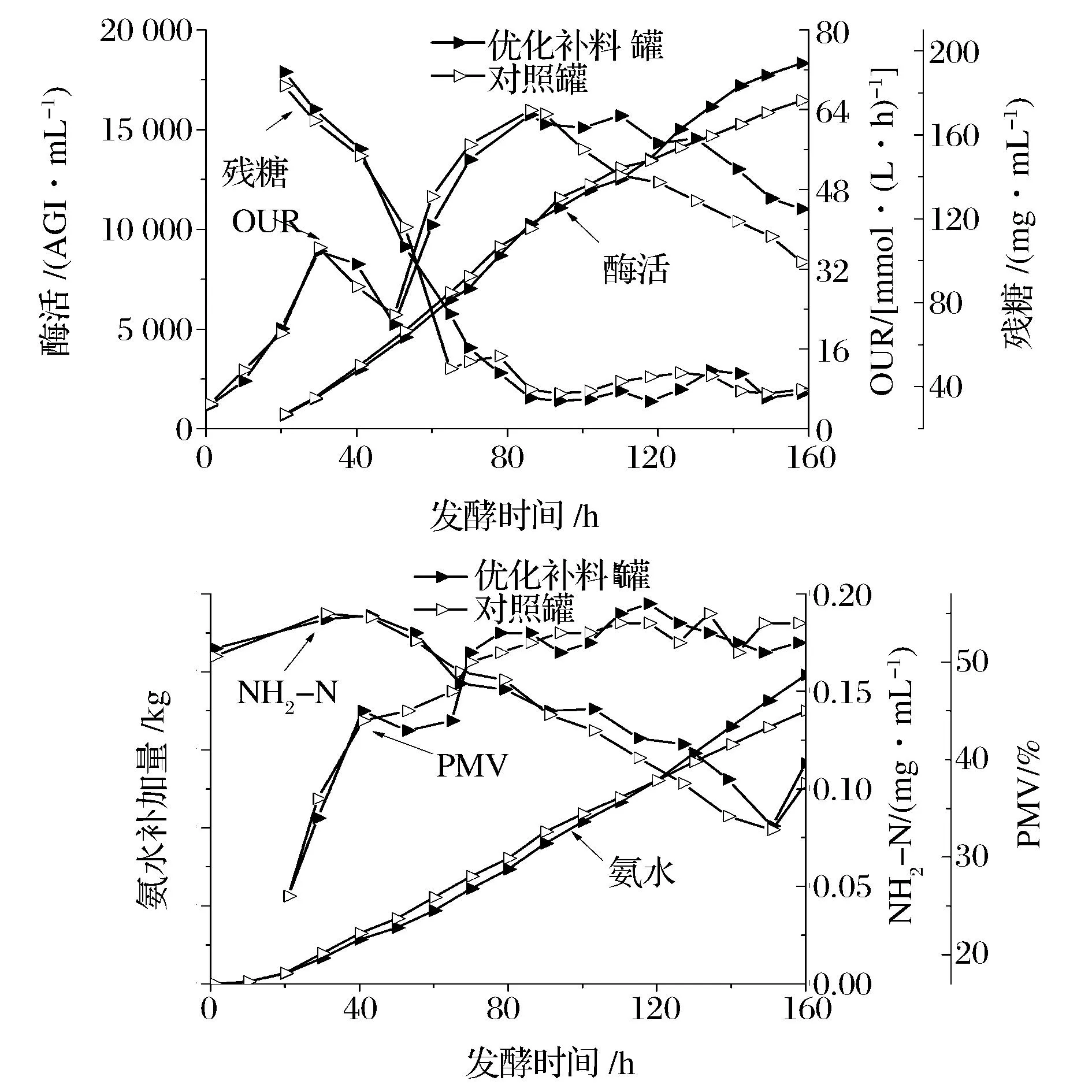
图3 残糖、OUR、酶活、PMV、氨水补加量和NH2-N浓度变化曲线图 Fig.3 Variation curves of residual sugar, OUR, glucoamylase activity, PMV, ammoniaadditive amount and NH2-N concentration
3结论
将OUR与统计学分析方法相结合成功地应用于黑曲霉产糖化酶的发酵优化过程,研究表明:Plackett-Burman设计方法可以从单因素筛选出的众多因素中有效地再次挑选出关键因素;利用CCD设计的响应面分析可以很好地优化关键因素,在得到有效的补料培养基组成后进行发酵罐验证试验,验证结果表明:在发酵95~100 h OUR下降时开始补加优化的补料培养基,能够明显提升菌体的氧消耗速率,促进糖化酶的快速合成,最终糖化酶的产量达到18 327.5 AGI/mL,比对照罐(16 460 AGI/mL)增加了11.35%。
改变补料培养基的配方只是优化的开始,补料流加方式、补料流加时间以及补料流加量等诸多方面的优化还有待进一步考察。本文结合OUR与统计学分析进行优化取得了良好效果,对结合更多的操作参数和生理代谢参数进行多尺度相关分析进一步提升糖化酶的产量具有借鉴意义,并对生产放大有极大的指导作用。
参考文献
[1]KELLY R M,DIJKHUIZEN L,LEEMHUIS H.Starch and α-glucan acting enzymes,modulating their properties by directed evolution[J].Journal of Biotechnology,2009,140(3):184-193.
[2]RAMADAS M,HOLST O,MATTIASSON B.Production of amyloglucosidase byAspergillusnigerunder different cultivation regimens[J].World Journal of Microbiology and Biotechnology,1996,12(3):267-271.
[3]KUMAR S,SATYANARAYANA T.Statistical optimization of a thermostable and neutral glucoamylase production by a thermophilic moldThermomucorindicae-seudaticaein solid-state fermentation[J].World Journal of Microbiology and Biotechnology,2004,20(9):895-902.
[4]KUMAR S,KUMAR P,SATYANARAYANA T.Production of raw starch-saccharifying thermostable and neutral glucoamylase by the thermophilic moldThermomucorindicaeseudaticaein submerged fermentation[J].Applied Biochemistry and Biotechnology,2007,142(3):221-230.
[5]SHOJI H,SUGIMOTO T,HOSOI K,et al.Simultaneous production of glucoamylase and acid-stable α-amylase using novel submerged culture ofAspergilluskawachiiNBRC4308[J].Journal of Bioscience and Bioengineering,2007,103(2):203-205.
[6]PEDERSEN H,BEYER M,NIELSEN J.Glucoamylase production in batch,chemostat and fed-batch cultivations by an industrial strain ofAspergillusniger[J].Applied Microbiology and Biotechnology,2000,53(3):272-277.
[7]MERICO A,CAPITANIO D,VIGENTINI I,et al.How physiological and cultural conditions influence heterologous protein production inKluyveromyceslactis[J].Journal of Biotechnology,2004,109(1):139-146.
[8]GANZLIN M,RINAS U.In-depth analysis of theAspergillusnigerglucoamylase (glaA) promoter performance using high-throughput screening and controlled bioreactor cultivation techniques[J].Journal of Biotechnology,2008,135(3):266-271.
[9]ELLAIAH P,ADINARAYANA K,BHAVANI Y,et al.Optimization of process parameters for glucoamylase production under solid state fermentation by a newly isolatedAspergillusspecies[J].Process Biochemistry,2002,38(4):615-620.
[10]BHATTI H N,RASHID M H,NAWAZ R, et al.Optimization of media for enhanced glucoamylase production in solid-state fermentation byFusariumsolani[J].Food Technology and Biotechnology,2007,45(1):51-56.
[11]大连轻工业学院,等.食品分析[M].北京:中国轻工业出版社,1994.
[12]KOTEVA K P,CANTIN A M,NEUGEBAUER W A,et al.Synthesis and evaluation of novel B-lactam inhibitors of human leukocyte elastase[J].Can J Chem,2001,79(4):377-387.
[13]谌颉,储炬,庄英萍,等.质谱仪在 avermectin 发酵过程中的应用[J].中国抗生素杂志,2004,29(1):4-7.
Optimization of fed-batch culture for enhanced production of glucoamylase with the application of oxygen uptake rate (OUR)
ZHANG Shi-yang1, WANG Ze-jian1, WANG Xing-ji2,GUO Mei-jin1, CHU Ju1*, ZHUANG Ying-ping1, ZHANG Si-liang1
1(State Key Laboratory of Bioreactor Engineering,East China University of Science and Technology,Shanghai 200237, China) 2(Shandong Longda Biological Engineering Co.Ltd,Shandong Province,Linyi 276410, China)
ABSTRACTAccording to the process data of glucoamylase fermentation by Aspergillus niger, the decrease of enzyme production rate in the middle and later periods was related to the decline of OUR influenced by cell growth and metabolism. Therefore, in this paper, the fed-batch culture was optimized through single factor screening experiments, Plackett-Burman design and central composite design with Design Expert software. The optimum feeding medium contained cottonseed protein 4.19 g/L, molasses 9.01 g/L, and CuSO4 0.015 g/L. Then the problem on enzyme production rate decreasing was significantly rescued by using the optimized culture. After the confirmatory experiments in 50 L fermentor, we found that the glucoamylase activity was enhanced by 11.35% with the addition of optimized medium.
Key wordsoxygen uptake rate; Aspergillus niger; glucomylase; fed-batch culture; optimization; Plackett-Burman design; central composite design
收稿日期:2015-10-03,改回日期:2015-11-26
基金项目:中荷国际合作项目(No. 2013DFG32630)
DOI:10.13995/j.cnki.11-1802/ts.201604004
第一作者:硕士研究生(储炬教授为通讯作者,E-mail: juchu@ecust.edu.cn)。
——全棉籽的加工与利用

