budR表达水平对克雷伯氏菌甘油代谢的影响
陆信曜,季广建,宗红,诸葛斌,2*
1(江南大学 工业生物技术教育部重点实验室,工业微生物研究中心,江苏 无锡,214122) 2(江南大学 糖化学与生物技术教育部重点实验室,江苏 无锡,214122)
budR表达水平对克雷伯氏菌甘油代谢的影响
陆信曜1,季广建1,宗红1,诸葛斌1,2*
1(江南大学 工业生物技术教育部重点实验室,工业微生物研究中心,江苏 无锡,214122) 2(江南大学 糖化学与生物技术教育部重点实验室,江苏 无锡,214122)
摘要通过过量表达和反义RNA抑制改变budR表达水平,考察budR表达水平对克雷伯氏菌甘油代谢的影响。过表达budR使得BudB和BudC的酶活提高了48.7%和69.7%,1,3-丙二醇产量降低了12.6%,2,3-丁二醇含量增加了73.3%,同时乙酸含量显著降低。反义RNA抑制budR表达后,BudB和BudC酶活分别降低了56%和78%,重组菌的生物量、2,3-丁二醇(BDO)、乙酸、乳酸等均表现为略有降低,1,3-丙二醇含量达到23.4 g/L,提高约10%。上述结果进一步丰富了budR基因在调控bud操纵子的表达水平、2,3-丁二醇合成及克雷伯氏菌甘油代谢中的作用,为后续代谢改造克雷伯氏菌合成1,3-丙二醇提供了新的思路。
关键词budR;克雷伯氏菌;甘油代谢;1,3-丙二醇;2,3-丁二醇
1,3-丙二醇(1,3-propanediol,PDO)是一种重要的三碳平台化合物,广泛应用于医药、化妆品等领域,尤其是作为合成新型聚酯纤维聚对苯二甲酸丙二醇酯(polytrimethylene terephthalate,PTT)的前体[1]。在已报道的PDO合成菌株中,克雷伯氏菌(Klebsiellapneumoniae)能够利用甘油高效生产PDO。在克雷伯氏菌中,甘油通过甘油脱水酶和1,3-丙二醇氧化还原酶消耗NADH生成PDO。另一方面,甘油同时被氧化为丙酮酸并继而产生乙醇、乳酸、乙酸、2,3-丁二醇(2,3-butanediol,BDO)等副产物,与PDO合成途径竞争碳流和还原力。
在这些副产物中,BDO的沸点与PDO相似,同时其在发酵液中的含量较高,极大地增加了下游分离提取成本,限制了发酵法生产PDO的工业化[2]。因此,降低BDO含量对生物合成PDO的工业化具有重要意义。在克雷伯氏菌中,bud操纵子编码了BDO合成相关基因,其中包括:α-乙酰乳酸合成酶(BudB),α-乙酰乳酸脱羧酶(BudA),2,3-丁二醇脱氢酶(BudC)及转录调节因子BudR[3-4](图1)。为了从基因水平上研究影响克雷伯氏菌BDO合成的因素,本文通过过量表达和反义RNA抑制改变胞内budR表达水平,考察其对克雷伯氏菌甘油代谢的影响。
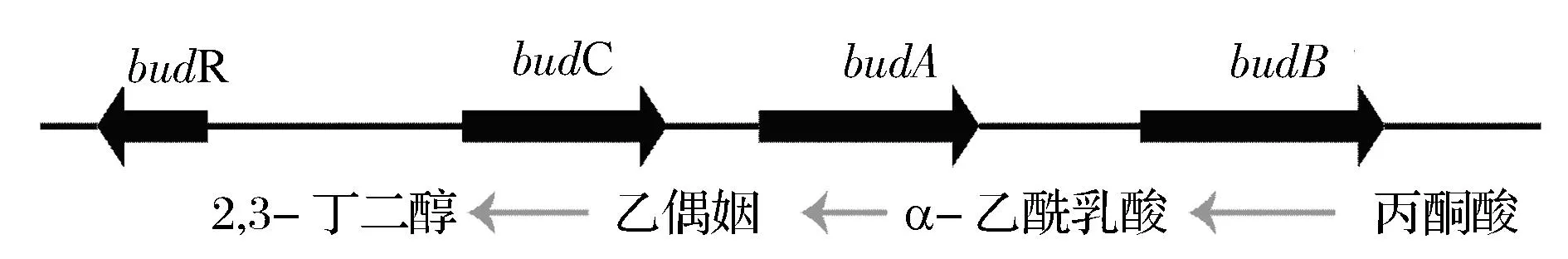
图1 克雷伯氏菌bud操纵子Fig.1 The bud operon of K. pneumoniae
1材料与方法
1.1材料与试剂
表达质粒pEtac、反义RNA表达载体pETR,KlebsiellapneumoniaeZG25由本研究室构建或选育并保存。硫酸卡那霉素(Kan)、异丙基-β-D-硫代半乳糖苷(IPTG)均购自生工生物工程公司。
1.2方法
1.2.1培养基及培养方法
LB培养基用于EscherichiacoliJM109和种子液培养。
发酵培养基(g/L):甘油 40,酵母膏 5,1水葡萄糖 6,KH2PO47.5,MgSO42,(NH4)2SO42,FeSO4·7H2O 0.005,维生素B120.015,微量元素溶液 10 mL。微量元素溶液(g/L):ZnCl20.07,MnCl2·4H2O 0.1,H3BO30.06,CoCl2·6H2O 0.2,CuCl20.02,NiCl2·6H2O 0.025,Na2MoO4·2H2O 0.035。根据需要加入Kan (终质量浓度100 μg/L)、IPTG (终浓度0.5 mmol/L)。
种子培养:50 mL的三角瓶装液10 mL,接种量1%(V/V),37 ℃下150 r/min培养6~7 h。发酵培养:250 mL的三角瓶装液50 mL,接种量4%(V/V),37 ℃下100 r/min培养。
1.2.2基因克隆与质粒构建
1.2.2.1pEtac-budR质粒的构建
根据K.pneumoniae342 (GenBank No: CP000964.1)基因组序列设计budR引物R1 (GAA GCG GGA GAG TCG TTC T)和R2 (ATT TGC GGA TGG AAA GCA T),PCR得到budR片段后克隆至质粒pEtac,得到质粒pEtac-budR并转化K.pneumoniaeZG25,得到K.pneumoniaeZG25(pEtac-budR)。同时将质粒pEtac转入K.pneumoniaeZG25,得到对照菌株K.pneumoniaeZG25(pEtac)。
1.2.2.2pETRH-budR质粒的构建
设计与budR基因RBS位点附近序列互补的反义DNA引物RB1 (CCG GAA TTC ATG GAA CTT CGT TAT CTT C)和RB2(ATA GAG CTC TCA GAA CAT CGC CAG AAA G),PCR得到的片段克隆至质粒pETRH,得到质粒pETRH-budR并转化K.pneumoniaeZG25,得到K.pneumoniaeZG25(pETRH-budR)。
1.2.3分析测定
菌体生物量用600 nm下的吸光值表示。发酵产物利用高效液相色谱 (high performance liquid chromatography,HPLC) 测定,Amines HPX-87H (Bio-Rad) (300 mm×7.8 mm,9 μm),60 ℃,流动相为5 mmol/L H2SO4,流速为0.6 mL/min,使用示差折光及紫外检测器。
SDS-PAGE采用5%浓缩胶和12%分离胶的垂直平板电泳,利用考马斯亮蓝R-250染色。
α-乙酰乳酸合成酶酶活(BudB):1 min将丙酮酸脱酸获得1 μmol乙偶姻的酶量定义为单位酶活,检测方法及步骤参照文献[5]。
2,3-丁二醇脱氢酶酶活(BudC):1 min生成1 μmol NADH酶量定义为单位酶活,检测方法及步骤参照文献[6]。
2结果与分析
2.1budR过表达对克雷伯氏菌甘油代谢的影响
如图2A所示,克隆得到的budR大小与预期相符、测序结果与数据库中序列比对一致。将其连接至pEtac载体,得到重组质粒pEtac-budR(图2B)。将重组质粒pEtac-budR转化克雷伯氏野生菌得到K.pneumoniaeZG25(pEtac-budR)。SDS-PAGE电泳显示,与对照菌K.pneumoniaeZG25(pEtac)相比,K.pneumoniaeZG25(pEtac-budR)成功实现了budR的胞内重组表达(图2C)。重组菌胞内酶活检测结果(表1)显示,过表达budR使得BudC的酶活提高了69.7%,BudB的酶活提高了48.7%(由于BudA底物α-乙酰乳酸不稳定、难以获得标准品,本文未测定其酶活)。上述结果表明,过表达budR能够显著提高BudB和BudC的酶活。

1-budR基因的PCR产物;M1-DNA marker;M2-标准分子量蛋白质marker;2-K. pneumoniae ZG25(pEtac-budR)胞内可溶蛋白; 3-K. pneumoniae ZG25(pEtac)胞内可溶蛋白图2 budR基因的PCR产物(A),质粒pEtac-budR图谱(B)及budR在克雷伯氏菌中表达的SDS-PAGE电泳分析(C)Fig.2 PCR product of budR gene (A), plasmid map of pEtac-budR (B), and SDS-PAGE analysis of the expression of budR (C)

菌体K.pneumoniaeZG25(pEtac)K.pneumoniaeZG25(pEtac-budR)K.pneumoniaeZG25(pETRH-budR)BudC/[U·mg-1(protein)]46.879.410.3BudB/[U·mg-1(protein)]11.917.75.22
如图3A所示,budR过表达使得重组菌的生物量提高了约20%,表明budR对克雷伯氏菌生长有明显的正调控作用。2株菌的PDO和BDO积累趋势相似,重组菌K.pneumoniaeZG25(pEtac-budR)的PDO产量降低了12.6%,而BDO含量则增加了73.3% (图3B)。这些结果表明,budR的过表达激活了BDO合成相关代谢酶活性,使得碳流向BDO途径偏转,与PDO途径竞争碳流和还原力,造成PDO产量降低。由于BDO具有抑制有机酸合成、稳定pH的作用,BDO含量的增加导致乙酸产量显著降低(图3C),同时有机酸积累量的减少也能够进一步促进细胞的生长。其他副产物含量均较少。
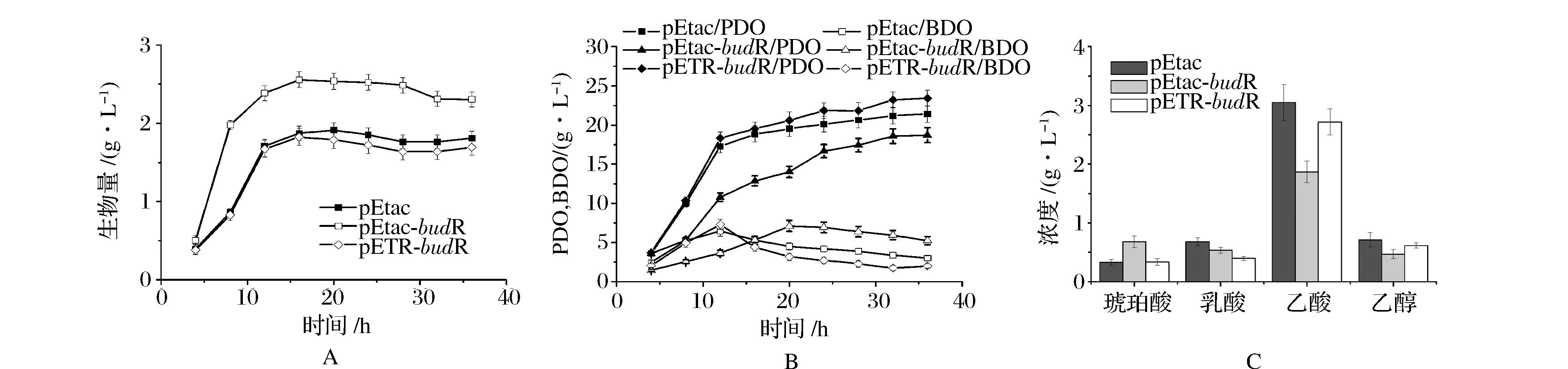
图3 重组菌K. pneumoniae ZG25(pEtac)、K. pneumoniae ZG25(pEtac-budR)和K. pneumoniae ZG25(pETR-budR)的发酵过程中的生物量(A)、主产物(B)和副产物(C)Fig.3 Time course of the fermentation of biomass (A), products (B) and byproducts (C) of the recombinants
2.2反义RNA抑制budR表达对克雷伯氏菌甘油代谢的影响
通常情况下,敲除是研究基因功能的重要手段。但由于bud操纵子可能参与了支链氨基酸的合成,因此敲除其中基因可能会对细胞生长有重要影响[7]。反义RNA技术能够在保留目的基因的前体下显著降低其表达水平[8]。本小节利用反义RNA抑制budR基因的表达。
已有报道根据起始密码子附近序列设计的反义RNA具有较好效果[9],据此设计引物克隆得到budR基因的反义DNA,扩增得到的反义DNA克隆至带有发夹结构[10]的反义RNA转录载体pETR,得到重组质粒pETR-budR(图4),将重组质粒pEtac-budR转化克雷伯氏野生菌得到K.pneumoniaeZG25(pETR-budR)。重组菌胞内酶活检测结果(表1)显示,重组菌K.pneumoniaeZG25(pETR-budR)中反义RNA诱导转录后,BudC酶活降低了78%,BudB酶活降低了56%,表明budB、budC的表达受到显著抑制。

M-DNA marker;1- PCR得到的budR反义DNA片段图4 budR反义DNA的克隆(A)和质粒pETR-budR图谱(B)Fig.4 PCR product of antisense budR (A) and plasmid map of pETR-budR (B)
如图3A所示,反义RNA抑制budR表达后,重组菌的生物量略有降低。虽然BudB和BudC的酶活下降严重,但重组菌K.pneumoniae(pETR-budR)的BDO含量降低并不明显(图3B)。事实上,已有文献报道克雷伯氏菌中可能存在其他负责BDO合成的酶[11],从而表现为抑制BudB和BudC活性未能显著弱化BDO合成。由于BDO的合成未受到严重的抑制,所以乙酸积累仅降低了约10%。相比之下,反义RNA抑制budR表达后,重组菌的生物量、BDO、乙酸、乳酸等均表现为稍有降低,从而在一定程度上为PDO提供了碳流和还原力,使得重组菌K.pneumoniae(pETR-budR)的PDO的产量达到23.4 g/L,提高约10%。
3结论
本文通过过量表达和反义RNA抑制budR,改变其表达水平,考察budR对克雷伯氏菌甘油代谢的影响。结果表明budR表达水平和BudB及BudC酶活之间具有正相关性。同时,budR表达水平的上调对BDO合成及克雷伯氏菌甘油代谢具有明显的影响,但budR表达水平的下调对甘油代谢的影响有限。上述结果进一步丰富了budR基因在调控bud操纵子的表达水平、BDO合成及克雷伯氏菌甘油代谢中的作用,为后续代谢改造克雷伯氏菌合成PDO提供新的思路。
参考文献
[1]KURIAN J V.A new polymer platform for the future-Sorona (R) from corn derived 1,3-propanediol[J].Journal of Polymers and the Environment,2005,13(2):159-167.
[2]XIU Zhi-long,ZENG An-ping.Present state and perspective of downstream processing of biologically produced 1,3-propanediol and 2,3-butanediol[J].Applied Microbiology and Biotechnology,2008,78(6):917-926.
[3]BLOMQVIST K,NIKKOLA M,LEHTOVAARA P,et al.Characterization of the genes of the 2,3-butanediol operons fromKlebsiellaterrigenaandEnterobacteraerogenes[J].Journal of Bacteriology,1993,175(5):1 392-1 404.
[4]WOOD B E,YOMANO L P,YORK S W,et al.Development of industrial-medium-required elimination of the 2,3-butanediol fermentation pathway to maintain ethanol yield in an ethanologenic strain ofKlebsiellaoxytoca[J].Biotechnology Progress,2005,21(5):1 366-1 372.
[5]CAVIN J F,DARTOIS V,LABARRE C,et al.Cloning of branched chain amino acid biosynthesis genes and assays of alpha-acetolactate synthase activities inLeuconostocmesenteroidessubsp.cremoris[J].Research in Microbiology,1999,150(3):189-198.
[7]MAYER D,SCHLENSOG V,BOCK A.Identification of the transcriptional activator controlling the butanediol fermentation pathway inKlebsiellaterrigena[J].Journal of Bacteriology,1995,177(18):5 261-5 269.
[8]NA D,YOO S M,CHUNG H,et al.Metabolic engineering ofEscherichiacoliusing synthetic small regulatory RNAs[J].Nature Biotechnology,2013,31(2):170-174.
[9]WU Jun-jun,YU O,DU Guo-cheng,et al.Fine-tuning of the fatty acid pathway by synthetic antisense RNA for enhanced (2S)-naringenin production fromL-tyrosine inEscherichiacoli[J].Applied and Environmental Microbiology,2014,80(23):7 283-7 292.
[10]NOBUTAKA N,TOMOHIRO T.Conditional gene silencing of multiple genes with antisense RNAs and generation of a mutator strain ofEscherichiacoli[J].Nucleic Acids Res,2009,37(15):e103.
[11]YU W,FEI T,PING X.Glycerol dehydrogenase plays a dual role in glycerol metabolism and 2,3-butanediol formation inKlebsiellapneumoniae[J].Journal of Biological Chemistry,2014,289(9):6 080-6 090.
Influence of expression level ofbudR on glycerol metabolism ofKlebsiellapeneumoniae
LU Xin-yao1, JI Gang-jian1, ZONG Hong1, ZHUGE Bin1,2*
1(Key Laboratory of Industrial Biotechnology, Ministry of Education, Research Centre of Industrial Microbiology, Jiangnan University, Wuxi 214122, China) 2(Carbohydrate Chemistry and Biotechnology, Ministry of Education, Jiangnan University, Wuxi 214122, China)
ABSTRACTIn this study, the expression level of budR was enhanced and repressed by overexpression and synthetic antisense RNA, respectively. The BudB and BudC activities were increased by 48.7% and 69.7%, respectively, by overexpression of budR. The titer of 1,3-propanediol was reduced by 12.6%. The concentration of 2,3-butanediol was increased by 73.3%. Meanwhile, the concentration of acetate was significantly increased. The BudB and BudC activities were repressed by 56% and 78%, respectively, after introduction of antisense RNA of budR. The 1,3-propanediol titer reached 23.4 g/L with the improvement by 10%. However, there were no significant changes of the concentrations of 2,3-butanediol and other byproducts after the introduction of the antisense RNA of budR. The results reported here provided new information about the effect of budR on the regulation of bud operon, 2,3-butanediol synthesis and glycerol metabolism of Klebsiella peneumoniae.
Key wordsbudR; Klebsiella peneumoniae; glycerol metabolism; 1,3-propanediol; 2,3-butanediol
收稿日期:2015-10-22,改回日期:2015-12-22
基金项目:863计划(2012AA021201)
DOI:10.13995/j.cnki.11-1802/ts.201604005
第一作者:博士,讲师(诸葛斌教授为通讯作者,E-mail:bzhuge@163.com)。

