高产洛伐他汀红曲霉氮离子束诱变育种
李阔阔,王钰,2*,万田,庄晓晓
1(安徽大学 资源与环境工程学院,安徽 合肥,230601) 2(安徽省中药材产业技术研发中心,安徽 合肥,230601)
高产洛伐他汀红曲霉氮离子束诱变育种
李阔阔1,王钰1,2*,万田1,庄晓晓1
1(安徽大学 资源与环境工程学院,安徽 合肥,230601) 2(安徽省中药材产业技术研发中心,安徽 合肥,230601)
摘要为了提高洛伐他汀产量,以红曲霉M14为出发菌株进行N+束诱变。诱变剂量分别为:78×1013、130×1013、182×1013、234×1013N+/cm2,通过高效液相色谱检测诱变菌株发酵产物中洛伐他汀的含量,筛选正突变菌株。结果显示,诱变剂量为130×1013N+/cm2时表现出相对较高的正突变率。最优诱变菌株M50-2洛伐他汀产量4.42 mg/g,相对于出发菌株提高70%。对其进行12次传代培养,发现产洛伐他汀的能力下降了2.3%,表现为良好的遗传稳定性,该菌株具有潜在的应用价值。
关键词红曲霉;洛伐他汀;氮离子束;诱变
红曲菌(Monascus)是一种丝状腐生真菌,属于子囊菌纲(Aseomyeetes),红曲菌科(Monascaceae)[1],能够产生红曲色素[2-3]、洛伐他汀[4-5]等次生代谢产物。其中洛伐他汀是1979年ENDO从红曲霉(Monascusruber)发酵培养液中分离出的一种物质,它在体内竞争性抑制胆固醇合成限速酶 (HMG-CoA)还原活性,阻断内源性胆固醇合成[6-10],从而有效治疗因血液中高胆固醇而引起的动脉硬化和冠心病等疾病。随着人类生活水平的提高,各种心脑血管疾病的患者越来越多,因此提高红曲霉洛伐他汀产量至关重要。前人分别从优化发酵条件[6,8,10]和对菌种进行物理化学诱变改良内在的遗传物质来提高产量。李滔滔[11]对红曲菌进行诱变,获得突变菌株液态发酵洛伐他汀产量达38.86 mg/L;游玟娟[12]利用紫外线和硫酸二乙酯复合诱变处理,红曲霉菌株的洛伐他汀产量提高了82.9%。
离子束微生物诱变育种是利用离子束注入微生物细胞内,引起微生物体内某些物质如(DNA或染色体等)发生变化,再通过人工定向选育得到新品种。利用离子束改良微生物菌种已在生产实践中得到应用并取得了明显效益[13],LI14]利用重离子束对土曲霉进行诱变获得高产洛伐他汀的菌株A.terreusZ15-7。N+束诱变作为一种诱变育种的方式应用于红曲霉研究相对较少,其中秦红霞[15]等利用N+束诱变红曲霉,筛选高产红曲色素相比原菌株产量提高了121%。
本研究以N+束的方式对红曲霉进行处理,探寻离子束对红曲霉产洛伐他汀的诱变效应并筛选最佳诱变菌株,为功能性红曲的诱变研究提供依据。
1材料与方法
1.1材料
1.1.1菌种
红曲霉M14,于4 ℃冰箱中保存。
1.1.2主要试剂和仪器
洛伐他汀标准品,中国药品生物制品检定所;链霉素,北京博奥拓达科技有限公司;脱氧胆酸钠盐,生工生物;其他化学试剂均为分析纯。高效液相色谱仪,Waters;恒温恒湿箱,宁波江南仪器厂;水浴锅,上海医疗器械五厂;SCQ-2201超声波清洗机,中国声彦超生设备公司;电热鼓风干燥箱,上海博讯实业有限公司。
1.1.3培养基
察氏培养基(g/L):葡萄糖30,NaNO33,酵母提取物5,K2HPO41, KCl 0.5 ,FeSO4· H2O 0.5,琼脂15,pH 5。麦芽提取物培养基(g/L):麦芽提取物20,蛋白胨10,葡萄糖20,琼脂15。种子培养基(g/L):葡萄糖100,蛋白胨10, KNO32, NH4H2PO42, MgSO4·7H2O 0.5, CaCl20.1, pH 6。固态发酵培养基: 甘油0.2%(ρ),蛋氨酸0.14%(ω),NaNO30.01% (ω),大米作为基质。
1.2实验方法
1.2.1洛伐他汀测定
液相色谱条件:色谱柱Agilent 5 TC-C18(2)(250 mm×4.6 mm,5 μm);检测波长238 nm,流速1.0 mL/min;梯度洗脱流动相比例:乙腈∶0.1%磷酸缓冲液(0~6 min,60∶40;6~24 min,60~95∶40~5;26~30 min,95~60∶5~40)进样量10 μL,柱温保持在35 ℃。
标准曲线:称取25 mg标准品溶解于25 mL乙腈溶液中,配制成1 mg/mL溶液。分别吸取2、4、6、8 mL溶液于10 mL容量瓶中,配制成质量浓度为0.2、0.4、0.6、0.8、1.0 mg/mL的标准液。标准曲线y=3×107x+191 972 (R2=0.999 7)。 其中,x代表质量浓度,mg/g;y代表峰面积。
提取方法:红曲米于60 ℃烘干至恒重,磨碎过100目筛。称取0.5 g于10 mL管中,加入10 mL乙酸乙酯70 ℃水浴2 h,8 000 r/min离心5 min。取上清液并烘干,加入5 mL乙腈溶解后用0.22 μm有机微孔滤膜过滤。
1.2.2红曲霉N+束诱变
将红曲菌接种于察氏培养基上,30 ℃培养7 d。用无菌水冲洗并收集孢子液于150 mL锥形瓶中,加入无菌玻璃珠于摇床160 r/min培养24 h,孢子浓度稀释到108个/mL,0.7 mL悬液涂布于培养皿中。N+束能量为15 keV,诱变剂量为78 × 1013、130×1013、182×1013、234×1013N+/cm2。诱变孢子用1 mL无菌水洗脱,吸取0.2 mL孢子悬液涂抹均匀于含有链霉素和脱氧胆酸钠盐的察氏培养基平板中,30 ℃培养箱中培养。
1.2.3高产洛伐他汀菌株筛选
根据5%(ρ)量接种于固态发酵培养基中,30 ℃条件下发酵16 d。检测发酵产物中洛伐他汀含量。对高产菌株进行传代培养并检测1,3,6,9,12代洛伐他汀产量,分析遗传稳定性。
1.2.4红曲色价测定方法
准确称取0.1 g样品于试管中,加入10 mL 70%的乙醇,60 ℃水浴1 h,6 000 r/min离心5 min。取出0.2 mL上清液,加入3.8 mL 70%乙醇稀释摇匀。将稀释液加入比色皿中,以70%乙醇做对照,在505 nm波长下测定吸光度A。色价按公式(1)计算:
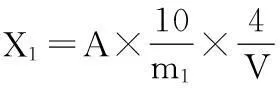
(1)
式中:X1为试样的色价,U/g;A为浸泡稀释液的吸光度;m1为样品质量,g;V吸取上清液的体积,mL。
1.2.5数据处理
实验数据用Excel 2013和SPSS 19软件进行整理和统计分析。
2结果与分析
2.1诱变效应
正突变率按公式(2)计算:

(2)
如表1所示,正突变率随着诱变剂量的增加而上升,在130×1013N+/cm2达到最高值18.2%,随后有所下降,在234×1013N+/cm2剂量时为11.8%。对于15 keV能量的N+束如图1所示,随着剂量增加菌落数呈现出下降的趋势,但是在130×1013N+/cm2时菌落存活数有稍微的回升,随后一直表现为下降的趋势。这可能是因为在诱变剂量小,细胞没有形成强有力的自我保护机制,当一次性注入大量离子束时,会激活细胞内的自我保护和自我修复的基质,防止细胞受到损害。如果进一步加大诱变剂量,这种机制就难以应付这种强度的损害,所以菌落存活数会一直下降,与前人所研究结果相同[16-17],从正突变率和菌落存活数两个方面考虑130×1013N+/cm2为最适诱变剂量。

表1 诱变剂量对正突变率影响

图1 不同诱变剂量下孢子存活曲线Fig.1 Livability curve of spores under different dose
2.2诱变菌株筛选
图2中a为洛伐他汀标准物质,b为红曲霉发酵产物检测结果。经过N+束诱变获得137株红曲霉,如图3所示,诱变菌株相对于出发菌株只有13.8%表现正突变。其中有8种诱变菌株相对于出发菌株和其他诱变菌株表现出明显优势,因此对这些菌株结合生长速度进一步分析,结果如表2所示。从洛伐他汀产量这一个指标看,M50-2、M50-16、M90-15相对于其他菌株具有显著性差异,具有明显的优势,但菌株之间并没有表现出显著性差异。生长速率显示M50-2表现出显著差异,为较优诱变菌株。
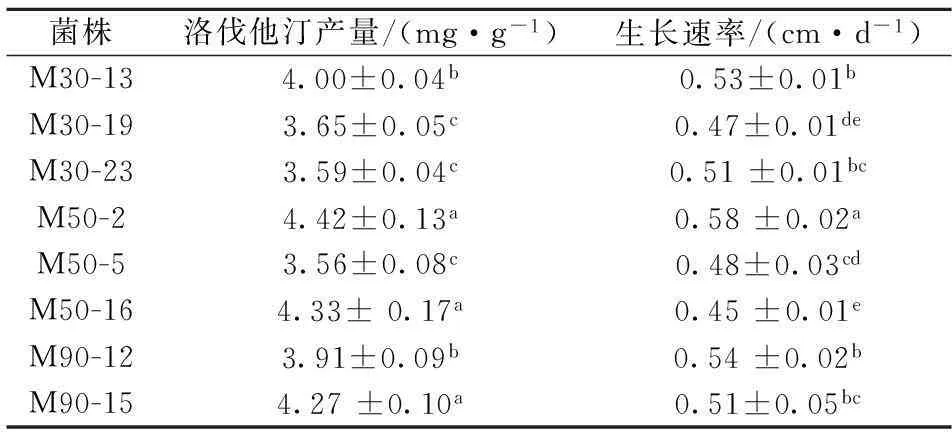
表2 红曲霉洛伐他汀产量和生长速度

图2 高效液相色谱 Fig.2 High performance liquid chromatography

图3 诱变菌株洛伐他汀产量Fig.3 Lovastatin yield of mutatin strains
2.3诱变菌株色价与洛伐他汀相关性分析
对诱变菌株进行洛伐他汀产量检测,HPLC方法是相对准确的,但对于诱变菌株数量多的情况下用这种方法相对繁琐耗时。李滔滔[11]提到,红曲色素和洛伐他汀的合成路径具有相同的部分,红曲色价可能和洛伐他汀产量之间有一定相关性。本实验选取8株诱变菌株进行发酵产物中色价测定并与对应洛伐他汀做对比,结果如图4所示。从中可以看出,不同菌株之间两个指数具有相同的变化趋势。为了精确分析两者的关系,对菌株进行相关性分析,结果显示,在0.05水平上表现出相关性,相关系数达到0.803。说明可以用测定色价间接检测洛伐他汀含量,排除差别相对大的菌株,再利用高效液相色谱进行精确检测来进一步筛选。
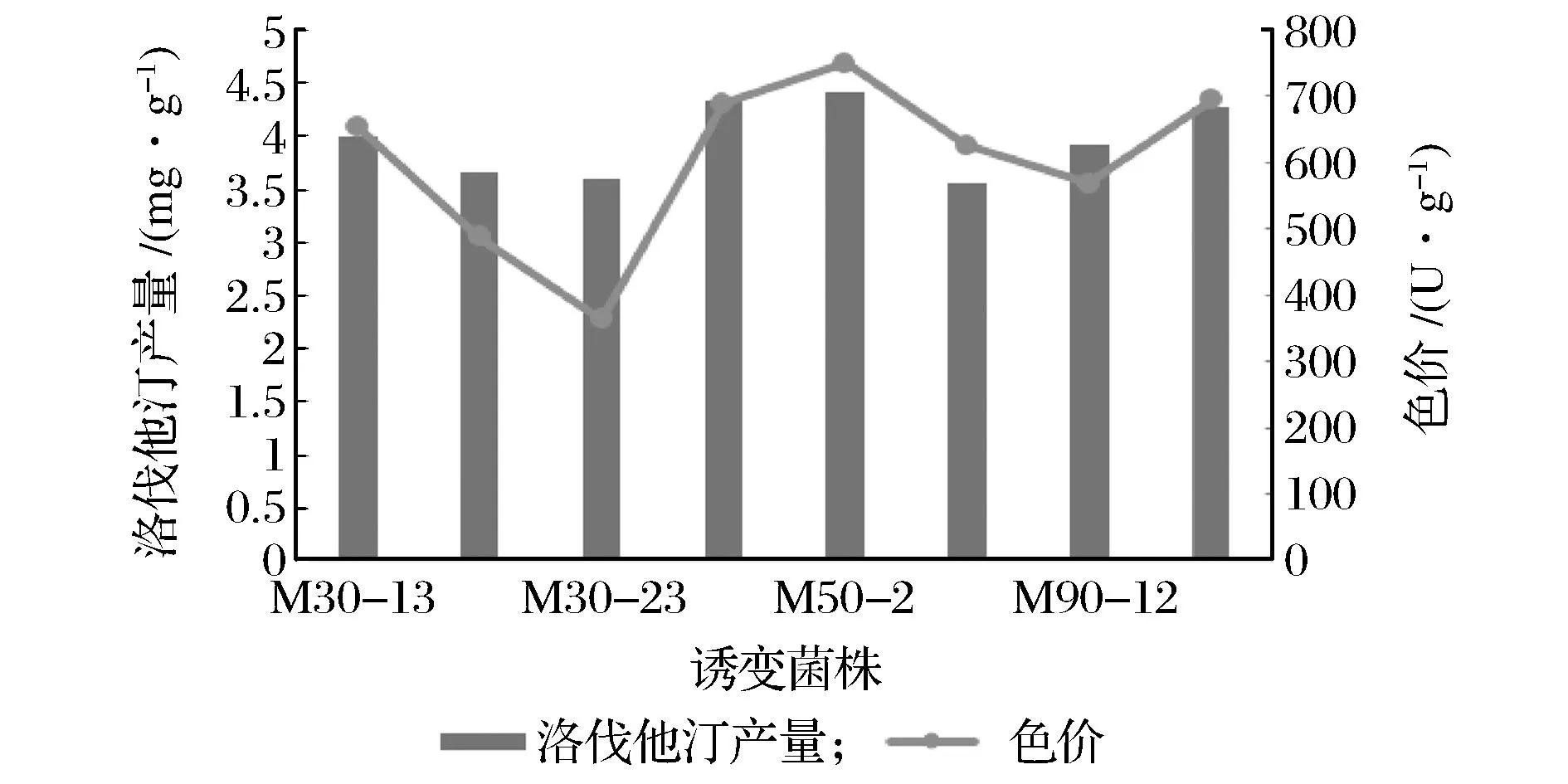
图4 诱变菌株色价和洛伐他汀Fig.4 Color scale yield and lovastatin of mutatin strains
2.4M50-2的遗传稳定性
检测诱变菌株M50-2洛伐他汀产量的遗传稳定性,将菌株进行连续培养至第12代,检测1、3、6、9、12代发酵产物中洛伐他汀产物含量。结果如表3所示。子代相对于第1代产量略有下降,但每组之间以及和一代对比没有表现出显著性差异,基本保持产量的稳定性。说明该诱变菌株具有良好的遗传稳定性,可以进行后续的发酵实验。

表3 高产洛伐他汀遗传稳定性
2.5M50-2与M14洛伐他汀代谢研究
为了研究诱变菌株和出发菌株发酵过程中洛伐他汀代谢的情况,对两种菌株发酵16 d,检测结果如图5所示。开始M50-2和M14洛伐他汀产量变化较小,在第6天出现显著增加并在14天达到最高,随后趋于稳定。说明诱变菌株和出发菌株在生物活性方面没有表现出不同。但是就洛伐他汀产量而言,在第4天开始M50-2产量高于M14,随后差异性逐渐分开,在14天差异性达到最大值。
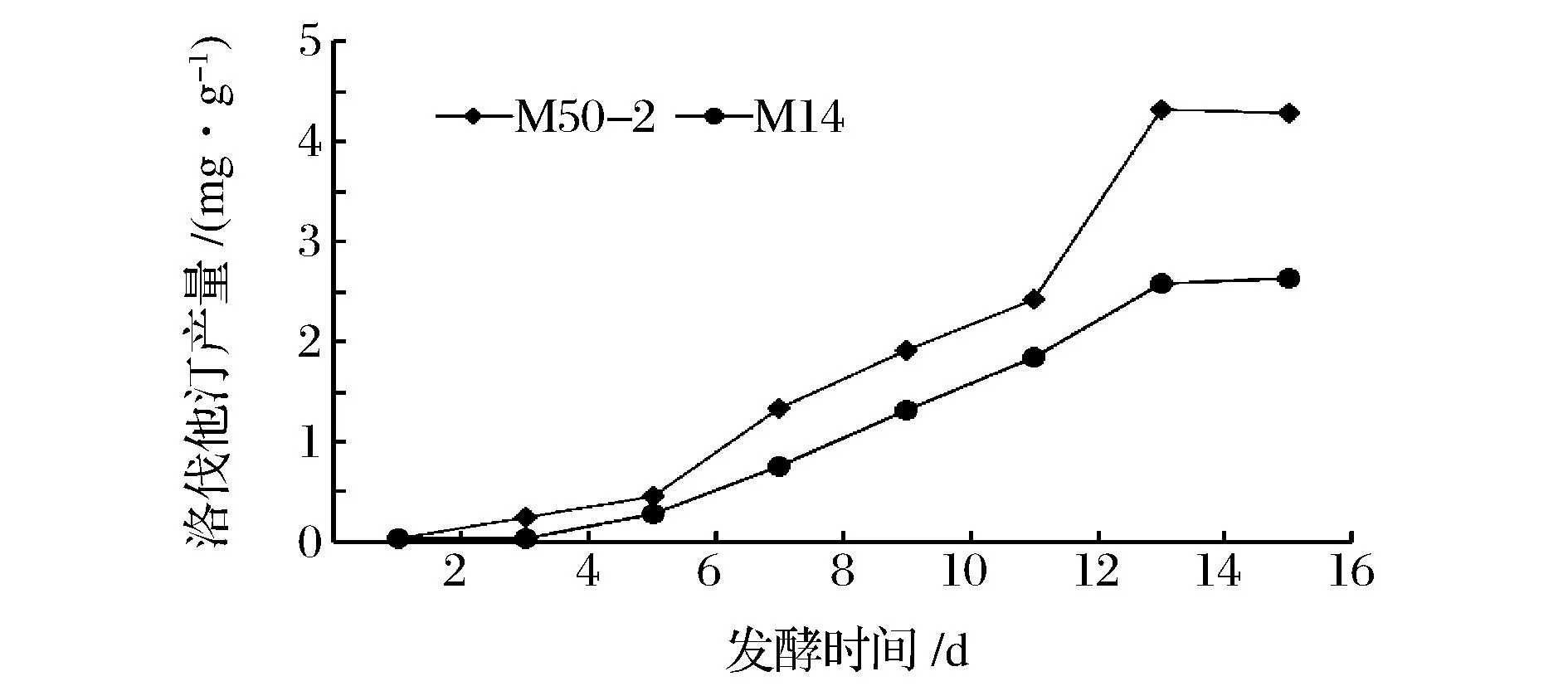
图5 不同发酵时间洛伐他汀产量Fig.5 Lovastatin production at different fermentation time
3讨论
红曲既是食品又是中药,在中国具有悠久生产和应用历史,其功能不仅在于抗菌,消化养胃,更重要的是可以产生降脂降压活性的物质。本研究以红曲霉为出发点,利用离子束诱变提高洛伐他汀产量。
随着N+束诱变剂量的增加,表现为成活数先下降再升高最后降低的曲线,形状似“马鞍形”,这和YU[16]和WANG[17]研究的一致,但是LI利用离子束对土曲霉进行诱变时,微生物成活率表现为一直下降趋势与本研究不一致,其中原因有待于进一步进行探讨。
在对诱变菌株进行筛选时,杨超根据高产红曲霉对洛伐他汀耐受性,制作洛伐他汀抗性平板筛选。李滔滔研究发现色价和洛伐他汀产量之间具有一定相关性,以此为出发点研究两者之间产量关系。从中发现可以利用两者之间具有显著相关性,可以间接检测红曲洛伐他汀产量,再利用高效液相色谱检测产别相对小的菌株,大大减少诱变菌株筛选的时间。
通过N+束诱变,诱变菌株M50-2洛伐他汀产量为4.42 mg/g相对于原始菌株提高了70%,比胡欢欢[18]利用紫外线和氯化锂复合诱变后菌株M-H4-3产量提高10%。相对于LEE[19]利用条件优化将产量提升35.5%,利用离子束诱变的方法提高产量是一种更优的选择。在进行遗传稳定性检测时,研究者对于传代次数考虑却不尽相同。LI[20]对诱变菌株传递9代,蔡作新[21]对链霉菌N3-643诱变菌株传递4代。本实验对M50-2传代,洛伐他汀含量没有显著性差异,表现为良好遗传稳定性。红曲霉次生代谢产物还包含桔霉素有害物质,在可食用的红曲米中严重影响人类身体健康。因此后续实验从洛伐他汀和桔霉素产量的比例以及国家对桔霉素含量标准两个方面综合考虑筛选优良菌株。
参考文献
[1]李钟庆.红曲菌的形态与分类学[M].北京:中国轻工业出版社,2003:1-2.
[2]NIMNOI P,LUMYONG S.Improving solid-state fermentation ofMonascuspurpureusonagricultural products for pigment production[J].Food Bioprocess Technology, 2011,4(8):1 384-1 390.
[3]HU Zhi-qiang, ZHANG Xue-hong,WU Zhen-qiang,et al. Perstraction of intracellular pigments by submerged cultivation ofMonascusin nonionic surfactant micelle aqueous solution[J]Biotechnology Productions and Process Engineering,2012,94(1):81-89.
[4]XIONG Xu, ZHANG Xue-hong, WU Zhen-qiang,et al.Optimal selection of agricultural products to inhibit citrinin production during submerged culture ofMonascusanka[J].Biotechnology and Bioprocess Engineering,2014,19(6):1 005-1 013.
[5]国家食品药品监督管理局国家药品标准[S]. YBZ01592004-2011Z. 2011.
[6]SERAMAN S, RAJENDAN A, THANGAVELU V,et al.Statistical optimization of anticholesterolemic drug lovastatin production by the red moldMonascuspurpureus[J]. Food and Bioproducts Processing,2010,88(2-3):266-276.
[7]JI Y K, HAE J K,OH J H,et al.Characteristics ofMonascussp. isolated fromMonascusfermentation products[J]. Food Science and Biotechnology,2010,19(5):1 151-1 157.
[8]SANI J, MONTIRA N, PANIT K,et al.Statistical optimization for Monacolin K and yellow pigment production and citrinin reduction byMonascuspurpureusin solid-state fermentation and citrinin reduction byMonascuspurpureusin solid-state fermentation[J].World Journal of Microbiology and Biotechnology,2013,23(3):364-374.
[9]HUANG Zhi-bing, XU Yang, LI Yan-ping,et al.Conversion investigation for lovastatin and its derivatives by HPLC[J] .Journal of Chromatographic Science,2010,48(8):631-636.
[10]JIA Zhi-hua, ZHANG Xiao-li, ZHAO Ya-ling,et al. Enhancement of lovastatin production by supplementing polyketide antibiotics to the submerged culture ofAspergillusterreus[J].Applied Biochemistry Biotechnology,2010,160(7):2 014-2 025.
[11]李滔滔,李小龙,张凤琴.高产洛伐他汀红曲菌株的诱变选育[J].食品工业科技,2012,33(24):246-248.
[12]游玟娟,温拥军,李援.高产洛伐他汀红曲霉复合诱变育种[J].食品工业科技,2014,35(22):213-215.
[13]缪建顺,杨建设,张苗苗等.重离子辐照微生物效应及诱变育种进展[J].辐射研究与辐射工艺学报,2014,32(2):1-8.
[14]LI Shi-weng, LI Mei,SONG Hong-ping,et al.Induction of a high-yield lovastatin mutant ofAspergillusterreusby12C6+heavy-ion beam irradiation and the influence of culture conditions on lovastatin production under submerged fermentation[J].Applied Biochemistry Biotechnology, 2011,165(3):913-925.
[15]秦红霞,周立平,嘉晓勤.N+离子束注入筛选红曲色素的红曲菌株及其发酵条件的研究[J].中国酿造,2011(4):68-71.
[16]余增亮,王纪,袁成凌.微生物油脂花生四烯酸产生菌离子束诱变和发酵调控[J].科学通报,2012,57(11):883-890.
[17]王曙阳,薄永恒,王丽华,等.12C6+离子辐照对阿维链霉菌代谢效应研究[J].原子核物理评论,2013,30(2):195-200.
[18]胡欢欢,胡中泽.红曲菌的复合诱变及其固态发酵条件的优化[J].食品科学,2012,33(11):247-251.
[19]LEE D S, LEE I.Development of monacolin K-enriched ganghwayakssuk (ArtemisiaprincepsPamp) by fermentation withMonascuspilosus[J].Journal of Microbiology and Biotechnology,2012,22(7): 975-980.
[20]LU Li-ping, ZHANG Bo-bo,XU Gan-rong,et al.Efficient conversion of high concentration of glycerol to Monacolin K by solid-state fermentation ofMonascuspurpureususing bagasse as carrier[J]. Bioprocess and Biosystems Engineering ,2013,36(2):293-299.
[21]蔡作新,郑传伟,田伟波,等.氮离子注入诱变选育恩拉霉素高产菌株[J].工业微生物,2015,45(3):58-61.
Screening of high-yield lovstatin monascus by nitrogen ion beam mutation breeding
LI Kuo-kuo1,WANG Yu1,2*,WAN Tian1,ZHUANG Xiao-xiao1
1(Shool of Resources and Environmental Engineering, Anhui University,Hefei 230601,China) 2(Industry Technology Research and Development Center for Chinese Medicinal Materials,Hefei 230601,China)
ABSTRACTIn order to improve the yield of lovastatin, strain M14 was injected by ion beam to induce mutant strain. The dose were 78×1013, 130×1013, 182×1013, and 234×1013N+/cm2. The positive mutant strains were screened through detection of lovastatin content in the solid-state fermentation products by HPLC. The optimal dose was 130×1013N+/cm2, which resulted in relatively high positive mutation rate. The best strain M50-2 yield 4.42 mg/g lovastatin, which was 70% higher than original strains. To examine the genetic stability of M50-2, the strain was continuously sub-cultured to the 12 generation. The ability to produce lovastatin fell by 2.3%. It remained steady after subculture. This strain has potential application.
Key wordsMonascus; lovastatin; N+beam; mutation
收稿日期:2015-09-10,改回日期:2016-01-06
基金项目:国家自然科学基金(31471554)
DOI:10.13995/j.cnki.11-1802/ts.201604018
第一作者:硕士研究生(王钰教授为通讯作者,E-mail:wangyu@ahu.edu.cn)。

