糙皮侧耳产洛伐他汀发酵培养基的优化
殷朝敏 范秀芝 刘纯友 陈浙娅 马 昆 史德芳程 薇 高 虹
(1湖北省农业科学院农产品加工与核农技术研究所,湖北武汉 430064;2国家食用菌加工技术研发分中心,湖北武汉 430064;3广西科技大学生物与化学工程学院,广西柳州 545006;4华中农业大学食品科技学院,湖北武汉 430070)
高血脂是困扰人们的一种富贵病,主要由饮食中脂肪或胆固醇摄入过多等所致,高血脂及其引发的多种心脑血管疾病已成为危及人类健康的头号杀手[1]。据《中国健康大数据》统计,我国高血脂患病人数已高达1.6亿。目前,已有多种降血脂药物,如脂必妥、血脂康等,这些药物的主要成分均为他汀类化合物。早在1976年,Endo等[2]发现产自橘青霉(Penicillum citrinum)的一种化合物能有效抑制胆固醇的合成,并将此化合物命名为美伐他汀。随着研究的不断深入,人们发现高剂量的美伐他汀会产生一定的副作用,如促成淋巴瘤的形成等[3],从而限制了美伐他汀的应用。几年后,研究者从土曲霉(Aspergillus terreus)中分离出另一种化合物,该化合物对胆固醇合成的抑制能力远高于美伐他汀,且无副作用,并将其命名为洛伐他汀[4]。研究表明,洛伐他汀能竞争性地抑制胆固醇生物合成限速酶——HMG-CoA还原酶(3-hydroxy-3-methyl glutaryl coenzyme A reductase),继而抑制内源性胆固醇合成,调节体内异常血脂的生成[5]。洛伐他汀除可以降低体内胆固醇外,还对过度兴奋和癫痫发作有一定的抑制作用[6];此外,小鼠试验表明,洛伐他汀对神经内分泌疾病、癌症、阿尔茨海默氏病、骨质疏松症以及内脏异常性疼痛等也有一定的治疗效果[7-9]。
目前,已在侧耳属(Pleurotusspp.)[10]、红曲霉属(Monascusspp.)[11-12]、青霉菌(Penicilliumspp.)[13]、曲霉属(Aspergillusspp.)[14-15]等多种真菌中发现了洛伐他汀。工业上常用曲霉属真菌液态发酵生产洛伐他汀,但丝状真菌在发酵过程中易产生多种次级代谢产物,如色素前体、硫赭曲菌素(Sulochrin)、曲地酸(Asterric acid)和地曲霉素(Geodin)等,不利于下游的提取纯化[1]。侧耳属食用菌不产生真菌毒素,但遗传背景复杂,工程菌构建困难,因此在洛伐他汀工业生产上应用较少。前期,湖北省农业科学院食用菌课题组测定了12株侧耳属食用菌常见栽培种菌丝中洛伐他汀的含量,其中糙皮侧耳(Pleurotus ostreatus)P380、PH2和P49菌株菌丝中洛伐他汀含量分别为42.10、38.09和35.83 μg·g-1,远高于其他菌株中洛伐他汀的含量[16]。本试验选择高产洛伐他汀的糙皮侧耳菌株并优化其发酵培养基以提高糙皮侧耳发酵产物的洛伐他汀产量,旨在为糙皮侧耳液体发酵菌质产品的开发提供数据参考。
1 材料与方法
1.1 供试菌株与培养基
糙皮侧耳(P.ostreatus)P380菌株、PH2菌株、P49菌株均保藏于湖北省农业科学院农产品加工与核农技术研究所。
马铃薯琼脂培养基(potato dextrose agar,PDA):马铃薯 200 g·L-1, 葡萄糖 20 g·L-1,琼脂 20 g·L-1,蒸馏水1 000 mL。液体完全培养基(liquid complete culture medium,LCYM):葡萄糖 20.0 g·L-1,蛋白胨 2.0 g·L-1,酵母膏 2.0 g·L-1,KH2PO40.5 g·L-1,K2HPO41.0 g·L-1,MgSO40.5 g·L-1,蒸馏水1 000 mL。 基础发酵培养基(basic fermentation medium,M0):葡萄糖20.0 g·L-1,蛋白胨 2.0 g·L-1,KH2PO42.0 g·L-1,MgSO41.0 g·L-1,蒸馏水 1 000 mL。
1.2 主要试剂与仪器
洛伐他汀(纯度≥98%)标准品,上海源叶生物科技有限公司;乙腈(色谱级),美国Sigma公司;纯净水,杭州娃哈哈集团有限公司;黄豆,滕州市兴龙食品有限公司;糙米,湖北思源农贸有限责任公司;麸皮、蔗糖,市售;其他试剂均为国产分析纯。试验前将黄豆、糙米和麸皮粉碎并过80目筛,过筛部分4℃保存备用。
LC-20AT高效液相色谱仪(配SIL-20A自动进样器、SPD-M20A二极管阵列检测器)、UV-1800紫外可见分光光度计,日本岛津公司;Sunfire C18色谱柱(5 μm,4.6 mm×250 mm),美国 Waters公司;HH-2数字显示恒温水浴锅,常州市国华仪器有限公司;KQ5200E超声波清洗器,昆山市超声仪器有限公司;RE5205型旋转蒸发仪,上海亚荣生化仪器厂。
1.3 糙皮侧耳液体培养
将3株糙皮侧耳菌株试管种接种到PDA平板,25℃培养4 d活化,取2 cm×2 cm的菌块接种到装有100 mL LCYM培养基的250 mL三角瓶中,25℃、120 r·min-1避光培养5 d后匀浆制备种子液。取6 mL种子液接种于装有600 mL MO培养基的1 L三角瓶中,25℃、120 r·min-1避光发酵10 d,在第 5~第 10 天,每天取发酵液2 mL,3 000 r·min-1离心10 min后取上清液,测定洛伐他汀产量,每次试验设置3个重复。
1.4 洛伐他汀产量测定
洛伐他汀产量的测定参考Lin等[17]和Chen等[18]的方法并作修改。采用Inert-Sustain C18色谱柱(250 mm × 4.6 mm,5 μm);流动相为乙腈 ∶水(70 ∶30,v/v);流速 0.8 mL·min-1;柱温 30℃;进样量 10 μL;检测波长238 nm;检测时间20 min。
标准曲线的绘制:精密称量20 mg洛伐他汀标准品,用色谱级甲醇定容至100 mL,即得洛伐他汀贮存液。吸取上述贮存液配置成不同浓度的标准液(1、5、10、20、50、100 μg·mL-1),过 0.45 μm 微孔滤膜后取10 μL进样测定。 以标准品质量浓度x(μg·mL-1)为横坐标,峰面积y为纵坐标绘制标准溶液曲线。
样品测定:无菌条件下,用移液枪取100 mL发酵液,1 435×g离心5 min,收集上清液,按照体积比1∶1加入乙酸乙酯后磁力搅拌萃取2 h,取有机相过0.22 μm微孔虑膜后进样测定。
1.5 生物量测定
在发酵的第5~第10天,每天取100 mL发酵液,双层滤纸抽滤后,菌丝球用蒸馏水冲洗3次,于80℃烘箱中烘干至恒重,记录菌丝干重。
1.6 发酵培养基的优化
将10 mL种子液加入到装有600 mL MO培养基的锥形瓶中(1 L),进行发酵培养优化试验。发酵8 d后测定生物量和发酵上清液中洛伐他汀产量,所有试验均设3次平行测定,结果取平均值。
1.6.1 单因素试验 碳源试验:分别用20.0 g·L-1的蔗糖、乳糖、麦芽糖、甘油、醋酸钠代替MO培养基中的葡萄糖,筛选最佳碳源;碳源浓度设12.0、16.0、20.0、24.0、28.0 g·L-1,筛选最佳浓度。
氮源试验:分别取2.0 g黄豆粉、大米粉、玉米粉和麸皮,加500 mL蒸馏水,煮沸10 min后过滤;取滤液,添加MO培养基中除蛋白胨外其他成分。氯化铵试验组,配置高浓度MO培养基(不加蛋白胨),添加40.0 g·L-1氯化铵无菌液至终浓度为 2.0 g·L-1。氮源浓度设 1.0、1.5、2.0、2.5、3.0 g·L-1,优化最佳浓度。
无机盐的影响:分别用2.0 g·L-1的氯化亚铁、硫酸盐、硫酸锌、硫酸铜、硫酸镁代替MO培养基中硫酸镁,筛选最佳无机盐;无机盐浓度设 1.5、2.0、2.5、3.0、3.5 g·L-1,并筛选最佳浓度。
发酵液初始pH的影响:调节MO培养基pH值分别为 5.5、6.0、6.5、7.0、7.5、8.0,确定培养基的最佳初始pH。
玉米粉/氯化铵比例的影响:在MO培养基基础上用玉米粉和氯化铵代替蛋白胨,并调整玉米粉/氯化铵比例为 0.25∶1、0.5 ∶1、1∶1、1.5 ∶1和 2 ∶1。
硫酸镁/磷酸二氢钾比例的影响:在基础发酵培养基基础上调整硫酸镁和磷酸二氢钾比例为1∶1、1.5∶1、2 ∶1、2.5 ∶1和 3 ∶1。
1.6.2 正交试验 在单因素试验基础上,采用正交试验对碳源、氮源、无机盐和发酵液初始pH 4个因素开展L9(34)正交试验(表1),确定产洛伐他汀最优培养基组成。
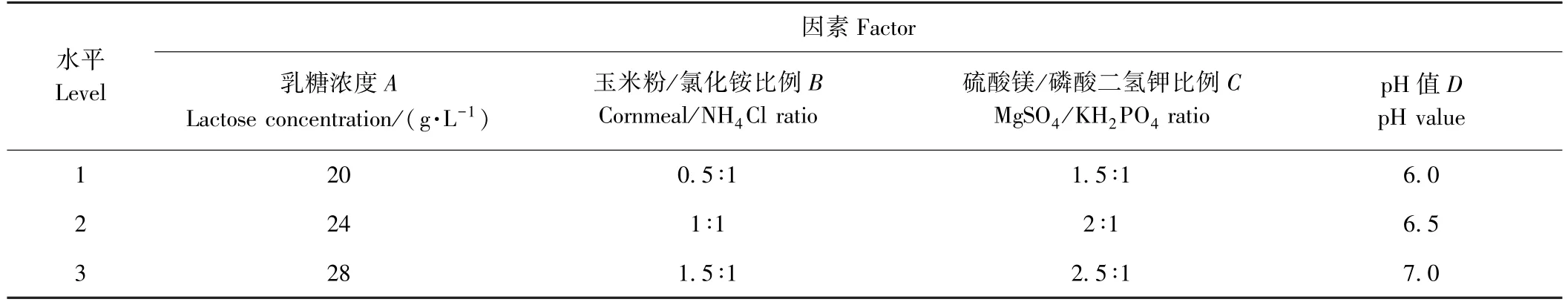
表1 L9(34)正交试验因素水平表Table 1 L9(34)factors and levels of orthogonal experiments
1.7 数据分析
采用SPSS 20.0软件对数据进行分析,采用Origin 8.0软件制图。
2 结果与分析
2.1 不同菌株发酵液中洛伐他汀产量曲线
由图1可知,从发酵第5天开始,随着发酵时间的延长,PH2、P380、P49菌株发酵液中洛伐他汀产量逐渐增加,至发酵第8天,P380菌株和P49菌株发酵液中洛伐他汀产量均达到最大值,分别为9.63、4.81 μg·mL-1;PH2菌株在发酵第9天时洛伐他汀产量达到最大值(7.86 μg·mL-1),随培养时间的延长洛伐他汀产量逐渐降低。这可能是由于洛伐他汀等次级代谢产物的积累以及生长环境的进一步恶化,在某种程度上抑制了菌丝生长[19]。综合3株糙皮侧耳菌株发酵液中洛伐他汀产量以及发酵周期长短,选取P380菌株作为后续试验的研究对象。
2.2 不同碳源对洛伐他汀产量的影响
研究表明碳源对真菌中洛伐他汀的产生具有重要的影响[20]。由图2-A可知,蔗糖为碳源时,菌丝生长旺盛,生物量最高;乳糖为碳源时,生物量比蔗糖组稍低,但洛伐他汀产量比蔗糖组高,产量达到 10.24 μg·mL-1。试验选取乳糖作为最佳碳源。由图2-B可知,当乳糖浓度为24.0 g·L-1时,发酵液中洛伐他汀产量达到最高,为 11.56 μg·mL-1。
2.3 不同氮源对洛伐他汀产量的影响
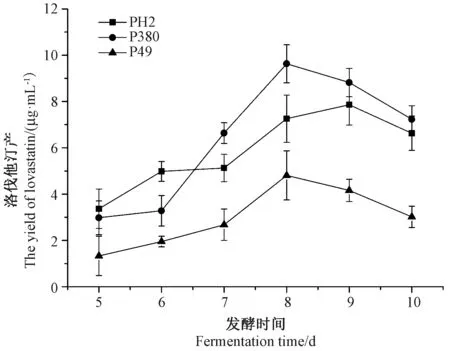
图1 不同菌株发酵液中洛伐他汀产量Fig.1 The yield of lovastatin produced by different P.ostreatus strains
除了碳源,氮源对菌丝合成洛伐他汀也有重要影响。Porcel等[21]发现氮源对土曲霉(A.terreus)产洛伐他汀的影响远大于碳源。由图3-A可知,发酵8 d后,添加有机氮源的发酵液中生物量都明显高于添加氯化铵组,但黄豆粉、大米粉和麸皮组中洛伐他汀产量均低于添加氯化铵组(6.68 μg·mL-1),添加玉米粉组洛伐他汀产量最高,为9.98 μg·mL-1。选定玉米粉作为最佳有机氮源。由图3-B可知,当玉米粉添加量为2.5 g·L-1时,发酵液中洛伐他汀产量最高(11.25 μg·mL-1)。
2.4 不同无机盐对洛伐他汀产量的影响
影响菌丝中洛伐他汀合成的另外一个重要因素是无机盐离子[1]。由图4-A可知,氯化亚铁组发酵液中几乎无菌丝生长;硫酸锌组发酵液中有少量菌丝生长,生物量较低,发酵液中未检测到洛伐他汀。硫酸锰和硫酸铜组发酵液中有一定菌丝生长,但洛伐他汀产量和生物量均低于硫酸镁组。硫酸镁组洛伐他汀产量和生物量最高,分别为 10.28 μg·mL-1和 13.54 g·L-1,选取硫酸镁作为外加无机盐离子。由图4-B可知,当硫酸镁添加量为2.5 g·L-1时,发酵液中洛伐他汀产量最高,达 12.86 μg·mL-1。
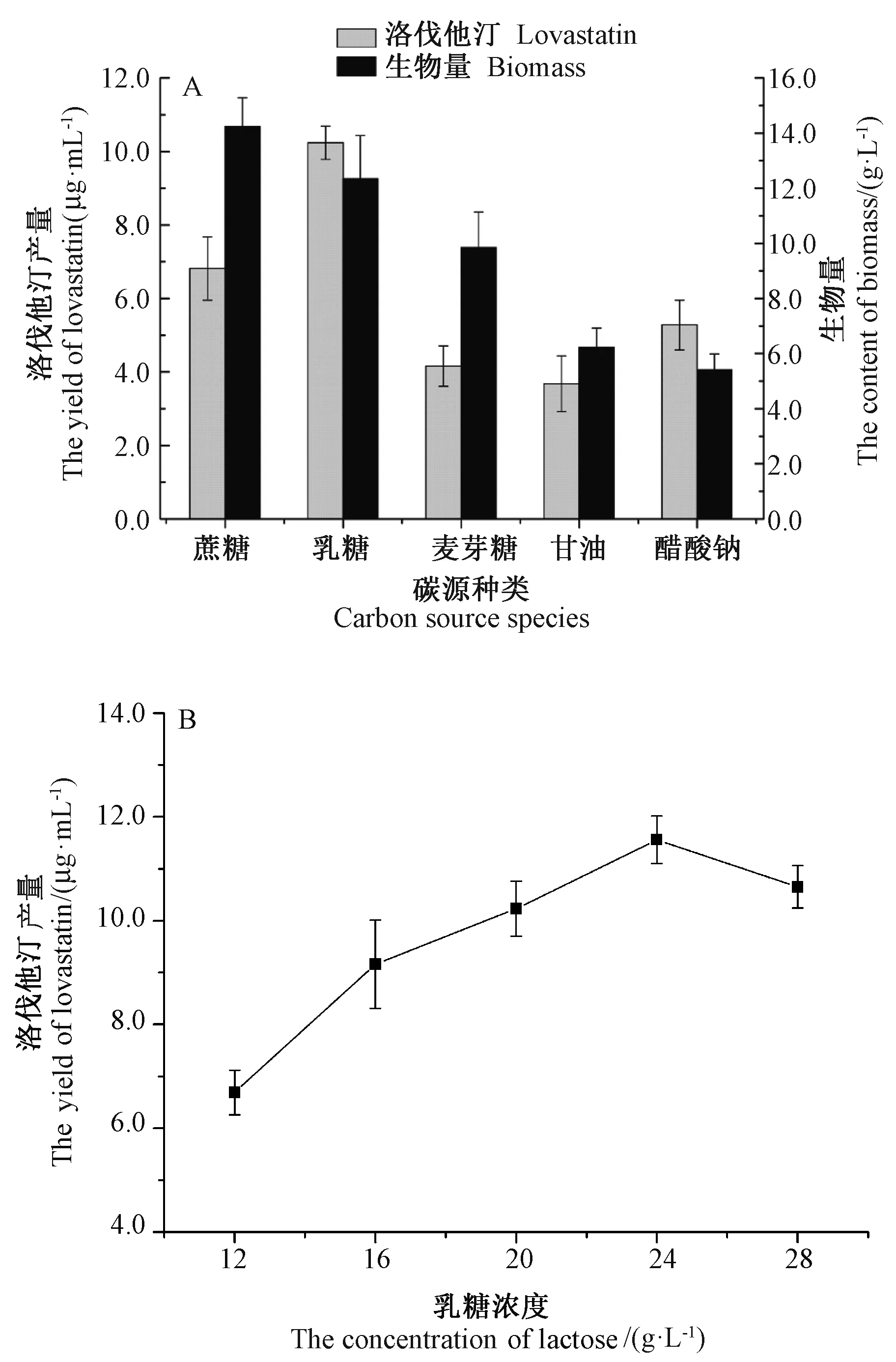
图2 不同碳源(A)和不同乳糖浓度(B)对洛伐他汀产量和生物量的影响Fig.2 Effect of carbon source(A)and lactose concentration(B)on the yield of lovastatin and content of biomass
2.5 发酵液不同初始pH对洛伐他汀产量的影响
由图5可知,在pH值6.0~7.0之间,发酵液中洛伐他汀产量和生物量相差不大。当pH值为6.5时,洛伐他汀产量和生物量最大,分别为8.86 μg·mL-1和10.88 g·L-1。
2.6 不同玉米粉/氯化铵比例对洛伐他汀产量的影响
研究表明,适当的氮源“饥饿”有助于洛伐他汀的形成和积累[1]。无机氮源,如氯化铵等小分子,可被糙皮侧耳菌丝快速利用。当以氯化铵为氮源时,发酵液中检测到的洛伐他汀产量高于黄豆粉、大米粉和麸皮组。由图6可知,当玉米粉/氯化铵添加比例为1∶1时,洛伐他汀产量最大(12.54 μg·mL-1)。
2.7 不同硫酸镁/磷酸二氢钾比例对洛伐他汀产量的影响
前期试验表明,磷酸盐对糙皮侧耳菌丝的生长以及次级代谢产物的生成至关重要(数据未发表)。由图7可知,随着硫酸镁/磷酸二氢钾添加比例的升高,发酵液中洛伐他汀含量也逐渐增加,当添加比例为2∶1时,发酵液中洛伐他汀产量最高,为12.63 μg·mL-1,随后洛伐他汀产量降低。
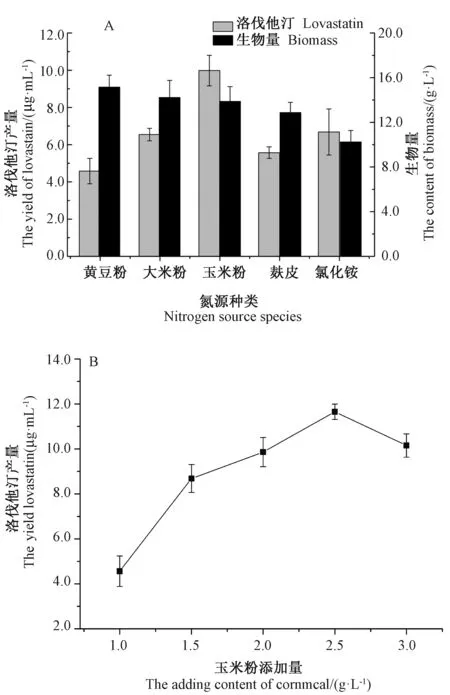
图3 不同氮源(A)和不同玉米粉添加量(B)对洛伐他汀产量和生物量的影响Fig.3 Effect of nitrogen source(A)and cornmeal adding content(B)on the yield of lovastatin and content of biomass
2.8 正交试验分析
由表2可知,各因素对洛伐他汀产量的影响程度依次为A>B>C>D,即乳糖浓度>玉米粉/氯化铵添加比例>硫酸镁/磷酸二氢钾添加比例>初始pH值。综合各因素,糙皮侧耳发酵产洛伐他汀最佳培养基(pleurotus ostreatus liquid medium,POL)为:乳糖24.0 g·L-1,玉米粉 2.5 g·L-1,氯化铵 2.5 g·L-1,磷酸二氢钾 5.0 g·L-1,硫酸镁 2.5 g·L-1,初始 pH 值 6.0。
2.9 最优发酵条件的验证
为验证优化培养基效果,分别用MO和POL培养基接种相同浓度的种子液,在同一条件下连续发酵培养8 d,结果如图8所示,与MO培养基相比,POL培养基的伐他汀产量提高了3.15倍,生物量提高了1.78倍。
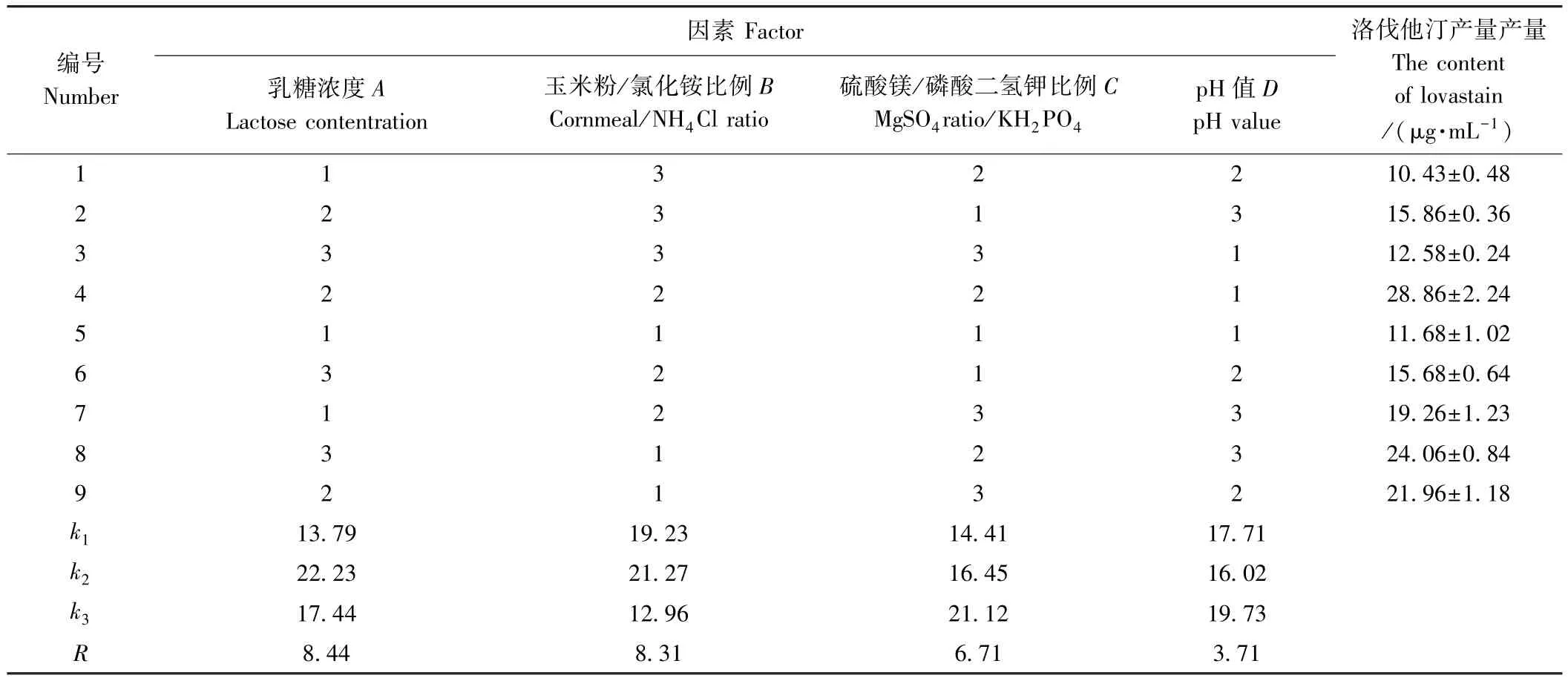
表2 正交试验设计和极差分析Table 2 The analysis of range and design of orthogonal test
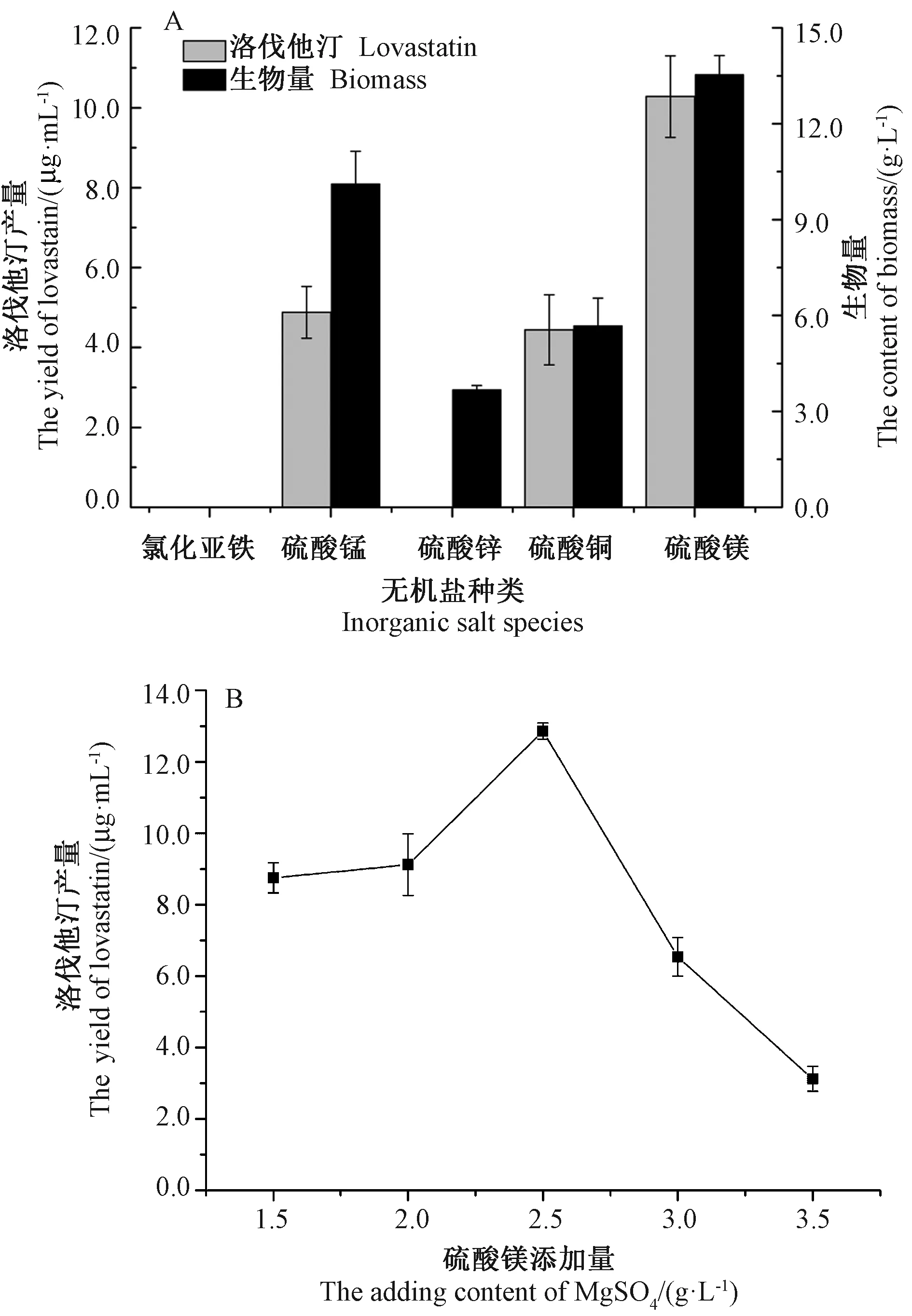
图4 不同无机盐(A)和不同硫酸镁添加量(B)对洛伐他汀产量和生物量的影响Fig.4 Effect of different inorganic salt(A)and MgSO4adding content(B)on the yield of lovastatin and content of biomass
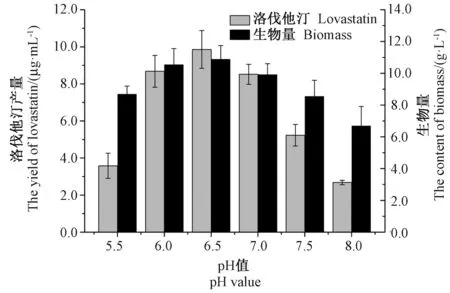
图5 不同pH值对洛伐他汀产量和生物量的影响Fig.5 Effect of different pH value on on the yield of lovastatin and content of biomass
3 讨论
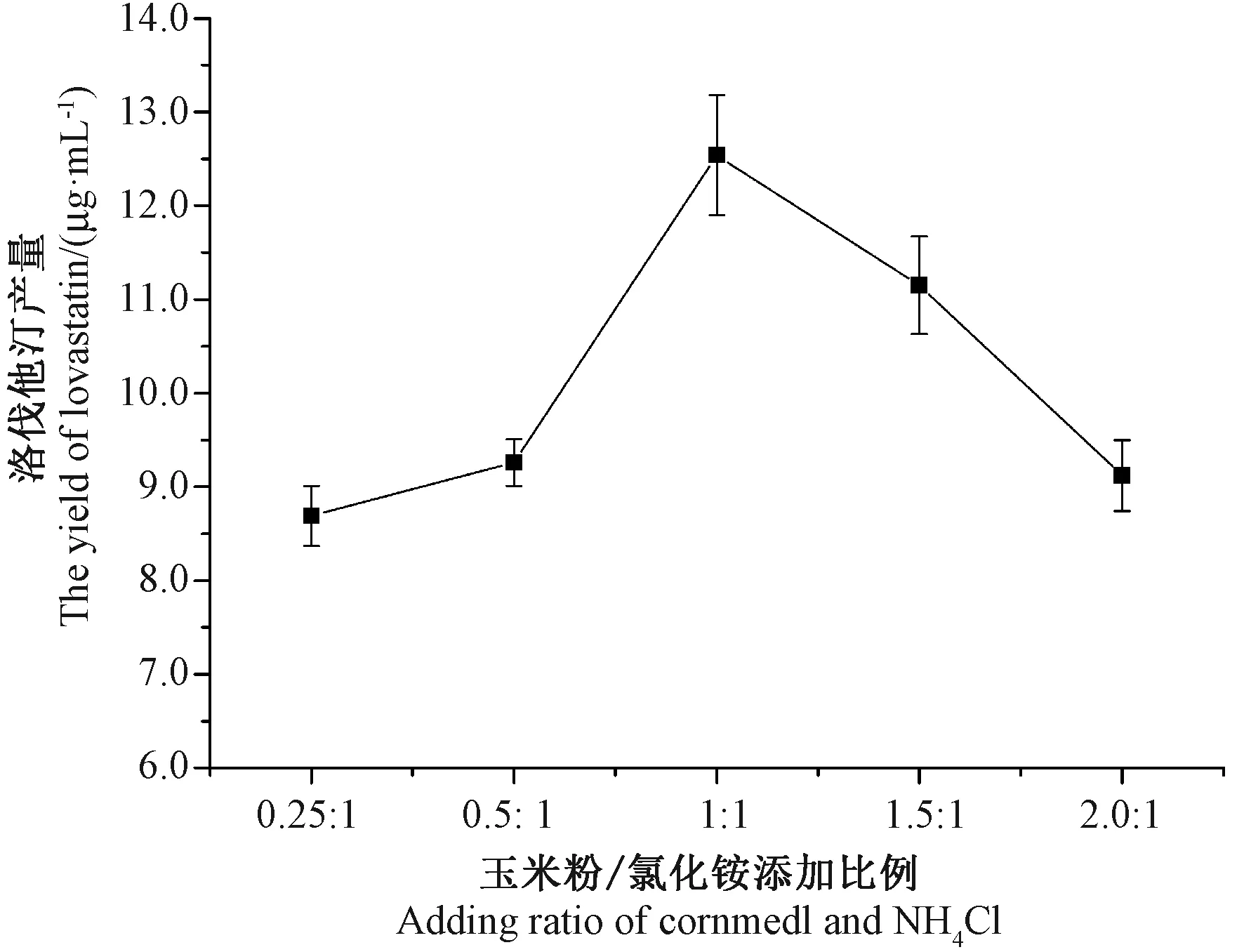
图6 不同玉米粉/氯化铵添加比例对洛伐他汀产量的影响Fig.6 Effect of different adding ratio of cornmeal/NH4Cl on the yield of lovastatin
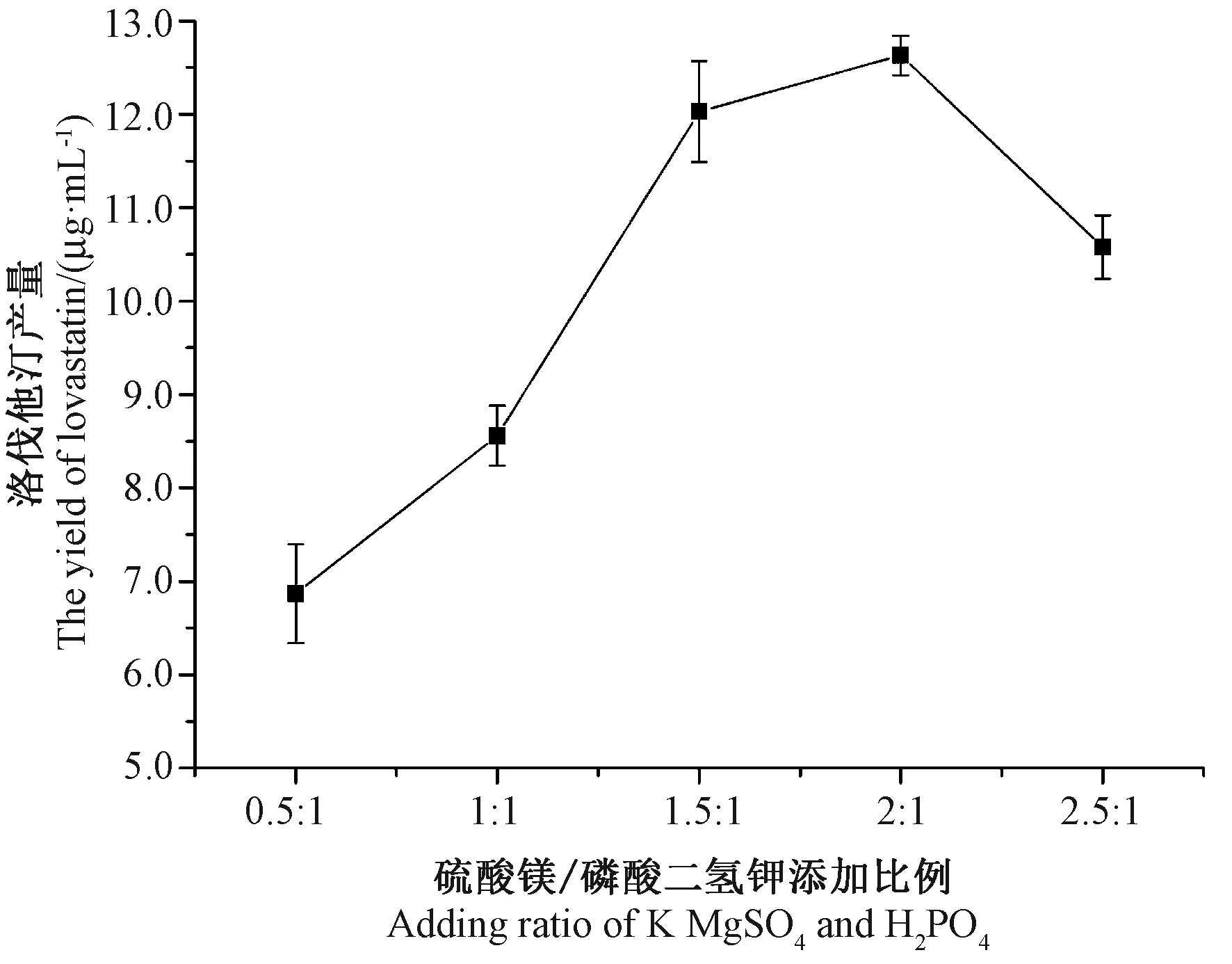
图7 不同硫酸镁/磷酸二氢钾添加比例对洛伐他汀含量的影响Fig.7 Effect of different adding ratio of MgSO4/KH2PO4on the yield of lovastatin
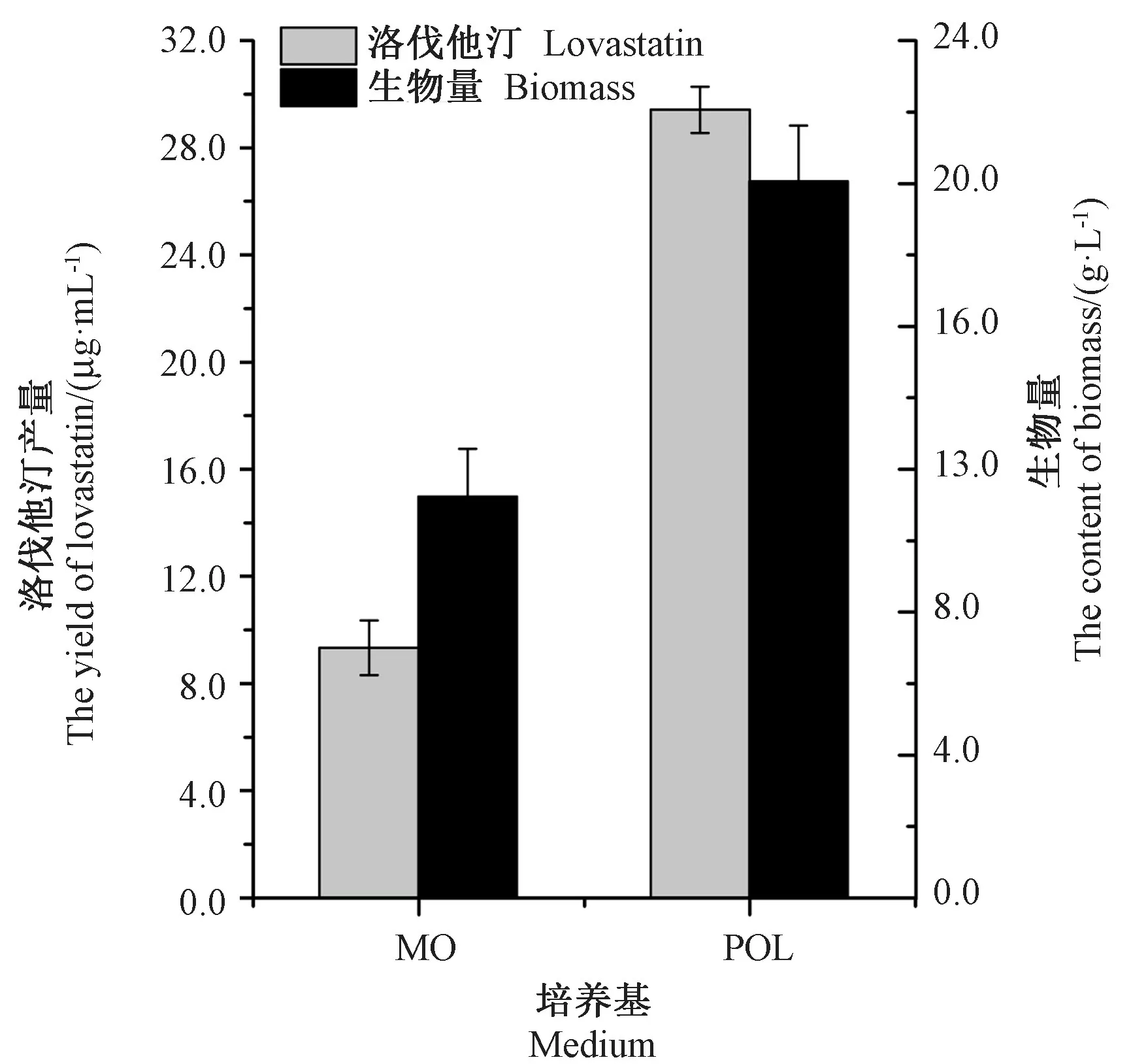
图8 优化前后洛伐他汀产量和生物量的变化Fig.8 Changes of lovastatin and biomass yield before and after medium optimization
洛伐他汀(C24H36O5),又称莫纳可林K,是一种有效的胆固醇合成抑制剂[5]。早在上世纪80年代,洛伐他汀被美国食品药品监督管理局(Food and Drug Administration,FDA)批准成为第一个上市的他汀类降血脂药物[22]。目前,洛伐他汀主要通过工业大规模发酵获得,发酵培养基组成如碳源、氮源种类及其浓度、氧饱和度、发酵pH值等对洛伐他汀的产量及产生速率均影响较大[1]。研究表明,在发酵培养基中添加缓慢代谢的碳源,如乳糖和甘油等,有利于洛伐他汀的合成和积累[23]。Casas Lopéz等[24]利用土曲霉发酵生产洛伐他汀时,乳糖加入量高达100 g·L-1,洛伐他汀产量可达230 mg·L-1。Li等[20]同样利用土曲霉发酵生产洛伐他汀,在培养基中额外加入3%甘油使得洛伐他汀产量高达916 mg·L-1。本研究发现,在MO培养基中用乳糖替代葡萄糖后,洛伐他汀产量从9.63 μg·mL-1增加到 10.24 μg·mL-1,但用甘油替代葡萄糖后,洛伐他汀含量反而下降(4.86 μg·mL-1),这可能与菌株的种类不同有关。前人研究结果表明,氮源对洛伐他汀产量的影响甚至超过碳源,氮源含量高导致生物量的增长以及其他次级代谢产物的生成,因此生产中常用适当限制氮源量的方法来获得高产洛伐他汀[21,25]。Kamath等[26]认为有机氮源对洛伐他汀产生无影响,只是对生物量有较大影响;Alarcón等[27]发现不同碳氮比对糙皮侧耳发酵产洛伐他汀影响较大,但有机氮源对洛伐他汀的合成影响不大。本研究发现,有机氮源对糙皮侧耳产洛伐他汀有一定影响,其中玉米粉可有效增加发酵液中洛伐他汀的积累。此外,无机氮源氯化铵对糙皮侧耳产洛伐他汀也有一定影响,推测可能是氯化铵属小分子物质易于吸收,在生长前期被用于菌丝生长,在后期氮源成了限制因素,这种营养限制有利于洛伐他汀的生成,Mulder等[1]的研究也证实了这一点。金属离子对洛伐他汀的影响也较大,Jia等[28]发现低浓度Cu2+会抑制细胞的生长以及洛伐他汀的合成,而一定浓度 Fe2+、Ca2+、Zn2+、Mg2+和 Mn2+能促进洛伐他汀的合成,但是将这些离子混合加入则会抑制洛伐他汀的合成。本研究结果发现,在MO培养基中将硫酸鲜替换成一定浓度氯化亚铁或者硫酸锌后,会明显抑制糙皮侧耳菌丝的生长,而添加一定量硫酸镁则有利于菌丝生长以及洛伐他汀的积累。目前关于发酵培养基pH对洛伐他汀合成的影响存在一定争议,部分学者认为丝状真菌发酵产洛伐他汀最适pH值为6.5,还有学者认为发酵培养基pH对洛伐他汀产量影响不大[1,25]。本研究结果表明,发酵培养基pH对糙皮侧耳产洛伐他汀有一定影响,但没有其他因素那么明显。此外,本研究还发现,玉米粉/氯化铵添加比例、硫酸镁/磷酸二氢钾添加比例对糙皮侧耳产洛伐他汀也存在一定影响,当玉米粉/氯化铵添加比例、硫酸镁/磷酸二氢钾添加比例分别为1∶1和2∶1时,洛伐他汀产量最大,这可能与糙皮侧耳对这些氮源和无机盐先后利用顺序有关。
4 结论
本研究通过单因素和正交试验确定了糙皮侧耳发酵产洛伐他汀的最优发酵培养基,与基础发酵培养基相比,优化后洛伐他汀产量提高了3.15倍,生物量提高了1.78倍,表明培养基组成对糙皮侧耳发酵产洛伐他汀影响较大。根据本研究结果,下一步将在代料生产中添加部分碳、氮源及无机盐,进一步研究如何提高糙皮侧耳子实体中洛伐他汀含量。

