传统发酵牦牛酸乳中益生性乳酸菌的体外筛选
陈孝勇,李键,赵欣,骞宇,陈炼红,陈娟,索化夷*
1(西南大学 食品科学学院,重庆,400715) 2(西南大学 重庆市特色食品工程技术研究中心,重庆,400715) 3(西南民族大学 青藏高原研究院,四川 成都,610041) 4(西南民族大学 生命科学与技术学院,四川 成都,610041)
5(重庆第二师范学院 生物与化学工程系,重庆,400067)
传统发酵牦牛酸乳中益生性乳酸菌的体外筛选
陈孝勇1,2,李键3,4,赵欣5,骞宇5,陈炼红3,4,陈娟4,索化夷1,2*
1(西南大学 食品科学学院,重庆,400715) 2(西南大学 重庆市特色食品工程技术研究中心,重庆,400715) 3(西南民族大学 青藏高原研究院,四川 成都,610041) 4(西南民族大学 生命科学与技术学院,四川 成都,610041)
5(重庆第二师范学院 生物与化学工程系,重庆,400067)
摘要为获得具有潜在益生特性的乳酸菌,实验以抗人工胃液、胆盐中生长效率和细胞表面疏水性为筛选指标,对羊八井地区传统发酵牦牛酸乳中分离出的38株乳酸菌进行体外筛选。最终通过测定结果综合比较得出菌株编号为YBJ-3、YBJ-11、YBJ-15、YBJ-17、YBJ-30和YBJ-33乳酸菌的益生特性较好,其中4株乳酸菌抗人工胃液能力大于90%,在胆盐中良好生长。通过16S rDNA序列分析鉴定,菌株编号YBJ-3为屎肠球菌(Enterococcus faecium)、YBJ-11为发酵乳杆菌(Lactobacillus fermentum)、YBJ-15为耐久肠球菌(Enterococcus durans)、YBJ-17为植物乳杆菌(Lactobacillus plantarum)、YBJ-30为植物乳杆菌(Lactobacillus plantarum)、YBJ-33为干酪乳杆菌(Lactobacillus casei)。
关键词牦牛酸乳;乳酸菌;益生性;筛选
益生菌是一类可在人体内发挥益生作用的活性微生物,随着我国发酵乳制品行业的快速发展,开发具有一定生理功能的益生菌产品成为我国乳品行业发展的重要方向[1]。发达国家通过建立大型专业化的菌种资源库,通过系统的筛选和研究得到了多株知名益生菌株。我国目前益生菌发酵乳制品大多采用国外菌种发酵,如伊利公司采用了芬兰Valio公司开发的LGG菌株;蒙牛乳业则采用丹麦Hansen公司的LABS菌群;光明乳业使用的活力e+菌是与丹麦尼斯克集团合作的产品。此外,国内保藏的乳酸菌菌种大多分离自国外的发酵剂,缺乏具有自主知识产权的益生菌菌种,主要原因在于我国益生乳酸菌的研究与开发起步较晚。
牦牛酸奶是青藏高原地区藏族人民常食用的美食,属于Ⅳ型发酵乳,具有悠久的历史。作为益生菌的乳酸菌要发挥益生功能的首要条件是可以进入人体肠道并在其中定殖。具备胃液、肠液抗性和肠道吸附能力的乳酸菌可以作为潜在益生菌进行进一步功能开发。用这种技术手段开发益生菌并取得成功。Li Wei[2]从传统发酵乳中分离出1株LactobacillushelveticusMB2-1,研究表明该菌株具有良好的体外抗氧化活性;王辑[3]研究内蒙古奶豆腐中的益生性乳酸菌,通过模拟人工胃液、胆盐和疏水性等试验,表明奶豆腐中植物乳杆菌M1-2和鼠李糖乳杆菌M6-1具有较好益生特性,具有潜在应用价值。本研究对西藏羊八井地区牦牛酸乳中筛选出的38株乳酸菌进行体外益生特性的筛选,为优良特性益生菌的研究及应用提供依据。
1材料与方法
1.1材料与试剂
从西藏羊八井地区传统发酵牦牛酸乳中分离出的38株未知乳酸菌,西南大学食品科学学院保藏。
MRS肉汤、琼脂、胃蛋白酶(1∶10 000)、牛胆盐、琼脂糖:生化试剂,北京索莱宝科技有限公司。巯基乙酸钠、二甲苯、盐酸:分析纯,成都市科龙化工试剂厂。PBS缓冲液:生化试剂,海克隆生物化学制品有限公司。λDNA/HindⅢ、6×DNA Loading Buffer、100 bp DNA Ladder、细菌基因组DNA提取试剂盒(DP302)、2×TaqPCR MasterMix:天根生化科技(北京)有限公司。上游引物27F(5′-AGAGTTTGATCCTGGCTCA-3′)、下游引物1495R(5′-CTACGGCTACCTTGTTACGA-3′):由生工生物工程(上海)股份有限公司合成。
1.2仪器与设备
水浴恒温振荡器(DSHZ-300A),苏州市培英实验设备有限公司;隔水式恒温培养箱(GHP-9160),上海齐欣科学仪器有限公司;洁净工作台(SW-CJ-2F),苏州安泰空气技术有限公司;离心机(5810),德国Eppendorf公司;生物显微镜(OLYMPUS-BX43),日本奥林巴斯公司;pH计(PHS-3C),上海仪电科学仪器股份有限公司;BioSpec-Mini紫外分光光度计,日本岛津公司;梯度PCR仪(S1000 Thermal Cycler),美国Bio-Rad公司;小型水平电泳槽(Mini-Sub Cell GT),美国Bio-Rad公司;Gene Genius凝胶成像系统,英国SynGene公司。
1.3方法
1.3.1乳酸菌的活化、镜检
将已纯化并保藏于甘油中的38株乳酸菌从-20 ℃冰箱中取出,待其恢复至室温后,分别吸取100 μL接种于MRS液体培养基中,水浴恒温振荡器37 ℃、150 r/min培养24 h,如此连续活化2代。取活化2代后的菌液1.5 mL,3 000 r/min 离心10 min,用接种环挑取少量沉淀均匀的涂于载玻片上,革兰氏染色[4]、镜检,确定各菌株是否为纯种。
1.3.2乳酸菌耐受人工胃液的测定
人工胃液[5]:0.2% NaCl、0.35% 胃蛋白酶,用1 mol/L的HCl调整pH为3.0,过滤除菌备用。
取活化后的菌株培养液5 mL,3 000 r/min离心10 min后收集菌体,用无菌生理盐水洗涤2次,重悬于5 mL生理盐水中制成菌悬液,将配制好的菌悬液与人工胃液按1∶9体积比混合,摇匀后置于恒温培养箱中37 ℃培养3 h,分别于0 h、3 h测定活菌数[5],按公式(1)计算存活率:

(1)
1.3.3乳酸菌胆盐中生长效率的测定
选用在人工胃液中存活率大于70%的菌株进行该实验。按2%的接种量取过夜培养的菌液分别接种于含0.0、0.3%、0.5%、1.0%的牛胆盐的MRS-THIO培养基(MRS培养基中加0.2%的巯基乙酸钠),在恒温培养箱中37 ℃培养24 h后,以空白培养基(未接种的MRS-THIO培养基)为对照,对上述不同质量浓度培养基的OD600 nm值进行测定[6],按照公式(2)计算菌株对胆盐的耐受力:

(2)
1.3.4乳酸菌细胞表面疏水性的测定
选用在人工胃液中存活率大于70%的菌株进行该实验。用BATH[7](碳烃化合物黏着法)对菌株表面疏水性进行测定:取培养好的菌液5 mL,3 000 r/min 离心10 min 收集菌体。以5 mL PBS (50 mmol/L,pH 6.5) 缓冲液洗涤菌体2次。以PBS缓冲液为空白对照,用PBS缓冲液调整菌体浓度,使其OD560 nm值约为1.00。取4 mL调整好菌体浓度的菌液于10 mL无菌离心管中,加入0.8 mL二甲苯,对照组不加二甲苯,振荡30 s,停顿10 s,后再振荡30 s,静置5 ~ 10 min分层,取下层水相,以PBS缓冲液为空白对照,测定OD560 nm值。按照公式(3)计算其疏水率(A0和A分别是与二甲苯混匀前、后菌液的OD560 nm值)。

(3)
1.3.5优良乳酸菌16S rDNA分析
由于在体外筛选中,单一指标的好坏不能全面反映菌体益生特性,应根据实验指标综合比较得出优良益生特性乳酸菌。按细菌基因组DNA提取试剂盒说明书提取优良益生特性菌株总DNA(模板)。PCR反应体系为25 μL:模板1 μL,引物27F、1495R各1 μL,2×TaqPCR Master Mix 12.5 μL,加无菌超纯水补足至25 μL。PCR反应条件:94 ℃ 5 min;94 ℃ 40 s,55 ℃ 40 s,72 ℃ 1 min,共35个循环;72 ℃ 10 min。反应结束后,取5 μL PCR产物用1.5% 琼脂糖凝胶电泳进行检测后,将PCR产物送华大科技有限公司测序。测序成功后,通过NCBI中的BLAST程序对所得16S rDNA序列进行比对分析。
1.3.6系统发育树的构建
从Gene Bank中调取8个种的乳酸菌序列作为参考序列,用Clustalx 1.83软件中的Alignment程序进行多序列匹配比对,再用MEGA 5.0软件中Kimura 2-parameter模式计算遗传距离,Neighbor-Joining构建优良菌株的同源序列系统发育树,系统发育树的每个分支采用自举法进行置信度检测,自举数据集为1 000[8-10]。
1.3.7数据处理
每个实验重复3次,用Excel 2003处理实验数据,结果以“平均值±标准方差”来表示。
2结果与讨论
2.1乳酸菌活化菌株镜检
如图1所示,乳酸菌活化菌株经革兰氏染色后,在显微镜下为蓝紫色,呈革兰氏阳性,符合乳酸菌特征。细胞形态结构均一,表明乳酸菌未被污染,可进行后续实验。

图1 乳酸菌革兰氏染色结果(10×1 000)Fig.1 Gram staining results of LAB(10×1 000)
2.2不同乳酸菌对人工胃液的耐受性
益生菌进入肠道之前先经过胃部,所以抗胃液能力是益生菌筛选的首要条件[11]。通常人体中胃液的pH为3.0左右,消化时间在1~3 h之间。实验通过乳酸菌在pH 3.0人工胃液中消化3 h后的存活力评价各菌株耐受性,筛选出具有良好耐受性的乳酸菌。由表1可知,从牦牛酸乳中分离出的38株乳酸菌,除
2株不能耐受pH 3.0人工胃液生长外,其余36株均能生长,但生长差异明显,存活率介于3.83%~98.36%之间 。表明乳酸菌对人工胃液具有不同的耐受力,其中YBJ-8、YBJ-12、YBJ-15、YBJ-17、YBJ-18、YBJ-23、YBJ-30、YBJ-33和YBJ-36的存活率在90%以上,活菌数大于108,表现出很好的耐受性。存活力大于70%的乳酸菌有17株,占耐受人工胃液菌株的47.22%。妥彦峰等[12]研究4株乳酸杆菌在模拟胃液中耐受力,M5AL、J23AL存活率高;G15AL、T3AL 在胃液中暴露3 h后失去活性。张和平等[5]研究内蒙古酸马奶样品中分离的乳酸杆菌耐受模拟胃液能力,除了L.caseiZhang存活率较高外,其他实验菌株均小于60%。由此可见,牦牛酸乳中分离出的乳酸菌抗酸能力好。对于不同乳酸菌抗酸能力的差异,陈霞[13]认为与质子泵机制、酸耐受反应机制、大分子保护和修复、碱生成等有关。此外,调控子、细胞密度和生物膜也可能影响乳酸菌的抗酸性。

表1 乳酸菌人工胃液耐受性测定结果
注:“-”表示不生长。
2.3不同胆盐浓度下乳酸菌的生长效率
益生菌进入肠道后,小肠中的胆盐对益生菌有抑制作用,因此,菌株对胆盐的耐受力常作为筛选益生菌的重要指标之一[14]。通常人体中胆盐的质量浓度在0.03%~0.3%的范围内波动。由表2可知,人工胃液中存活率大于70%的乳酸菌在不同质量浓度的胆盐中均能生长,随着胆盐质量浓度的增加生长效率有所下降。原因在于高浓度胆盐容易使细胞膜通透性改变、膜内蛋白质解离,最终导致细胞内物质流出,部分细胞死亡[15]。各菌株在胆盐中的生长效率均有不同。相比之下,YBJ-1、YBJ-3、YBJ-8、YBJ-15、YBJ-30和YBJ-33在胆盐中生长较好,其中YBJ-1和YBJ-8在0.3%胆盐中生长情况最好,生长效率分别是无胆盐情况的40.30%和35.72%。

表2 乳酸菌生长效率测定结果
2.4不同乳酸菌的疏水性
在益生菌体外筛选中,菌体表面疏水性的大小[16]反映菌体在体内定殖的能力的强弱,疏水能力大,则乳酸菌黏附力好,定植能力强。由表3可知,不同乳酸菌对二甲苯的吸附能力有所不同。其中,YBJ-3、YBJ-11、YBJ-15、YBJ-16、YBJ-17、YBJ-19、YBJ-22、YBJ-30和YBJ-33的疏水率都大于65%,对二甲苯具有良好的吸附能力;而YBJ-1、YBJ-10、YBJ-12、YBJ-18和YBJ-23的疏水率都在50%以下,对二甲苯的吸附能力相对较弱。
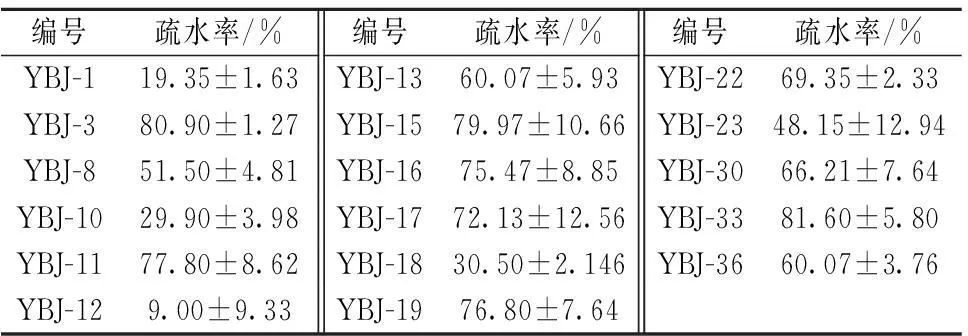
表3 乳酸菌疏水性测定结果
2.5优良益生菌株16S rDNA序列分析
通过对牦牛酸乳中分离出的乳酸菌进行抗人工
胃液、胆盐中生长效率和疏水性的测定,综合比较得出菌株编号为YBJ-3、YBJ-11、YBJ-15、YBJ-17、YBJ-30和YBJ-33乳酸菌的益生特性好。图2是这6株乳酸菌总DNA经PCR扩增、电泳后的结果。由图可知,PCR扩增后的目的片段接近1 500 bp,条带无拖尾现象、清晰明亮,阴性对照无条带,说明PCR扩增效果较好。

Marker-100bp DNA Ladder; 0-阴性对照,1-YBJ-3;2-YBJ-11; 3-YBJ-15; 4-YBJ-17; 5-YBJ-30; 6-YBJ-33图2 优良菌株16S rDNA扩增产物琼脂糖凝胶电泳图Fig.2 Agarose gel electrophoresis of the selected strains 16S rDNA amplified products
表4为这6株优良益生特性乳酸菌16S rDNA序列通过BLAST程序比对分析结果。

表4 优良菌株鉴定结果
2.6系统发育树
由图3可知,实验菌株涉及肠球菌属和乳杆菌属。YJB-3与YJB-15属于肠球菌属,YJB-3以99%的自举支持率与屎肠球菌处于同一分支上;YJB-15以97%的自举支持率与耐久肠球菌聚在同一分支,二者亲缘关系较近,差异小。YJB-11、YJB-17、YJB-30和YJB-33属于乳杆菌属,其中YJB-17和YJB-30以100%的自举支持率与植物乳杆菌聚在一起;YJB-33以100%的自举支持率与干酪乳杆菌聚在一起;YJB-11以100%的自举支持率与发酵乳杆菌聚在一起。可见,系统发育树分析结果与16S rDNA序列分析结果相一致。系统发育树中,各分支长度间的差异代表物种进化程度的高低。
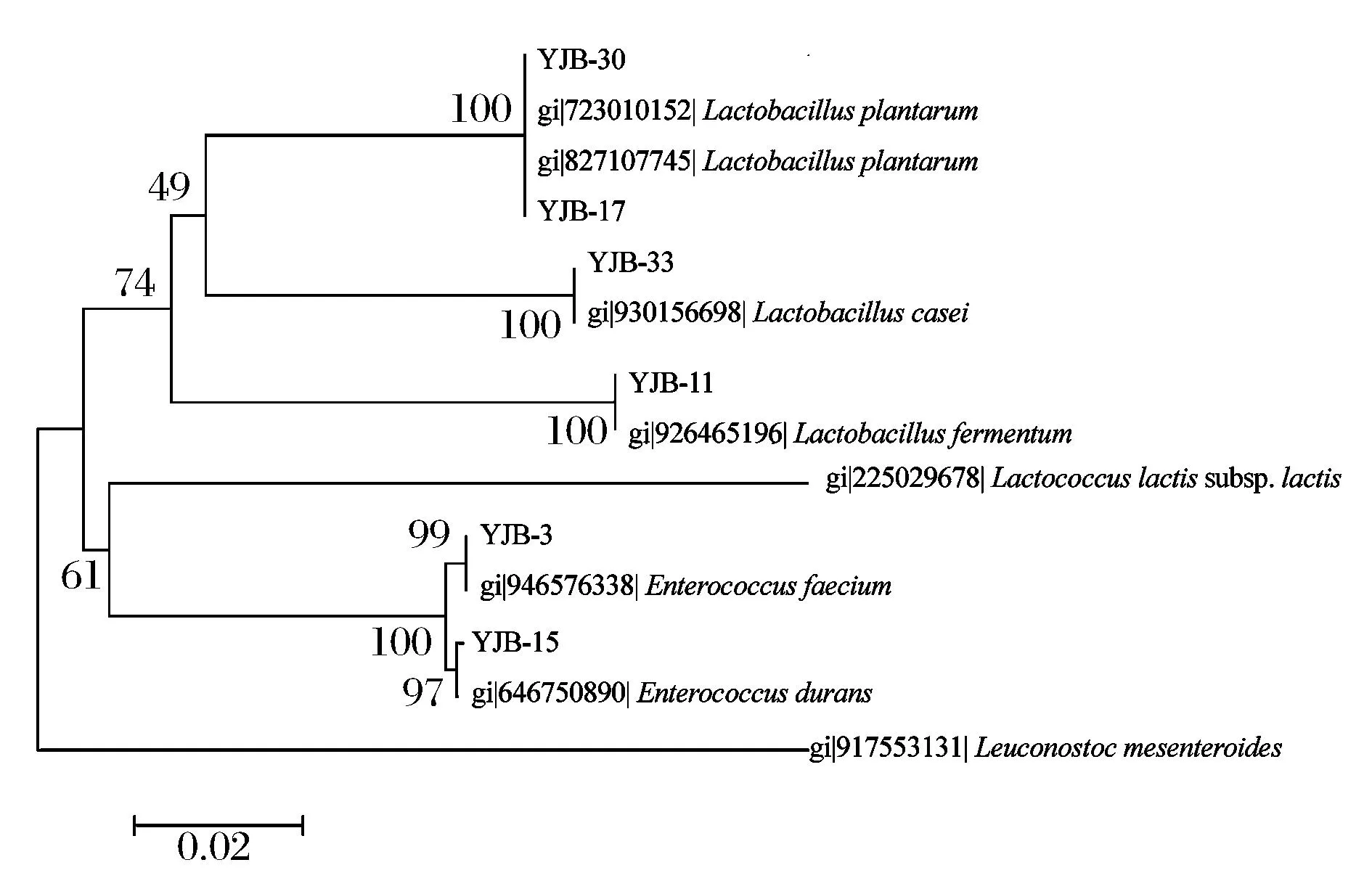
图3 基于优良菌株16S rDNA序列的系统发育树Fig.3 Phylogenetic tree based on the selected strains 16S rDNA sequences
3结论
乳酸菌作为主要的益生菌,其益生特性的好坏一直是国内外学者研究益生菌的重要基础。研究表明,益生性乳酸菌具有调节肠道内菌群平衡、抑制胆固醇吸收、抗氧化、抗肿瘤和预防癌症等功能。其来源主要有开菲尔、奶酪和藏灵菇等。本实验所用菌株来源于青藏高原羊八井地区的传统发酵牦牛酸乳中,牦牛酸奶因其制作工艺和独特的地理环境及气候条件,使得牦牛酸奶中微生物菌群与传统发酵食品中微生物菌群存在差异。通过对牦牛酸乳中分离出的38株乳酸菌的抗人工胃液、胆盐中生长效率和细胞表面疏水性的筛选数据,得出菌株编号为YBJ-3、YBJ-11、YBJ-15、YBJ-17、YBJ-30和YBJ-33的益生特性较好,其中人工胃液处理后存活率最高达96.05%,在胆盐中均能良好生长,疏水能力好。
目前益生菌的研究主要针对活性菌株,其中以乳杆菌属中植物乳酸菌和干酪乳杆菌的研究为主。实验通过对优良菌株16S rDNA序列分析鉴定得到1株干酪乳杆菌、1株屎肠球菌、1株耐久肠球菌和2株植物乳杆菌。其中屎肠球菌和耐久肠球菌为食品上不可用菌,干酪乳杆菌、植物乳杆菌和发酵乳杆菌可用于食品工业,且具备良好益生菌的基本特性,值得进一步研究。
参考文献
[1]RODOLPHE B,ERIC A,ROBERT H,et al.Functional and comparative genomic analyses of an operon involved in fructooligosaccharide utilization byLactobacillusacidophilus[J].Proceedings of the National Academy of Sciences of the United States of America,2003,100(15):8 957-8 962.
[2]LI Wei,JI Juan,RUI Xin,et al.Production of exopolysaccharides byLactobacillushelveticusMB2-1 and its functional characteristicsinvitro[J].Lebensmittel-Wissenschaft und-Technologie,2014,59(2):732-739.
[3]王辑,顾芸佳,马文慧,等.内蒙古奶豆腐中潜在益生性乳酸菌的筛选[J].食品科学,2014,35(13):171-177.
[4]BENSALAH F,DELORME C,RENAULT P.Characterisation of thermotolerant cocci from indigenous flora of ‘leben’ in Algerian arid area and DNA identification of atypicalLactococcuslactisstrains[J].Current Microbiology,2009,59(2):139-146.
[5]张和平,孟和毕力格,王俊国,等.分离自内蒙古传统发酵酸马奶中L.caseiZhang潜在益生特性的研究[J].中国乳品工业,2006,4(4):4-10.
[6]赵欣,骞宇.牦牛酸乳分离发酵乳杆菌发酵豆浆的胃溃疡预防效果研究[J].食品科学,2014,35(17):236-240.
[7]POWTHONG P,SUNTORNTHI P.Isolation,identification and analysis of probiotic properties of lactic acid bacteria from selective various traditional Thai fermented food and Kefir[J].Pakistan Journal of Nutrition,2015,14:67-74.
[8]NOURA El-Ahmady E N,HAROUN S A,OWEIS E A,et al.Identification of newly isolatedTalaromycespinophilusand statistical optimization of β-glucosidase production under solid-state fermentation[J].Preparative Biochemistry & Biotechnology,2015,45(7):712-729.
[9]TAMURA K,PETERSON D,PETERSON N,et al.MEGA5: Molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods[J].Molecular Biology and Evolution,2011,28(10):2 731-2 739.
[10]ENNAHAR S,CAI Y,FUJITA Y.Phylogenetic diversity of lactic acid bacteria associated with paddy rice silage as determined by 16S ribosomal DNA analysis[J].Applied and Environmental Microbiology,2003,69(1):69-444.
[11]PATEL A,PRAJAPATI J B,HOLST O,et al.Determining probiotic potential of exopolysaccharide producing lactic acid bacteria isolated from vegetables and traditional Indian fermented food products[J].Food Bioscience,2014,5:27-33.
[12]妥彦峰,张伟钦,张兰威,等.Lactobacillus菌株的益生功能评价[J].现代食品科技,2012,8(8):906-910.
[13]陈霞,乌日娜,孟和,等.乳酸菌耐酸机理[J].中国乳品工业,2008,3(3):30-34.
[14]PAN Xiao-dong,CHEN Fen-qin,WU Tian-xing.The acid, bile tolerance and antimicrobial property ofLactobacillusacidophilusNIT[J].Food Control,2009,20(6):598-602.
[15]BEGLEY M,GAHAN C G M,HILL C.The interaction between bacteria and bile[J].FEMS Microbiology Reviews,2005,29(4):625-651.
[16]王昕,侯聚敏,付丽丽,等.产β-半乳糖苷酶乳酸菌的筛选及其益生性研究[J].中国乳品工业,2012,40(8):20-23.
Invitroscreening of lactic acid bacteria with probiotic properties from traditional fermented Yak yogurt
CHEN Xiao-yong1,2, LI Jian3,4, ZHAO Xin5,QIAN Yu5, CHEN Lian-hong3,4, CHEN Juan4, SUO Hua-yi1,2,*
1(College of Food Science, Southwest University, Chongqing 400715, China) 2(Chongqing Engineering Research Center of Regional Food, Chongqing 400715, China) 3(Institute of Qinghai-Tibetan Plateau, Southwest University for Nationalities, Chengdu 610041, China) 4(College of Life Science and Technology, Southwest University for Nationalities, Chengdu 610041, China) 5(Department of Biological and Chemical Engineering, Chongqing University of Education, Chongqing 400067, China)
ABSTRACTIn order to obtain lactic acid bacteria with potentially probiotic properties, 38 strains isolated from traditional fermented Yak yogurt in the Yambajan-Tibet were studied by test in vitro. The viability of simulated gastric fluid, growth efficiency in bile salt and cell surface hydrophobicity had been examined. The results showed that YBJ-3, YBJ-11, YBJ-15, YBJ-17, YBJ-30 and YBJ-33 strains had good probiotic properties. 4 of these strains had good resistance of over 90% to simulated gastric fluid and grow well in the bile salt. And 6 strains were identified by 16S rDNA sequence analysis. The YBJ-3 was identified as Enterococcus faecium, YBJ-11 as Lactobacillus fermentum, YBJ-15 as Enterococcus durans, YBJ-17 and YBJ-30 as Lactobacillus plantarum, YBJ-33 as Lactobacillus casei. According to the regulations of the ministry of health in China, Lactobacillus fermentum, Lactobacillus plantarum and Lactobacillus casei can be used in food industry, and thus they can be considered as potential probiotic in functional fermented dairy products.
Key wordsYak yogurt; lactic acid bacteria; probiotic; screening
收稿日期:2015-11-24,改回日期:2016-01-14
基金项目:国家公益性行业(农业)科研专项(201203009);重庆市社会民生科技创新专项(cstc2015shmszx80021);重庆市特色食品工程技术研发中心能力提升项目(cstc2014pt-gc8001)
DOI:10.13995/j.cnki.11-1802/ts.201604016
第一作者:硕士研究生(索化夷副教授为通讯作者,E-mail:birget@swu.edu.cn)。

