中温α-淀粉酶基因在枯草芽孢杆菌中的高效表达及其发酵条件优化
张士彬,陈景奇,崔艳艳, 谢能中,王敏,张大伟*
1(天津科技大学 生物工程学院,天津,300457) 2(中国科学院 天津工业生物技术研究所,天津,300308) 3(广西科学院,非粮生物质酶解国家重点实验室,国家非粮生物质能源工程技术研究中心,广西 南宁,530007)
中温α-淀粉酶基因在枯草芽孢杆菌中的高效表达及其发酵条件优化
张士彬1,2,陈景奇2,崔艳艳1, 谢能中3,王敏1,张大伟2*
1(天津科技大学 生物工程学院,天津,300457) 2(中国科学院 天津工业生物技术研究所,天津,300308) 3(广西科学院,非粮生物质酶解国家重点实验室,国家非粮生物质能源工程技术研究中心,广西 南宁,530007)
摘要以枯草芽孢杆菌为表达系统,以中温α-淀粉酶为目标蛋白,研究了启动子和信号肽对外源蛋白表达分泌的影响。分别选取了4种启动子以及8种信号肽来进行筛选,结果表明,启动子PAprE的强度最高,信号肽SPnprE的分泌效率最好。针对重组菌株1A751Q31进行系统的发酵优化,在72 h发酵液中α-淀粉酶酶活达到380 U/mL。在7.5 L发酵罐中进行放大实验,发酵液中α-淀粉酶酶活最高达到853 U/mL。以上研究表明,α-淀粉酶适合在枯草芽孢杆菌中进行表达,同时表明枯草芽孢杆菌是良好的异源蛋白表达系统。
关键词枯草芽孢杆菌;α-淀粉酶;启动子;信号肽;发酵优化
芽孢杆菌属中的革兰氏阳性菌作为生产和分泌蛋白的微生物,在工业领域已经被广泛应用[1]。芽孢杆菌属作为工业微生物,拥有实用廉价的大规模生产系统,其目标蛋白分泌量在培养基中可以达到20~25 g/L。目前市场上可以购买到的酶制品大约有60%是由芽孢杆菌属生产的[2-3]。在芽孢杆菌属中,枯草芽孢杆菌被广泛应用于异源蛋白的表达。与大肠杆菌相比较,枯草芽孢杆菌被称为安全无害(GRAS)的表达系统[4]。在枯草芽孢杆菌中,尽管同源蛋白的生产已经取得了较高的生产水平,某些同源蛋白的分泌量可以达到g/L的级别[5],但是异源蛋白的生产却通常不令人满意。而且在应用枯草芽孢杆菌表达系统时,仍然存在一些瓶颈限制其表达分泌:如转录、蛋白折叠、膜转运、信号肽加工、蛋白酶水解等等[6]。而其中转录与膜转运是两个最为主要的限制因素。因此在应用枯草芽孢杆菌表达系统表达分泌外源蛋白时,必须要解决这两方面瓶颈,从而获得目标蛋白的高水平表达分泌。
在多个工业领域,酶制剂已经替代了以前使用的化学方法来进行底物水解,从而在工业流程中大大降低了环境污染,同时也使得加工过程更加方便。众所周知,α-淀粉酶能够促进淀粉以及α-葡聚糖中的α-1,4-糖苷键的水解[7]。作为糖基水解酶GH-13家族中的一员[8],其水解产物为糊精、低聚糖和单糖。由于α-淀粉酶在食品、医药、化学制品等领域[7]都有广泛应用,如淀粉液化、焙烤行业、洗涤工业、纺织品退浆、造纸工业和燃料乙醇等等,因此市场对其有很大的需求,约占据酶制剂25%[9]的市场份额。
在本研究中,以α-淀粉酶为目标蛋白,运用枯草芽孢杆菌表达系统对其进行分泌表达。通过对表达元件的优化,包括启动子和信号肽的选择与优化,突破或减弱枯草芽孢杆菌表达系统表达异源蛋白的限制,以实现α-淀粉酶在枯草芽孢杆菌中的高效表达。后续工作中,又对产α-淀粉酶的枯草芽孢杆菌工程菌株进行系统的发酵优化,并在7.5 L发酵罐中进行放大实验。这些研究工作对中温α-淀粉酶的工业化生产有一定的帮助作用,同时对枯草芽孢杆菌表达异源蛋白也提供了一些参考意义。
1材料与方法
1.1材料
1.1.1菌株和质粒
文中所用菌株与质粒均列于表1中,所用引物均列于表2中。

表1 菌株与质粒
注:aAmerican Type Culture Collection;bBGSC,BacillusGenetic Stock Center。
1.1.2酶和试剂
dNTP和DNA聚合酶Q5购自MBI Fermentas,DNA聚合酶PrimerSTAR Mix购自Takara,2×TaqPCR MasterMix, DNA Marker (Marker Ⅲ和1 kb Marker )和细菌基因组DNA提取试剂盒(DP302-02)购于北京天根生化科技有限公司,质粒小提试剂盒(D6943-02)和柱式PCR产物纯化试剂盒(D6492-02)购自OMEGA,其余试剂均为进口或国产分析纯级。
1.1.3培养基
LB(g/L):酵母粉5,蛋白胨10,Nacl 10。121 ℃灭菌20 min。固体培养基中另加入琼脂粉15。
SR(g/L):酵母粉25,蛋白胨15,K2HPO43。pH 7.0,121 ℃灭菌20 min。
发酵罐培养基(g/L):可溶性淀粉20,酵母粉25,蛋白胨15,K2HPO43。121 ℃灭菌30 min。
补料培养基(g/L):可溶性淀粉50,酵母粉50。121 ℃灭菌30 min。
可根据需要,在各培养基中分别添加相应抗生素:氨苄青霉素100 μg/mL;卡那霉素50 μg/mL。
1.2方法
1.2.1培养条件
大肠杆菌以LB培养基进行培养,枯草芽孢杆菌以SR培养基进行培养发酵。大肠杆菌以及枯草芽孢杆菌培养温度均为37 ℃。摇瓶发酵时,采用250 mL三角瓶,装液量为30 mL,摇床转速为220 r/min。
1.2.2α-淀粉酶基因的克隆以及包含不同启动子及信号肽的表达质粒的构建
本实验所用引物均列于表2中。α-淀粉酶基因以纯化过的解淀粉芽孢杆菌ATCC23844基因组为模板通过PCR技术扩增获取。本实验中所用质粒载体均运用“Simple cloning”方法构建[10]。4个启动子(PHpaⅡ,PApre,PsacB和Pglv)以及8个信号肽(SPAmyQ,SPsacB,SPamyE,SPnprE,SPpel,SPphoA,SPlipA和SPphoD)被用来构建不同重组载体,具体流程如图1。下面以pMAQ1的构建为例进行说明。

表2 引物
续表2

底物序列(5’-3’)PPglv-RCGTTTTTGAATCATCATATGTAAATCCTC-CTTGATAACGTTTACAATTCPMA5-F3GTAAATGGCACGCTGATGCAGPMA5-R3CATATGTCTTTACCCTCTCCPnprE-FGGAGAGGGTAAAGACATATGCATAT-GGGTTTAGGTAAGAAATTGTCTGPnprE-RAAAATACTGCATCAGCGTGCCATTTA-CAGCCTGAACACCTGGCAGGCPaprE-FGGAGAGGGTAAAGACATATGAGAAG-CAAAAAATTGTGGATCAGCPaprE-RGCATCAGCGTCCCATTAAGATTTGCAGC-CTGCACAGACATGTTGCTGAACPlipA-FGGAGAGGGTAAAGACATATGAAATTTGTAAAAAGAAG-GATCATTGPlipA-RAATACTGCATCAGCGTGCCATTTACAGCG-GCTTTTGCTGACGGCTGCAACPpel-FGGAGAGGGTAAAGACATATGAAAAAAGTGATGTTAGCPpel-RCTGCATCAGCGTGCCATTTACTGCGT-TCGCGCCAGCTGGAGPamyE-FGGAGAGGGTAAAGACATATGTTTG-CAAAACGATTCAAAACCPamyE-RAATACTGCATCAGCGTGCCATTTACAG-CACTCGCAGCCGCCGGTCCTGCCPsacB-FGGAGAGGGTAAAGACATATGAACAT-CAAAAAGTTTGCAAAACPsacB-RCTGCATCAGCGTGCCATTTACCG-CAAACGCTTGAGTTGCGCCTCCTGCCPphoA-FGGAGAGGGTAAAGACATATGAAAAAAAT-GAGTTTGTTTCPphoA-RCTGCATCAGCGTGCCATTTACAGCTCCG-GCAAAGATTCCAGCTGTAAGGPphoD-FGGAGAGGGTAAAGACATATGGCATACGACAGTCGTTTTGPphoD-RCTGCATCAGCGTGCCATTTACAGCATT-TACTTCAAAGGCCCCAACCG

图1 重组质粒的构建Fig.1 Construction of expression vector pMAQ
运用细菌基因组DNA试剂盒提取解淀粉芽孢杆菌基因组,并以其为模板,以PAmyQ-F和PAmyQ-R为引物,运用PCR技术扩增出携带自身信号肽(SPAmyQ)的完整amyQ基因。以PMA5-F1和PMA5-R1为引物,以质粒pMA5为模板,扩增出pMAQ1的载体骨架。扩增出的两段线性DNA片段的5'端和3'端都包含20~50 bp的重叠末端。以这些片段为模板,运用POE-PCR (prolonged overlap extension PCR)技术扩增出DNA多聚体,并把产物转化大肠杆菌DH5α感受态细胞,得到重组质粒pMAQ1。其余携带不同启动子与信号肽的重组质粒均以此方式构建。
1.2.3产α-淀粉酶重组枯草芽孢杆菌工程菌株的构建
将1.2.2中的重组质粒运用化学转化法转化宿主枯草芽孢杆菌1A751感受态细胞[11],经过卡那霉素抗性筛选出阳性克隆,进行摇瓶发酵。
1.2.4摇瓶培养条件的优化
(1)碳源优化。分别以可溶性淀粉、豆饼粉、豆粕粉、麸皮、玉米浆干粉、葡萄糖、蔗糖、木糖、麦芽糖和乳糖为碳源(20 g/L的添加量),进行摇瓶发酵,SR培养基为对照。
(2)氮源优化。分别选取豆饼粉、玉米浆、蛋白胨、酵母粉、磷酸氢二铵、硫酸铵和氯化铵为氮源(20 g/L的添加量),以淀粉为碳源,进行摇瓶发酵。
(3)不同金属离子及添加剂对发酵结果的影响。分别在培养基中添加2 g/L的ZnSO4、FeCl3、MgSO4、CaCl2、MnSO4、NaCl、FeSO4、Tween-20和Tween-80,进行摇瓶发酵。
(4)发酵温度优化。工程菌株分别在30 ℃、37 ℃、42 ℃和45 ℃条件下,进行摇瓶发酵。
(5)初始pH值优化。分别调节培养基初始pH值为7.0、7.5、8.0和8.5,进行摇瓶发酵。
1.2.57.5 L发酵罐发酵评价
发酵采用总体积7.5 L发酵罐(BioFlo 310,New Brunswick Scientific CoInc., USA),工作体积为3.5 L。发酵过程中,温度维持37℃,pH值维持在7.0~7.5(pH值通过滴加体积分数为40% 的H3PO4或者溶液浓度为5 mol/L的 KOH来维持),并且通过对通风量与搅拌速率的控制使溶氧(DO)维持在20% ~ 40%的范围。初始培养基为发酵罐培养基(1.1.3),另加入50 μg/mL的卡那霉素。发酵时间18 h时,以补料培养基进行补料操作,直至发酵周期结束(72 h)。
1.2.6酶活测定
酶活测定方法参照国标法(GB8275—2009)。1 mL液体酶,于60 ℃,pH 6.0条件下,1 h液化1 g可溶性淀粉,即为1个酶活力单位(U/mL)。
1.2.7重组蛋白的SDS-PAGE分析
取不同培养时间的发酵液,离心(12 000×g,10 min,4 ℃),取上清,加入5×SDS-PAGE样品缓冲液后在沸水中煮15 min,样品进行SDS-PAGE(分离胶浓度为12%,浓缩胶浓度为5% )。电泳结束后凝胶染色2 h,将脱色后的凝胶用 Bio-Rad 凝胶成像系统照相 。
2结果与讨论
2.1不同启动子的筛选
启动子的强度直接影响异源蛋白的表达效率,因此强启动子的优化常用于提高基因的表达。本实验中选取枯草芽孢杆菌中常用的四种强启动子来提高淀粉酶基因的转录表达,其中包括两个组成型启动子(PHpaⅡ和PApre)以及两个诱导型启动子(PsacB和Pglv,诱导剂分别为蔗糖和麦芽糖)。包含不同启动子的重组质粒分别为:pMAQ1(PHpaⅡ),pMAQ2(PsacB),pMAQ3(PApre)和pMAQ4(Pglv)。分别将其转化B.subtilis1A751,得到重组菌株1A751Q1,1A751Q2,1A751Q3和1A751Q4。包含不同启动子菌株经摇瓶发酵72 h后,进行酶活检测,结果如图2所示。

1-菌株1A751Q3; 2-菌株1A751Q1; 3-菌株1A751Q2; 4-菌株1A751Q4图2 包含不同启动子的重组菌株产α-淀粉酶酶活比较Fig.2 Comparison of α-amylase production in recombinant strains with different promoters.
从图2可以看出组成型启动子(PHpaⅡ和PApre)表达效果强于诱导型启动子(PsacB和Pglv)。并且菌株1A751Q3(PApre)酶活最高达到135 U/mL,相较于其他菌株酶活将近高出100%。表明在4种启动子中,启动子PApre是最有效的启动子。
2.2不同信号肽的筛选
在分泌型蛋白表达分泌时,信号肽起到决定性作用[12]。信号肽主要包括3个区域:带正电的N末端,称为碱性氨基末端;中间疏水序列,以中性氨基酸为主,是信号肽的主要功能区;较长的带负电荷的C末端,含小分子氨基酸,是信号序列切割位点[13-14]。其主要功能有3方面:(1)防止胞内新合成肽链折叠,以维持转运构象并避免激活有损害作用的酶;(2)与其它分泌装置成分相互作用并指导跨膜过程;(3)膜上前蛋白拓扑结构的决定因子。总之,信号肽对于整个分泌过程有重要影响。因此,为了实现α-淀粉酶的高效分泌,寻找合适的信号肽是十分必要的。
基于前面4种启动子中选出的最合适启动子PApre,将研究中经常使用的信号肽(SPAmyQ,SPsacB,SPamyE,SPnprE,SPpel,SPphoA,SPlipA,SPphoD)与α-淀粉酶基因amyQ融合,以强启动子PApre来启动其表达。将重组质粒pMAQ31(SPnprE),pMAQ32(SPpel),pMAQ33(SPphoA),pMAQ34(SPlipA),pMAQ35(SPamyE),pMAQ36 (SPSacB)和pMAQ37(SPphoD)分别转化B.subtilis1A751,得到重组菌株1A751Q31,1A751Q32,1A751Q33,1A751Q34,1A751Q35,1A751Q36和1A751Q37。将以上重组菌株进行摇瓶发酵,在72 h取样并进行酶活检测,结果如图3所示。

1-菌株1A751Q31; 2-菌株1A751Q32; 3-菌株1A751Q33; 4-菌株1A751Q34; 5-菌株1A751Q35; 6-菌株1A751Q36; 7-菌株1A751Q37; 8-对照菌株1A751Q3图3 包含不同信号肽的重组菌株产α-淀粉酶酶活比较Fig.3 Comparison of α-amylase production in recombinant strains with different signal peptides
从图3可以很明显地看出,只有菌株1A751Q31,1A751Q32和1A751Q33酶活相较于对照组有所提高。SPAmyQ,SPsacB和SPamyE均为依赖Sec分泌途径的信号肽。依赖Tat分泌途径的菌株1A751Q37(SPphoD)酶活最低,重组菌株1A751Q31酶活最高,达到274 U/mL。表明信号肽SPnprE为最合适的信号肽,而基于Tat途径的信号肽并不适宜α-淀粉酶的分泌。
2.3摇瓶培养条件优化
2.3.1碳源优化
对前面产酶最高的重组菌株1A751Q31进行发酵条件优化。不同碳源对发酵结果影响见图4a。从图中可以看出,不同碳源对α-淀粉酶的生产有不同影响。相较于其他碳源,以淀粉为碳源时酶活达到326 U/mL,明显高于其他碳源。可能淀粉既作为碳源,又对α-淀粉酶的生产起到一定的诱导作用,因为淀粉是α-淀粉酶的作用底物。以葡萄糖、蔗糖为碳源时,发酵液中几乎没有酶活,可能由于葡萄糖效应抑制α-淀粉酶的表达[15]。后续实验中,我们又对淀粉添加量进行了优化(图4b),最终得出,添加20 g/L的淀粉最为合适。

a-不同碳源对发酵结果的影响; b-不同浓度淀粉对发酵结果的影响图4 碳源优化Fig.4 Optimization of the carbon source
2.3.2氮源优化
不同氮源对发酵结果影响见图5a。从图中能够看出,蛋白胨为最佳氮源,菌株发酵酶活可达到380 U/mL。而使用无机氮源时菌体几乎不再产酶,可能菌株在利用无机氮源时不能很好地合成蛋白,而且加入无机氮源后导致发酵后期发酵液pH值过高,可能会影响菌体正常生长代谢。后续实验中,对蛋白胨添加量进行优化(图5b),最终得出,添加20 g/L的蛋白胨最为合适。

a-不同氮源对发酵结果的影响; b-不同浓度蛋白胨对发酵结果的影响图5 氮源优化Fig.5 Optimization of the nitrogen source
2.3.3不金属离子及同添加剂对产酶影响
不同金属离子及添加剂对发酵结果影响见图6。从图6可以看出,大部分金属离子及添加剂对α-淀粉酶的发酵都有明显抑制作用,可能这些离子及添加剂影响菌体的生长代谢,影响到α-淀粉酶的合成和分泌,或者影响到酶分子的构象,致使酶活性降低。

图6 不同添加剂对发酵结果影响Fig.6 Effects of different additives on the fermentation
2.3.4温度及培养基初始pH值对产酶影响
温度及培养基初始pH值对发酵结果影响分别见图7a与7b。从图7a可以看出,温度过高和过低均不利于α-淀粉酶的生产。37 ℃为最佳温度。从图7b可以看出初始pH值为7或7.5时,酶活相差无几。但是从pH 7.5以后,随着pH值的升高,酶活呈明显的下降趋势,可能pH值过高超出了酶的最适pH值,最终致使酶损失部分活性。这表明pH值过高(尤其超过7.5)并不利于α-淀粉酶的生产。

a-温度对发酵结果的影响; b-初始pH值对发酵结果的影响图7 温度及培养基初始pH值对发酵结果影响Fig.7 Effects of temperature and initial pH value on the results of fermentation
2.4发酵罐评价
结合摇瓶优化结果,用7.5 L发酵罐对重组菌株进行放大发酵评价,发酵结果如图8。从图8a中可以看出,菌株在30 h后进入平稳期,酶活仍持续增长。在60 h时,酶活达到最大值853 U/mL,随后酶活与生物量均有所下降,表明发酵已进入末尾期。从发酵液上清的SDS-PAGE分析中(图8b)也可以看出酶量的积累过程与发酵曲线相吻合。
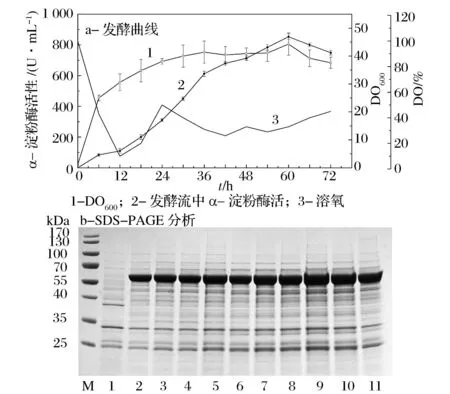
M-Marker; 1-对照菌株1A751; 2-18 h; 3-24 h; 4-30 h; 5-36 h; 6-42 h; 7-48 h; 8-54 h; 9-60 h; 10-66 h; 11-72 h图8 5 L发酵罐中重组菌株1A751Q31产α-淀粉酶发酵结果Fig.8 Production of α-amylase in the recombinant strain 1A751Q31 by fed-batch fermentation in a 7.5 L fermentor
3结论
强启动子的使用是提高蛋白表达量常用的策略之一。枯草芽孢杆菌中常用的启动子有两类:组成型启动子和诱导性启动子。两类启动子各有利弊,组成型启动子可以使目标蛋白持续表达从而实现目标蛋白在胞内或胞外大量表达,无需成本较贵的诱导剂。但同时存在目标蛋白对菌体有害和表达可控性较差的缺点[16]。诱导型启动子具有可以控制基因转录开始与停止的独特优势。使用诱导型启动子,可以根据具体情况需要,对基因的表达进行调控。比如,可以使细胞密度达到一定程度时再开启目标蛋白的表达,从而将目标蛋白表达对细胞带来的伤害降到最低。因此,选择合适的强启动子对于增强异源蛋白的表达有重要意义。
信号肽结构是前体蛋白进行转运的一个限制性因素,因此为了获得高水平的的目标蛋白,选择一个适合的信号肽是十分重要的。由于不同物种来源的信号肽存在一定的差异,因而在枯草芽孢杆菌中表达异源分泌蛋白时,异源分泌蛋白的天然信号肽不一定在枯草芽孢杆菌中能够有效指导底物进入蛋白质分泌程序。也就是说,异源分泌蛋白的天然信号肽与枯草芽孢杆菌的内源分泌系统兼容性不一定好。所以,通过更换或改造异源分泌蛋白的天然信号肽能够增加异源蛋白在枯草芽孢杆菌中的分泌量。
微生物发酵的生产水平不仅取决于生产菌种本身的性能,而且要提供合适的发酵条件,才能使它的生产能力充分发挥出来。优化发酵工艺可以充分发挥菌种的潜在能力,提高发酵过程的生产效率,降低生产成本。因此,工艺优化的研究尤其重要。
本文通过基因克隆将来源于解淀粉芽孢杆菌的α-淀粉酶基因amyQ在B.subtilis1A751中实现异源表达。并通过对启动子以及信号肽等表达元件的优化,从4种强启动子(PHpaⅡ,PApre,PsacB和Pglv)及8种信号肽(SPAmyQ,SPsacB,SPamyE,SPnprE,SPpel,SPphoA,SPlipA和SPphoD)中分别筛选出最适宜枯草芽孢杆菌表达分泌α-淀粉酶的启动子PApre以及信号肽SPnprE。通过对重组菌株发酵条件的初步优化,最终使发酵液中α-淀粉酶酶活达到380 U/mL。经7.5 L发酵罐放大,在60 h时,发酵液中酶活达到峰值853 U/mL。本研究对于α-淀粉酶生产有一定借鉴作用,同时可以对运用枯草芽孢杆菌表达异源蛋白提供指导。
参考文献
[1]DEGERING C,EGGERT T,PULS M,et al.Optimization of protease secretion inBacillussubtilisandBacilluslicheniformisby screening of homologous and heterologous signal peptides[J].Applied and Environmental Microbiology,2010,76(19):6 370-6 376.
[2]FU L L,XU Z R,LI W F,et al.Protein secretion pathways inBacillussubtilis: implication for optimization of heterologous protein secretion[J].Biotechnology Advances,2007,25(1):1-12.
[3]SCHALLMEY M,SINGH A,WARD O P.Developments in the use ofBacillusspecies for industrial production[J].Canadian Journal of Microbiology,2004,50(1):1-17.
[4]WESTERS L,WESTERSS H,QUAX W J.Bacillussubtilisas cell factory for pharmaceutical proteins:a biotechnological approach to optimize the host organism[J].Biochimica et Biophysica acta,2004,1 694(1-3): 299-310.
[5]SIMONEN M,PALVA I.Protein secretion inBacillusspecies[J].Microbiological Reviews,1993,57(1):109-137.
[6]LI W,ZHOU X,LU P.Bottlenecks in the expression and secretion of heterologous proteins inBacillussubtilis[J].Research in Microbiology,2004,155(8):605-610.
[7]JANECEK S,SVENSSON B,MACGEGOR E A.Alpha-amylase: an enzyme specificity found in various families of glycoside hydrolases[J].Cellular and Molecular Life Sciences:CMLS,2014,71(7):1 149-1 170.
[8]AVDIIUK K V,VARBANETS L D.Microbial alpha-amylases:physicochemical properties,substrate specificity and domain structure[J].Ukrains′kyi Biokhimichnyi Ahurnal,2013,85(4):5-19.
[9]PANDEY A,NIGAM P,SOCCOL C R,et al.Advances in microbial amylases[J].Biotechnology and Applied Biochemistry,2000,31( Pt 2):135-152.
[10]YOU C,ZHANG X Z,ZHANG Y H.Simple cloning via direct transformation of PCR product (DNA Multimer) toEscherichiacoliandBacillussubtilis[J].Applied and Environmental Microbiology,2012,78(5):1 593-1 595.
[11]SPIZIZEN J.Transformation of bichemically deficient strains ofBacillussubtilisby deoxyribonucleate[J].Proceedings of the National Academy of Sciences of the United States of America,1958,44(10):1 072-1 078.
[12]CHEN J Q,GAI Y M,FU G,et al.Enhanced extracellular production of alpha-amylase inBacillussubtilisby optimization of regulatory elements and over-expression of PrsA lipoprotein[J].Biotechnology Letters,2015,37(4):899-906.[13]KANG Z,YANG S,DU G,et al.Molecular engineering of secretory machinery components for high-level secretion of proteins inBacillusspecies[J].Journal of industrial microbiology & biotechnology,2014,41(11):1 599-1 607.
[14]ZANEN G,HOUBEN E N,MEIMA R,et al.Signal peptide hydrophobicity is critical for early stages in protein export byBacillussubtilis[J].The FEBS Journal,2005,272(18):4 617-4 630.
[15]HASELTINE C,ROLFSMEIER M,BLUM P.The glucose effect and regulation of α-amylase synthesis in the hyperthermophilic Archaeon Sulfolobus solfataricus[J].Journal of Bacteriology,1996,178(4):945-950.
[16]YING Q,ZHANG C,GUO F,et al.Secreted expression of a hyperthermophilic alpha-amylase gene fromThermococcussp. HJ21 inBacillussubtilis[J].Journal of Molecular Microbiology and Biotechnology,2012,22(6):392-398.
High level expression of medium α-amylase inBacillussubtilisand optimization of fermentation conditions
ZHANG Shi-bin1, CHEN Jing-qi2,CUI Yan-yan1, XIE Neng-zhong3, WANG Min1, ZHANG Da-wei2*
1(College of Biotechnology, Tianjin University of Science and Technology, Tianjin 300457, China) 2(Tianjin Institute of Biotechnology, Chinese Academy of Sciences, Tianjin 300308, China) 3(Guangxi Academy of Sciences, State Key Laboratory of Non-Food Biomass and Enzyme Technology,National Engineering Research Center For Non-food Biorefinery, Nanning 530007, China)
ABSTRACTIn this study, the effect of promoter and signal peptide on the expression of heterologous model protein, α-amylase, was studied by using Bacillus subtilis as the expression system. Four promoters and eight signal peptides were compared, and the best promoter and signal peptide for the expression and secretion of α-amylase were identified. The results indicated that PAprEand SPnprEwere the most suitable for the production of α-amylase in B.subtilis. The fermentation of the recombinant B. subtilis 1A751Q31 was then optimized, and the activity of α-amylase in the supernate achieved 380 U/mL. Fed-batch fermentation in a 7.5 L fermentor was carried out, and the activity of α-amylase in the supernate reached 853 U/mL. All the studies in this paper indicated that it was suitable for the expression of α-amylase using B. subtilis as the expression system, and B. subtilis was a suitable system for expression of heterologous proteins.
Key wordsBacillus subtilis; α-amylase; promoter; signal peptide; optimization of fermentation
收稿日期:2015-10-18,改回日期:2015-12-04
基金项目:国家自然科学基金 (No. 31370089, 21446008, 31400079); 广西省科技支撑项目 (14125008-2-22)
DOI:10.13995/j.cnki.11-1802/ts.201604010
第一作者:硕士研究生(张大伟研究员为通讯作者,E-mail:zhang_dw@tib.cas.cn)。

