5-肼基四唑高氯酸含能配合物的合成、表征及性能
张至斌, 张建国, 许彩霞, 殷 昕, 何 飘
(北京理工大学爆炸科学与技术国家重点实验室, 北京 100081)
1 引 言
近年,以四唑及其衍生物为配体的含能配合物受到含能材料研究工作者越来越多的重视[1-5]。四唑环骨架为平面结构,氮含量80%,其同分异构体包括1H-四唑,2H-四唑和5H-四唑,相比于后两者,目前常用的为1H-四唑,其结构中含有离域大π键,机械感度较低,安定性良好[6-8]。1H-四唑及其取代衍生物中含有大量的N—N、C—N和NN键,使其具有较高的正生成热,有助于化合物提高热稳定性,并能形成多种结构稳定且具有独特性能的含能配合物[9-14]。
在1H-四唑衍生物中,5-肼基四唑(5-HT)氮含量可达84%,并且具有芳香性。研究发现,以5-HT为配体合成的金属高氯酸配合物对激光较为敏感,具有良好的起爆性能[15-19]。盛涤伦等[20-21]合成了激光敏感起爆药高氯酸·5-肼基四唑汞(HTMP),并对其进行结构表征和感度性能方面的研究。
本研究在已有研究的基础上,探究以肼基四唑为配体的其他金属配合物的性能。以5-HT为配体,在水溶液中与对应高氯酸盐M(ClO4)2(M=Cd、Zn、Ni、Co、Mn)反应,制得5种肼基四唑高氯酸含能配合物[Cd(HT)6](ClO4)2(1),[Zn(HT)6](ClO4)2(2),[Ni(HT)3](ClO4)2(3),[Co(HT)6](ClO4)2(4),[Mn (HT)6](ClO4)2(5),并对其进行结构表征、性能测试和理论计算,为其在含能材料领域中的应用奠定基础。
2 实验部分
2.1 试剂和仪器
金属硝酸盐、高氯酸、盐酸、无水乙醇等为市售分析纯试剂,5-HT为实验室自制[20-21]。
Flash EA1112全自动微量元素分析仪; 德国Bruker公司Equinox 55型傅里叶变换红外光谱仪(KBr压片,扫描范围4000~400 cm-1,分辨率4 cm-1); 美国Parr6200氧弹量热仪; 美国Perkin-Elmer公司Pyris-1型热分析仪(流动N2气氛,流速 20 mL· min-1,升温速率10 ℃· min-1)。
2.2 合成原理
5-肼基四唑高氯酸配合物的制备分两步进行。第一步,由5-氨基四唑为原料制备5,5′-偶氮四唑钠,进而在盐酸中将5,5′-偶氮四唑钠分解重结晶制备5-HT。第二步,由高氯酸提供强无机酸环境,5-HT与对应的金属硝酸盐发生反应,制得5-肼基四唑高氯酸配合物。合成路线见Scheme 1。

Scheme 1 Synthesis of perchlorate complexes with 5-HT as ligand
2.3 实验步骤
5-HT的合成过程参照文献[20-21],得率约40%。
取1.001 g(10 mmol)5-HT溶解于20 mL蒸馏水中,加入浓度为70%的高氯酸20 mL,作为底液。取5 mmol的M(NO3)2(M=Cd、Zn、Ni、Co、Mn)溶于10 mL蒸馏水中作为滴加液,在20 ℃下缓慢滴加到底液中。滴加完毕后继续反应60 min,停止搅拌,静置。过滤,取滤出物用水洗,无水乙醇洗涤,干燥得细粉状产物。
元素分析(%): [Cd(HT)6](ClO4)2(1)计算值(实测值): C 7.90 (7.81),H 2.65 (2.63),N 55.30 (55.21); [Zn(HT)6](ClO4)2(2)计算值(实测值): C 8.33 (8.41),H 2.80 (2.86),N 58.31 (58.15); [Ni(HT)3](ClO4)2(3)计算值(实测值): C 6.46 (6.52),H 2.17 (2.10),N 45.72 (44.86); [Co(HT)6](ClO4)2(4)计算值(实测值): C 8.40 (8.49),H2.82 (2.80),N 58.75 (58.82); [Mn(HT)6](ClO4)2(5)计算值(实测值): C 8.44(8.36),H 2.83 (2.87),N 59.02 (58.46)。
3 结果与讨论
3.1 5-肼基四唑高氯酸配合物的红外光谱分析
5-肼基四唑高氯酸配合物的红外图谱如图1所示。并与文献[20]报道的5-HT红外图谱进行比较。
配合物1:ν(cm-1)=3333,3244,3212,3000,2934,1647,1560,1504,1377,1184,1118,1035,999,501。
配合物2:ν(cm-1)=3303,3231,1639,1558,1497,1296,1167,1033,753,566。
配合物3:ν(cm-1)=3272,1626,1538,1202, 1105,1030,833,756,626,524。
配合物4:ν(cm-1)=3243,3274,1631,1551,1376,1194,1097,1026,841,758,626,503。
配合物5:ν(cm-1)=3332,3205,2990,1645,1560,1501,1375,1188,1043,993,755,510。

图1 5-HT高氯酸配合物的红外谱图
Fig.1 FTIR spectra of perchlorate complexes with 5-HT as ligand and 5-HT
与5-HT红外谱图相比,配合物1-5的谱图具有明显变化。金属离子与5-HT形成配位键后,—NH—NH2上N—H键的极性减弱, N—H伸缩振动产生的宽吸收带消失,同时四唑环上N—H键极性发生变化,其由于伸缩振动产生的吸收峰消失。1200~1700 cm-1处表示四唑环扭曲及伸缩振动的吸收峰仍存在。指纹区900~1100 cm-1处表示N—N、N—H单键伸缩振动以及N—H键弯曲振动的吸收峰发生较大变化。ClO4-的吸收峰位于1000 cm-1处。
3.2 5-肼基四唑高氯酸配合物的热分析
对5-肼基四唑高氯酸配合物在四种不同升温速率(5,10,15,20 ℃·min-1)下进行差示扫描量热分析(DSC)测试。升温速率为10 ℃·min-1时,5种配合物的DSC曲线如图2所示。由图2可知,5种配合物均有剧烈放热峰,且其初始分解温度均高于200 ℃,表明5-肼基四唑高氯酸配合物具有较好的热稳定性。由于中心金属离子不同,导致5种配合物的放热分解过程不尽相同: 配合物1具有两个放热过程,第一放热峰始于273.4 ℃终于304.1 ℃,峰温为288.7 ℃; 第二放热峰始于311.5 ℃终于365.8 ℃,峰温350.6 ℃。配合物2放热较少,放热峰始于351.1 ℃终于382.2 ℃,峰温373.5 ℃。配合物3包括两个放热过程,第一放热峰始于265.6 ℃终于319.8 ℃,第二放热峰始于357.9 ℃终于376.3 ℃,对应峰温为295.1 ℃和367.4 ℃。配合物4与1热分解过程相近,包括两个放热过程,第一放热峰始于230.4 ℃终于318.1 ℃,第二放热峰始于338.8 ℃终于376.2 ℃,对应峰温为276.1 ℃和355.4 ℃。配合物5只有一个放热过程,其放热峰非常尖锐,始于323.6 ℃终于352.5 ℃,峰温344.8 ℃。

图2 5-肼基四唑高氯酸配合物的DSC曲线
Fig.2 DSC curves of perchlorate complexes with 5-HT as ligand
依照GJB5891.28-2006,对制备合成的5-HT高氯酸配合物进行定容燃烧热(Qv)测试。采用Parr 6200全自动氧弹量热仪,选用1104型氧弹,充氧1 min,使弹内气压达到3.0 MPa,以保证氧弹内样品能充分燃烧。测试条件为室温25 ℃,相对湿度30%,药量500 mg。经六次平行试验,测试结果如表1所示。
表1 5种配合物的燃烧热
Table 1 Heat of combustion (Qv) for five complexes

complexQv/MJ·kg-118.51326.29735.84147.78358.963
由表1可知,5种配合物燃烧时释放热量大小顺序为: 5>1>4>2>3,且均具有良好的燃烧性能,表明其具有较好的含能特性。
根据Kissinger法[22]和Ozawa-Doyle法[23]计算目标配合物1-5的放热分解反应的表观活化能Ea和指前因子A。测定五种5-肼基四唑高氯酸配合物在四种不同线性升温速率(5,10,15,20 ℃·min-1)下的DSC曲线,得到其第一放热分解峰温(Tp)并列于表2,两种方法计算得到的热力学参数见表3。
(1)
(2)
式中,Tp为第一放热分解峰温,由DSC曲线得到,℃;R为理想气体常数,8.314 J·mol-1·℃-1;β为线性升温速率,℃·min-1;C为常数。
表2 不同升温速率下5种配合物的第一放热分解峰温
Table 2 Peak temperatures of the first exothermic stage of complex 1-5 at different heating rate

heatingrate/℃·min-1peaktemperature/℃123455278.6366.8287.9259.7339.710288.7374.5295.1276.1344.815295.4379.4303.3281.1350.320301.2382.4309.8287.2354.7
表3 5种配合物的非等温动力学参数
Table 3 Non-isothermal kinetic parameters of complexes 1-5

complex12345EK/kJ·mol-1153.5296.8158.9116.1280.1lg(AK/s-1)12.2422.0912.548.97621.79RK-0.9982-0.9998-0.9820-0.9906-0.9843EO/kJ·mol-1154.8292.5160.2119.0276.1RO-0.9984-0.9998-0.9840-0.9919-0.9845
Note:Eis apparent activation energy,Ais pre-exponential factor,Ris linear correlation coefficient, The subscript K and O represent Kissinger′s method and Ozawa′s method, respectively.
由表3可以看出,两种方法计算配合物1-5的表观活化能有所差异,结合其DSC曲线(图2)可以看出,配合物2的热稳定性最好,其次为配合物5,热稳定性顺序为: 2>5>3>1>4。
3.3 理论计算
为了进一步研究配体5-HT的电子结构性质及其配位关系,使用Gaussian 09程序[24],采用密度泛函理论,在B3LYP/6-311++g**水平上,对其进行几何结构优化,并计算其振动频率,振动频率均为正值,表明该分子为势能面上的稳定驻点; 在获得优化几何构型的基础上,进行自然键轨道(NBO)分析,得到分子中各原子NBO电荷分布情况; 分析分子表面静电势极值分布,以此研究其可能的活性配位点; 最后计算其最高占据分子轨道(HOMO)-最低未占据分子轨道(LUMO)及跃迁能级差,考察其前线轨道组成成分,进一步研究分子结构的稳定性。
3.3.1 几何结构
图3为优化得到的5-HT的几何构型,表4列出了优化结构的部分几何参数。
由表4可知,5-HT分子中大部分N原子与C原子在同一平面,而肼基上的N原子则相对于环平面有一定角度(N(1)—N(6)—C(5)—N(4): 179.2°,N(4)—C(5)—N(6)—N(7): 3.0°); 四唑环上N—N和C—N键长均在1.3~1.4 Å,说明π电子的离域使得键长趋于平均化,环上原子所成键角近似为
108°左右,说明分子趋向于稳定的五元环结构; 分子中C,N均是sp2杂化,但由于N原子上有孤对电子,N相互靠近排斥力较大,从而造成角度存在一定偏差。整体看来,5-HT分子存在共轭效应,从而有利于其结构稳定。

图3 5-肼基四唑(5-HT)优化几何构型
Fig.3 The optimal geometric configuration of 5-HT
表4 在B3LYP/6-311++g**水平下5-HT几何优化参数
Table 4 Selected parameters of 5-HT after geometry optimization at B3LYP/6-311++g**

bondlength/Åbondangle/(°)dihedralangle/(°)N(1)—N(2)1.36N(1)—N(2)—N(3)105.9N(1)—N(2)—N(3)—N(4) 0.4N(2)—N(3)1.28N(1)—C(5)—N(6)122.7N(2)—N(1)—C(5)—H(1) 173.7N(3)—N(4)1.36N(2)—N(3)—N(4)112.0N(2)—N(3)—N(4)—C(5) -0.7N(4)—C(5)1.31C(5)—N(6)—N(7)116.0N(4)—C(5)—N(6)—H(6) -136.2C(5)—N(1)1.35N(3)—N(4)—C(5)105.6N(1)—N(6)—C(5)—N(4) 179.2N(6)—N(7)1.41C(5)—N(6)—H(6)113.8C(5)—N(6)—N(7)—H(7a) -88.0N(1)—H(1)1.01N(4)—C(5)—N(1)108.4N(4)—C(5)—N(6)—N(7) 3.0N(6)—H(6)1.01N(6)—N(7)—H(7a)112.5C(5)—N(6)—N(7)—H(7b) 148.1N(7)—H(7a)1.01N(2)—N(1)—H(1)120.5N(7)—H7(b)1.01N(6)—N(7)—H(7b)109.1C(5)—N(6)1.38
3.3.2 NBO电荷
在优化得到5-HT的几何结构的基础上,对分子进行自然键轨道(NBO)分析,其NBO电荷分布如表5所示。从NBO电荷分布来看,分子中由于N原子的电负性高于C、H原子,使得N原子均带负电荷,而C、H原子显示出较高的正电性,其中,C(5)原子(0.52 a.u.)所带正电荷最高。此外,四唑环上的N原子所带负电荷较少,而环外肼基上N原子所带负电荷较多,这是—NH2吸电子的诱导效应所导致的结果; 比较所有N原子电荷大小可知,N(1)、N(4)、N(6)和N(7)原子所带负电荷最多,因此有可能更容易受到亲核试剂的进攻而发生化学反应。考虑到所有N原子都可能与金属原子配位,以及N(1)和N(6)原子的空间位阻效应,因而5-HT分子中的N(2)、N(3)、N(4)和N(7)可能参与金属原子配位,形成相应配位化合物。
表5 B3LYP/6-311++g**水平下5-HT的NBO电荷
Table 5 The natural bond orbital(NBO)charge of 5-HT at the B3LYP/6-311++g**level
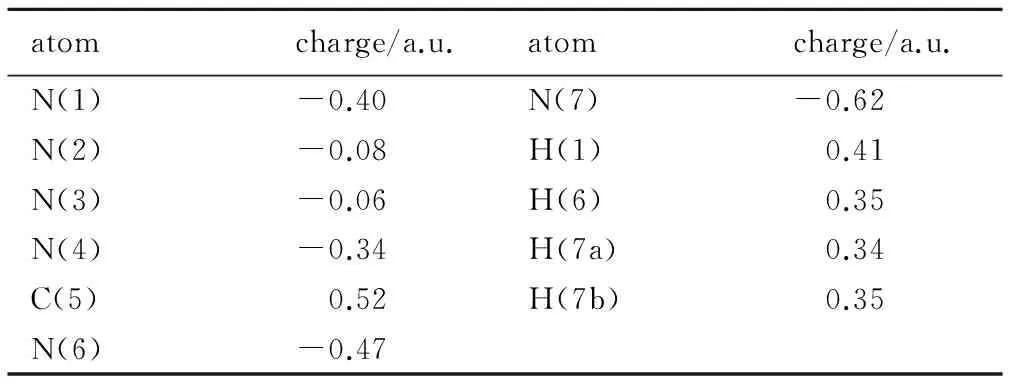
atomcharge/a.u.atomcharge/a.u.N(1)-0.40N(7)-0.62N(2)-0.08H(1)0.41N(3)-0.06H(6)0.35N(4)-0.34H(7a)0.34C(5)0.52H(7b)0.35N(6)-0.47
3.3.3 静电势分析
基于B3LYP/6-311++g**优化的5-HT结构,使用Multiwfn程序[25]中的定量分子表面分析,得到其分子表面静电势极值点分布,如图4所示,红色点表示静电势极大值,蓝色点表示静电势极小值。

图4 5-HT分子表面静电势极值分布(单位: kJ·mol-1)
Fig.4 The electrostatic potential distributions of 5-HT(unit: kJ·mol-1)
由图4可知,分子表面的静电势各有4个极大值点和5个极小值点,这是由于电子和原子核的共同作用导致的; 静电势极大值点都分布在H原子附近,而极小值点分布在部分N原子周围,这主要是N原子的电负性高于H原子的缘故。其中,四唑环上N(3)、N(4)原子周围的静电势值最小,其值为-187.61 kJ·mol-1和-191.11 kJ·mol-1,表明该处电子分布较密。考虑空间阻碍效应和原子进攻的方位,结合NBO电荷分布和静电势极值点分布情况(图4),可以预测四唑环上的N(3)和N(4)原子更容易参与金属原子配位,形成以5-HT为配体的配位化合物。
3.3.4 HOMO-LUMO轨道
HOMO反映给电子能力,LUMO反映接受电子的能力,它们共同构成分子前线轨道(FMOs),并且HOMO-LUMO的能级差大小反映分子的稳定性及反应活性。图5为5-HT的HOMO-LUMO轨道及能极差示意图。
由图5可知,HOMO主要由四唑环和肼基上的原子轨道提供,这表明电子集中分布在四唑环和肼基所处的位置,从而可以预测四唑环上的N原子为主要的电子供体,成为潜在的配位活性位点; 此外,HOMO表面存在π轨道在四唑环上的CN之间发生离域的现象,这有利于分子紧密连接在一起。而LUMO则主要是由肼基上的H原子轨道贡献,由此说明该部位容易得到电子,可能易受亲核试剂的进攻而发生化学反应。计算HOMO-LUMO的能级差为6.1057 eV,说明分子中存在电荷转移相互作用,电子容易从HOMO轨道跃迁到LUMO轨道,从而影响分子稳定性及化学反应活性。

图5 在B3LYP/6-311++g**水平下5-HT HOMO-LUMO轨道及能极差示意图
Fig.5 The orbital of HOMO-LUMO of 5-HT at the B3LYP/6-311++g**level
3.4 感度特性
按照GJB5891.22-2006、GJB5891.24-2006,对目标配合物1-5撞击和摩擦感度进行测试。撞击感度测试条件为20 mg,800 g落锤; 摩擦感度测试条件为90°摆角,1.96 MPa。测试结果见表6。
表6 5种配合物的感度测试结果
Table 6 Sensitivities of five complexes

compleximpactsensitivity/cmfrictionsensitivity/%1nofire02nofire0345.68425965nofire0HTMP[21]23.792BNCP[21]13.886
由表6可知,配合物4的摩擦感度较高,为96%,其特性落高(H50)为25 cm,其机械感度与肼基四唑汞(HTMP)和高氯酸·四氨·双(5-硝基四唑)合钴(Ⅲ)(BNCP)相当; 其次为配合物3,摩擦感度8%,特性落高(H50)为45.6 cm,其余配合物在此条件下均不发火。
4 结 论
(1) 5-HT为配体合成5种肼基四唑高氯酸配合物,并对其进行结构表征,其燃烧热(Qv)分别为8.513(1),6.297(2),5.841(3),7.783 MJ·kg-1(4)和8.963 MJ·kg-1(5)。
(2) 通过DSC分析发现5种配合物分解温度高于200 ℃,表明其热稳定性良好。运用Kissinger法和Ozawa-Doyle法对五种配合物的表观活化能进行计算,分别为154.2(1),294.7(2),159.6(3),117.6 kJ·mol-1(4)和278.1 kJ·mol-1(5)。其热稳定性顺序为2>5>3>1>4。
(3) 为研究配体5-HT的配位结构和配位能力,通过对5-HT的理论研究,分析了其电子结构、NBO电荷、静电势分布以及前线轨道分布,预测了其与金属离子形成配合物时可能的配位原子位置。表明5-HT四唑环上的N(3)和N(4)原子更容易同时参与金属原子配位,形成以5-肼基四唑为配体的配位化合物。
(4) 对目标配合物进行感度测试,结果表明: 高氯酸配合物系列中,配合物4在90°摆角、1.96 MPa条件下摩擦感度为96%,800 g落锤下,撞击感度H50为25 cm,其机械感度与HTMP和BNCP相当,有望应用于起爆药领域。
参考文献:
[1] Huynh M, Michael D C, Thomas J M, et al. Green primary explosives: 5-nitrotetrazolato-n2-ferrate hierarchies[J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica, 2006, 103(27): 10322-10327.
[2] Huynh M, Michael A H, Thomas J M, et al. Green primaries: environmentally friendly energetic complexes[J].EnvironmentalSciences, 2006, 103(14): 5409-5412.
[3] 盛涤伦,马凤娥,孙飞龙,等. BNCP起爆药的合成及其主要性能[J]. 含能材料, 2000, 8(3): 100-103.
SHENG Di-lun, MA Feng-e, SUN Fei-long, et al. Study on synthesis and main poroperties of BNCP[J].ChineseJournalofEnergeticMaterials(HannengCailiao), 2000, 8(3): 100-103.
[4] 徐松林, 阳世清, 岳守体, 等. 偶氮四唑类高氮含能化合物的合成及表征[J]. 火炸药学报, 2005, 28(3): 52-54.
XU Song-lin, YANG Shi-qing, YUE Shou-ti, et al. Synthesis and characterization of high- nitrogenenergetic compounds derived from azotetrazolate[J] .ChineseJournalofExplosives&Propellants, 2005,28(3): 52- 54.
[5] 周素芹,居学海,肖鹤鸣,等. 四唑与水二聚体相互作用的理论研究 [J]. 火炸药学报, 2005, 28(4): 1-4,13.
ZHOU Su-qin, JU Xue-hai,XIAO He-ming, et al.Theoreticalstudy on intermolecular interactions oftetrazole-waterdimers[J] .ChineseJournalofExplosives&Propellants, 2005,28(3): 52- 54.
[6] Joo Y H, Twamley B. Carbonyl and oxalyl bridged bis(1,5-diaminotetrazole)-based energetic salts[J].Chemistry:aEuropeanJournal, 2009, 15(36): 9097-9104.
[7] SHANG Jing, ZHANG Jian-guo, ZHANG Tong-lai, et al. Theoretical study of energetic complexes (Ⅲ): bis-(5-nitro-2htetrazolato-N2) tetraammine cobalt(Ⅲ) perchlorate (BNCP) and its transition metal (Ni/Fe/Cu/Zn) perchlorate analogues[J].ChineseJournalofChemistry, 2012, 30(7): 1624-1630.
[8] 盛涤伦, 朱雅红, 蒲彦利, 等. 新一代起爆药设计与合成研究进展[J]. 含能材料, 2012, 20(3): 263-272.
SHENG Di-lun, ZHU Ya-hong, PU Yan-li, et al. Development of a new-generation primary explosives designing and synthesis[J].ChineseJournalofEnergeticMaterials(HannengCailiao), 2012, 20(3): 263-272.
[9] David A, Dixon D F, Karl O C ,et al. Enthalpies of formation of gas-phase N3, N3-, N5+, and N5-from Ab initio molecular orbital theory, stability predictions for N5+,N3-and N5+,N5-, and experimental evidence for the instability of N5+,N3-[J].JournaloftheAmericanChemicalSociety, 2004, 126(3): 834-843.
[10] Fischer N, Klapötke T M, Piercey D G, et al. Hydroxylammonium 5-nitriminotetrazolates[J].ZeitschriftfurAnorganischeandAllgemeineChemie, 2012, 638(2): 302-310.
[11] Fischer N, Joas M, Klapötke T M, et al. Transition metal complexes of 3-amino-1-nitroguanidine as laser ignitible primary explosives: structures and properties[J].InorganicChemistry, 2013, 52(23): 13791-13802.
[12] Klapötke T M, Piercey D G. 1, 1′-azobis(tetrazole): a highly energetic nitrogen-rich compound with a N10 chain[J].InorganicChemistry, 2011, 50(7): 2732-2734.
[13] Joo Y H, Twamley B. Energetic nitrogen-rich derivatives of 1,5-aiaminotetrazole[J].AngewChem, 2008, 47(33): 6236-6239.
[14] 李志敏,张建国,刘俊伟,等. 固体火箭技术[J]. 1,5-二氨基四唑含能配合物的制备、表征及其催化性能研究, 2011, 34(1): 79-85.
LI Zhi-min, ZHANG Jian-guo, LIU Jun-wei, et al. Synthesis, characterization and catalytic activity of energetic complexes based on 1,5-diaminotetrazole[J].JournalofSolidRocketTechnology, 2011, 34(1): 79-85.
[15] Skocypec R D, Mahoney A R, G1ass M W, et al. Modeling laser iginition of explosives and pymtechnicseffects and characterization of radiative transfer[C]∥Proceedings of the15 th Intemational Pyrotechnic Seminar,1990: 877-894.
[16] Ilyushin M A, Tselinsky I V, Zhilin A Yu, et a1.Coordination complexes as inorganic explosives for initiation systems[J].ChineseJournalofEnergeticMaterials(HannengCailiao),2004,12(1): 15-19.
[17] Ilyushin M A, Tselinsky I V, Bachurina I V, et al. Laser initiation of complex perchlorates of d-metals with heterocyclic ligands[J].ChineseJournalofEnergeticMaterials(HannengCailiao),2006, 14(6): 401-405.
[18] 彭蕾, 李玉川, 杨雨璋, 等. 双环和多环四唑含能化合物的合成研究进展[J]. 有机化学, 2012 (4): 667-676.
PENG Lei, LI Yu-chuan, YANG Yu-zhang, et al. Research progress in synthesis of energetic compounds of bicyclo- and multicyclo-tetrazoles[J].ChineseJournalofOrganicChemistry, 2012(4): 667-676.
[19] 阳世清,岳守体.国外四嗪四唑类高氮含能材料研究进展[J]. 含能材料, 2003, 11(4): 231-235.
YANG Shi-qing, YUE Shou-ti. Progress in High-nitrogen energetic materials derived from tetrazine and tetrazole[J].ChineseJournalofEnergeticMaterials(HannengCailiao),2003, 11(4): 231-235.
[20] 朱雅红, 盛涤伦, 陈利魁, 等. 含能中间体5-肼基四唑的合成及表征[J]. 火炸药学报, 2008, 31(6): 39-41.
ZHU Ya-hong, SHENG Di-lun, CHEN Li-kui, et al. Synthesis and characterization of energetic intermediate 5- hydrazinotetrazole[J].ChineseJournalofExplosives&Propellants, 2008, 31(6): 39-41.
[21] 朱雅红, 盛涤伦, 杨斌, 等. 激光敏感起爆药高氯酸·5-肼基四唑汞的合成和性能[J]. 含能材料, 2009, 17(2): 169-172.
ZHU Ya-hong, SHENG Di-lun, YANG Bin, et al. Synthesis and properties of laser sensitivity primary explosive 5-hydrazinotetrazolemercury perchlorate[J].ChineseJournalofEnergeticMaterials(HannengCailiao),2009, 17(2): 169-172.
[22] Kissinger H E. Reaction kinetics in differential thermal analysis[J].AnalChem, 1957, 19: 1702-1706.
[23] Ozawa T. A new method of analyzing thermogravimetric data bull[J].ChemSocJpn, 1965, 38: 1881-1886.
[24] Frisch M J, Schlegel H B, Scuseria G E, et al. GAUSSIAN 9 (Revision A.01)[CP]; Gaussian, Inc., Wallingford, CT, 2009.
[25] Lu T, Multiwfn. version 1.4: http://multiwfn.codeplex.com/.[2015,03,13]

