依折麦布联合非诺贝特治疗混合型高脂血症的临床疗效和安全性*
马红 谭春燕 陈海燕 张荣驿 刘杰
依折麦布联合非诺贝特治疗混合型高脂血症的临床疗效和安全性*
马红1谭春燕2陈海燕2张荣驿2刘杰2
(1.重庆长航医院内科, 重庆 400042; 2.川北医学院附属医院心内科, 四川 南充 637000)
目的 观察依折麦布联合非诺贝特治疗混合型高脂血症的临床疗效和安全性。 方法 选择2012年8月~2014年10月于我院确诊的混合型高脂血症患者128例,随机分为两组各64例。对照组给予非诺贝特(200mg/d)治疗,观察组给予依折麦布(20mg/d)和非诺贝特(200mg/d)联合治疗3个月,检测两组患者治疗前后的总胆固醇(total cholesterol,TC)、三酰甘油(triglyceride,TG)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)和高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)水平,并分析比较治疗效果和安全性。 结果 ①与治疗前比较,两组患者治疗后的TC、TG、LDL-C水平均明显降低,差异均有统计学意义(均P<0.05),而HDL-C水平明显升高,差异亦有统计学意义(P<0.05);与对照组比较,联合治疗后观察组的TC、TG、LDL-C水平均降低,差异均有统计学意义(均P<0.05),而HDL-C水平增高,差异亦有统计学意义(P<0.05)。②观察组的总有效率(93.75%)明显高于对照组(76.56%),差异有统计学意义(P<0.05)。③观察组出现不良反应的总比例显著低于对照组,差异有统计学意义(P<0.05)。 结论 与单用非诺贝特相比,依折麦布联合非诺贝特能更有效地降低混合型高脂血症患者的血脂水平,且安全性较高,弥补了单用贝特类药物降脂的局限性。
依折麦布; 非诺贝特; 降血脂药; 高脂血症; 血脂异常
高脂血症是指血中总胆固醇和(或)三酰甘油过高或高密度脂蛋白胆固醇过低,又称为血脂异常。血脂异常作为代谢综合征的组成之一,与动脉粥样硬化、冠心病、心肌梗死、高血压、糖尿病、脑卒中、周围血管疾病等密切相关。因此,对血脂异常的干预已经成为目前防治心血管疾病的首要措施。临床常用的调脂药物有他汀、贝特、烟酸、树脂、胆固醇吸收抑制剂、普罗布考、w-3脂肪酸等药物。本文联合应用依折麦布和非诺贝特,对高脂血症患者的血脂变化情况进行观察和临床分析,现将结果报告如下。
1 资料与方法
1.1 临床资料 选取2012年8月~2014年10月在我院确诊的混合型高脂血症患者128例,其中男性79例,女性49例,年龄39~71岁,平均年龄(57.3±5.2)岁,患病时间3~6年,平均4.2年。混合型高脂血症的诊断标准参照我国血脂异常防治建议[1],即:空腹血清检查结果显示血清总胆固醇(TC)超过5.72mmol/L(220mg/dl)和甘油三酯(TG)超过1.70mmol/L(150mg/dl)、LDL-C>3.6mmol/L(140mg/dl)。排除标准:①纯合子家族性高脂血症/高胆固醇症患者。②对依折麦布或非诺贝特有过敏史或严重不良反应者。③由药物(避孕药、合成类固醇和皮质类固醇、噻嗪类利尿剂、β受体阻滞剂等)引起的高脂血症或正在使用可能起调脂作用的药物者。④正在服用与研究药物存在相互作用的药物(抗凝药、大环内酯类抗生素、抗真菌药物、环孢素、HIV蛋白酶抑制剂、地尔硫卓、维拉帕米、胺碘酮)。⑤肝功能异常(丙氨酸氨基转移酶、天门冬氨酸氨基转移酶、胆红素≥1.5倍参考值上限)。⑥慢性肾功能不全(血肌酐≥1.5倍参考值上限)。⑦未控制的甲状腺功能低下。⑧控制不良的糖尿病/高血压。⑨自身免疫性疾病。⑩严重酗酒者、妊娠、哺乳期妇女或近期有生育计划者。将所有患者按照随机数字法分为对照组和观察组各64例。其中对照组男性40例,女性24例,年龄41~71岁,平均年龄(57.4±5.4)岁;观察组男性39例,女性25例,年龄39~70岁,平均年龄(57.2±5.1)岁。两组患者在性别、年龄、体重指数(BMI)、血压、血糖、血脂、合并症等方面差异无统计学意义(P>0.05),具有可比性。所有患者均自愿接受临床治疗及随访,并签署知情同意书。
1.2 方法
1.2.1 治疗方法 对照组单纯给予非诺贝特200mg/d口服治疗,观察组给予依折麦布(商品名:益适纯,进口药品注册证号:H20130837,默沙东公司生产)20mg/d口服和非诺贝特200mg/d,温水送服。两组患者均连续用药3个月。服药期间不改变两组患者的饮食习惯和生活习惯,且不服用干扰血脂代谢的药物。治疗前有服用调脂药物及影响血脂水平药物者停药4~6周。
1.2.2 观察指标及测定方法 所有患者在治疗前和治疗3个月末,空腹12小时并以坐位5min后采集空腹静脉血,在肘正中静脉采取静脉血置入不含抗凝剂的生化试管,室温离心后提取血清。应用罗氏试剂盒(罗氏诊断产品购自上海有限公司)进行血脂检测。用过氧化物酶法测定总胆固醇(TC),用脂蛋白脂酶法测定三酰甘油(TG),用直接一步法测定低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)水平,并观察记录患者的不良反应。
1.3 疗效判定标准 采用1993年我国卫生部制定的《新药临床研究指导原则》的标准:显效(达下列任何1项):TC下降幅度≥20%,TG下降幅度≥40%,LDL-C下降幅度≥20%,HDL-C上升幅度≥0.26mmol/L;有效(达下列任何1项):TC下降幅度10%~20%,TG下降幅度20%~40%,LDL-C下降幅度10%~20%,HDL-C上升幅度0.10~0.26mmol/L;无效:未达到有效标准者。显效率+有效率=总有效率。

2 结果
2.1 两组患者治疗前后血脂浓度比较 与治疗前比较,两组患者治疗后的TC、TG、LDL-C水平均明显降低,差异均有统计学意义(均P<0.05),而HDL-C水平明显升高,差异亦有统计学意义(P<0.05);与对照组比较,联合治疗后观察组的TC、TG、LDL-C水平均降低,差异均有统计学意义(均P<0.05),而HDL-C水平增高,差异亦有统计学意义(P<0.05),见表1。
2.2 两组患者临床疗效比较 联合治疗后观察组的总有效率(93.75%)明显高于对照组(76.56%),差异有统计学意义(P<0.05),见表2。
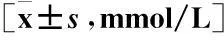
表1 两组患者治疗前后血脂浓度比较
注:与对照组相比,①P<0.05
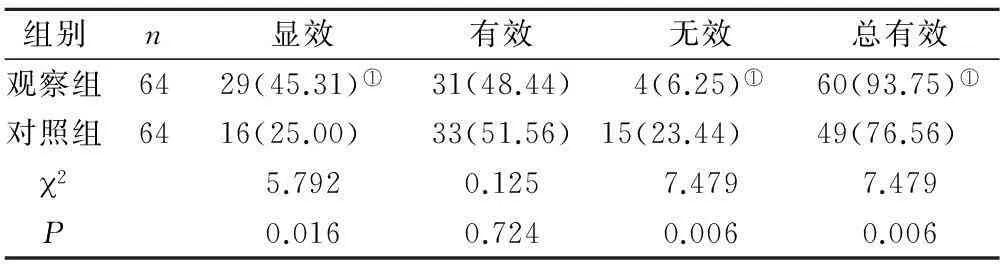
表2 两组患者治疗后临床疗效比较[n(×10-2)]
注:与对照组相比,①P<0.05
2.3 两组患者不良反应比较 联合治疗后观察组出现不良反应的总比例显著低于对照组,差异有统计学意义(P<0.05),见表3。

表3 两组患者不良反应比较[n(×10-2)]
注:与对照组相比,①P<0.05
3 讨论
动脉粥样硬化性心血管疾病是全球发病率和死亡率的主要原因之一[2]。而以LDL-C水平增高为特征的高脂血症则是动脉粥样硬化性心血管疾病中最重要的危险因素之一[3]。然而尽管通过他汀类药物治疗后LDL-C水平已经达标,但是心血管残余风险仍然存在[4]。因此,进一步研究其他降脂药物来减少心血管风险的必要性日益凸显。
非诺贝特属于氯贝丁酸衍生物类血脂调节药,可降低血浆中的TC和TG(以降低TG为主),升高HDL-C。非诺贝特通过激活过氧化物酶体增殖物激活受体α(peroxisome proliferator-activated receptor ligands α,PPARα)[5],增加血中载脂蛋白AI、载脂蛋白A II及脂蛋白脂肪酶(lipoprotein lipase,LPL)的基因表达,减少载脂蛋白C Ⅲ的基因表达,提高LPL的脂解活性,从而降低TG和LDL-C水平,同时促进胆固醇的逆向转运,提高HDL-C水平。非诺贝特还能负性调节PPARα核因子活性而抑制某些炎症及粘附分子表达,从而产生除降脂作用以外的抗炎和抗动脉粥样硬化作用。Bing Sun等[6]研究结果显示,非诺贝特治疗后甘油三酯水平降低能够改善内皮功能以及系统性炎症和氧化,且呈剂量依赖性,说明在高脂血症致动脉粥样硬化的早期阶段,非诺贝特治疗可能在血管保护方面具有重要作用。依折麦布属于胆固醇吸收抑制剂,抑制胆固醇从肠腔吸收到肠细胞中[7]。口服后依折麦布被迅速吸收并与葡萄糖醛酸结合形成依折麦布-葡萄糖醛酸,作用于小肠黏膜细胞的刷状缘,特异性地结合肠黏膜上的Ni-emann-Pick C1-like 1(NPC1L1)转运蛋白并抑制其活性[8],从而选择性地抑制膳食和胆汁中的胆固醇以及植物甾醇跨小肠壁转运到肝脏中[9],使得小肠黏膜吸收的胆固醇明显减少,同时导致肝脏胆固醇储存减少,使肝脏LDL受体合成增加,加速LDL代谢,使血浆LDL-C水平降低[10]。但依折麦布不影响肝脏胆固醇的合成,不影响胆酸的排泄,也不影响其他脂类和脂溶性维生素在小肠的吸收[11],而且依折麦布直接作用于小肠上,对胆固醇与三酰甘油的吸收抑制无需通过调节胆固醇与胰脂酶,也无需改变胆固醇自身的跨膜转运方式,具有良好的胃肠道耐受性。因此,依折麦布是已作为不能耐受高剂量他汀治疗或血脂水平未达标患者的二线治疗方法[12]。 依折麦布和非诺贝特联合应用时,二者分别作用于胆固醇代谢的外源性和内源性两个途径,协同增加降脂效果。本研究结果显示,较单用非诺贝特,联合用药后TC、TG和LDL-C水平进一步降低,HDL-C进一步升高,总有效率明显升高,这与之前的许多研究结果是一致的。Farnier M等[13]研究结果显示,随机给予625例混合型血脂异常患者安慰剂、依折表布10mg,非诺贝特160mg,非诺贝特160mg+依折麦布10mg治疗12周后,联合给药组较任一单一给药组相比,血浆中LDL-C降低20.4%,非HDL-C降低30.4%,apoB降低26.1%,TG降低幅度甚至更多。Mckenney JM等[14]研究结果显示,在576例患者的双盲实验中,联合给药组与单用非诺贝特比较,血浆中LDL-C(-22% vs -8.6%)、非HDL-C(-31.6 vs 19.4%)和TG(-46% vs -41.8%)水平明显降低,HDL-C(20.9% vs 17.8%)水平明显升高,apoB(-25.2 vs -16.2%)水平明显降低。Ansquer JC等[15]研究结果显示,在随机双盲实验中,60例患者随机服用依折麦布10mg,非诺贝特145mg,依折麦布10mg+非诺贝特145mg 12周后,联合给药组较单一组的LDL-C、TC、非HDL-C、apoB和apoB/apoA 1比例显著降低。
本研究结果显示,联合应用依折麦布和非诺贝特的临床疗效明显优于单用非诺贝特,但出现头痛、腹胀等不良反应的总比例却显著降低。分析其原因可能是因为依折麦布不影响肝脏胆固醇的合成以及脂溶性维生素和其他脂类的吸收[16];同时依折麦布几乎不通过主要药物代谢酶--细胞色素P450(CYP450)同工酶代谢,故几乎不与其他药物发生相互作用[17]。本实验的缺点在于未规定TG和LDL-C的基础水平值,这是因为非诺贝特的效应依赖于脂质的基础水平,若基础水平TG明显升高而LDL-C非常低,使用非诺贝特后LDL-C水平可以显著升高,相反,LDL-C基础水平较高而TG水平较低的患者,使用非诺贝特后LDL-C水平可以显著降低[18]。
4 结论
本研究结果显示,与单用非诺贝特相比,依折麦布联合非诺贝特能更有效地降低混合型高脂血症患者的血脂水平,且出现头痛、腹胀、全身乏力等不良反应较少,安全性较高,弥补了单用贝特类药物降脂的局限性。因此建议在治疗混合型高脂血症患者时,优先选择依折麦布联合非诺贝特进行降脂治疗。
[1]血脂异常防治对策专题组.血脂异常防治建议[J].中华心血管病杂志,1997,3:169-175.
[2]Goff Jr DC,Lloyd-Jones DM,Bennett G,etal.2013 ACC/AHA guideline on the assessment of cardiovascular risk: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines[J]. Circulation,2014,129:S49-73.
[3]Stone NJ,Robinson JG,Lichtenstein AH,etal.2013 ACC/AHA guideline on the treatment of blood cholesterol to reduce atherosclerotic cardiovascular risk in adults: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines[J].J Am Coll Cardiol,2014,63(25):2889-2934.
[4]Chapman MJ,Ginsberg HN,Amarenco P,etal.Triglyceride-rich lipoproteins and high-density lipoprotein cholesterol in patients at high risk of cardiovascular disease: evidence and guidance for management[J].Eur Heart J,2011,32:1345-1361.
[5]Filippatos T,Milionis HJ.Treatment of hyperlipidaemia with fenofibrate and related fibrates[J].Expert Opin Investig Drugs,2008,17(10):1599-1614.
[6]Sun B,Xie Y,Jiang J,etal.Pleiotropic effects of fenofibrate therapy on ratswith hypertriglycemia[J].Lipids Health Dis,2015,14:27.
[7]Filippatos TD,Mikhailidis DP.Lipid-lowering drugs acting at the level of the gastrointestinal tract[J].Curr Pharm Des,2009,15(5):490-516.
[8]Hawes BE, O’Neill KA,Yao X,etal.In vivo responsiveness to ezetimibe correlates with niemann-pick C1 like-1(NPC1L1) binding affinity: Comparison of multiple species NPC1L1 orthologs[J].Mol Pharmacol,2007,71:19-29.
[9]Sato Y,Suzuki R,Kobayashi M,etal.Involvement of cholesterol membrane transporter Niemann-Pick C1-like 1 in the intestinal absorption of lutein[J].J Pharm Sci,2012,15(2):256-264.
[10] Ayad MF,Magdy N.Application of new spectrofluorometric techniques for determination of atorvastatin and ezetimibe in combined tablet dosage form[J].Chem Pharm Bull,2015,63(6):443-449.
[11] Pearson TA,Denke MA,McBride PE,etal.A community-based, ran-domized trial of ezetimibe added to statin therapy to attain NCEP ATPIII goals for LDL cholesterol in hypercholesterolemic patients: the eze-timibe add-on to statin for effectiveness (EASE) trial [J].Mayo Clin Proc,2005,80(5):587-595.
[12] Couture P,Lamarche B. Ezetimibe and bile acid sequestrants: impact on lipoprotein metabolism and beyond[J].Curr Opin Lipidol,2013,24(3):227-232.
[13] Farnier M,Freeman MW,Macdonell G,etal.Efficacy and safety of the coadministration of ezetimibe with fenofibrate in patients with mixed hyperlipidaemia[J].Eur Heart J,2005,26(9):897-905.
[14] Mckenney JM,Farnier M,Lo KW,etal.Safety and efficacy of long-term coadministration of fenofibrate and ezetimibe in patients with mixed hyperlipidemia[J].J Am Coll Cardiol,2006,47(8):1584-1587.
[15] Ansquer JC,Bekaert I,Guy M,etal.Efficacy and safety of coadministration of fenofibrate and ezetimibe compared with each as monotherapy in patients with type IIb dyslipidemia and features of the metabolic syndrome: a prospective, randomized, double-blind, three-parallel arm, multicenter, comparative study[J].Am J Cardiovasc Drugs,2009,9(2):91-101.
[16] Hwang KM,Park SA,Kim JY,etal.Formulation and in Vitro Evaluation of Self-microemulsifying Drug Delivery System Containing Fixed-Dose Combination of Atorvastatin and Ezetimibe[J].Chem Pharm Bull,2015,63(6):423-430.
[17] Jeu L,Cheng JW.Pharmacology and therapeutics of ezetimibe (SCH 58235), a cholesterol-absorption inhibitor[J].Clin Ther,2003,25(9):2352-2387.
[18] Bays HE,Shah A,Macdonell G,etal.Effects of coadministered ezetimibe plus fenofibratein mixed dyslipidemic patients with metabolic syndrome[J].Metab Syndr Relat Disord,2011,9(2):135-142.
《西部医学》可为您医学知识的更新、基础与临床的研究及医学论文的撰写,提供帮助、借鉴及指导,欢迎订阅《西部医学》杂志。
The efficacy and safety of ezetimibe combined with fenofibrate for treatment of combined hyperlipidemia
MA Hong1,TAN Chunyan2,ZHANG Rongyi2,etal
(1.DepartmentofMedicine,ChanghangHospital,Chongqing400042,China;2.DepartmentofCardiology,NorthSichuanMedicalCollegeAffiliatedHospital,Nanchong637000)
Objective To observe the efficacy and safety of ezetimibe combined with fenofibrate in treating patients with combined hyperlipidemia. Methods 128 patients mixed hyperlipidemia were randomly divided into control group given fenofibrate (200mg/d) and observation group given ezetimibe (20mg/d) and fenofibrate(200mg/d) combination. TC, TG, LDL-C, HDL-C and adverse reactions incidence were detected before and 3 months after treatment. Results TC, TG and LDL-C of the two groups were significantly reduced after treatment (P<0.05), while HDL-C level increased(P<0.05). Compared with that of the control group, TC, TG and LDL-C of observation group was reduced(P<0.05), while HDL-C level increased(P<0.05). The total effective rate of observation group was notably increased compared with that of the control group(P<0.05). The total proportion of adverse reactions in observation group was markedly decreased compared with that of the control group(P<0.05). Conclusion The efficacy of combination of fenofibrate and ezetimibe is significantly better than that of fenofibrate alone in treating combined hyperlipidemia with good safety.
Ezetimibe; Fenofibrate; Antilipemic agent; Hyperlipidemia; Dyslipidemia
四川省教育厅课题(2012ZA060)
R 589.2
A
10.3969/j.issn.1672-3511.2016.03.018
2015-12-01; 编辑: 母存培)

