柴胡皂甙A对脓毒症大鼠早期血清中炎症因子的影响
李淑萍 张宇
【摘要】 目的 探讨柴胡皂甙A(SsA)对脓毒症大鼠早期血清中炎症因子的影响。方法 90只清洁级SD大鼠, 随机分为对照组、脓毒症组和治疗组(脓毒症+SsA), 各30只。通过盲肠结扎穿孔建立脓毒症大鼠模型, 术后1、8、24 h三个时间点收集动脉血标本。酶联免疫分析法检测血清肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)浓度。结果 与对照组比较, 脓毒症组大鼠血清TNF-α、IL-6水平在术后各时间点均明显升高(P<0.05)。在8、24 h时间点, 治疗组大鼠TNF-α、白细胞介素-1(IL-1)的含量均较脓毒症组各时间点显著降低(P<0.05)。结论 SsA可抑制脓毒症大鼠早期炎症反应。
【关键词】 柴胡皂甙A;脓毒症;肿瘤坏死因子-α;白细胞介素-1;大鼠
脓毒症是由细菌感染引发的全身性炎症反应, 常见于严重创伤、烧伤、休克及大手术后, 可导致多器官功能衰竭, 是临床重症患者主要死亡原因之一[1]。虽然近年来对该疾病的发病机制等已有较多的理解且出现了较多的治疗方法和药物, 但目前此重症的治疗效果仍不令人满意。据统计, 脓毒症死亡率在1979~2000年为0.022%~0.044%, 占美国全年总死亡率的9%[2]。SsA是从传统中药柴胡中提取的有效单体成分。已有研究证明SsA具有抗氧化、抗炎及肝脏保护等生物学活性, 但其是否可用于脓毒血症治疗尚未有相关研究报道。本研究通过盲肠结扎穿孔术建立大鼠脓毒症模型, 检测术后多时间点TNF-α和IL-6水平的变化情况, 旨在明确SsA对脓毒症早期炎症反应的影响。现报告如下。
1 材料与方法
1. 1 材料 清洁级SD大鼠90只, 雌雄不限, 平均体重(200±20)g, 购自郑州大学实验动物中心。将大鼠随机分为对照组、脓毒症组和治疗组(脓毒症+5.0 mg/kg SsA), 每组30只。
1. 2 方法 大鼠适应性饲养1周, 自由饮食, 实验前禁食过夜。依Rittirsch D等[3]所报道的方法, 通过盲肠结扎穿孔术(CLP)建立大鼠脓毒症模型。10%水合氯醛(3 ml/kg)腹腔麻醉, 沿腹部正中线作约1.5 cm切口, 寻找到盲肠并在其根部进行结扎。使用18号针穿刺盲肠3次, 挤压盲肠见有粪便溢出, 将盲肠还纳回腹腔, 关闭腹壁切口。对照组大鼠在找到盲肠后即关闭腹壁切口, 盲肠不作结扎穿刺。治疗组大鼠在CLP术后立即经尾静脉注射SsA(购自上海医药工业研究院, 纯度>98%, 5.0 mg/kg)。
1. 3 检测炎症因子TNF-α和IL-6 分别于术后1、8、24 h 三个时间点从腹主动脉收集动脉血标本。4℃静置30 min, 4000 r/min离心15 min并保存血浆于-80℃冰箱。采用酶联免疫检测试剂盒(美国R&D公司)检测TNF-α和IL-6含量, 操作过程严格按照试剂盒说明书进行, 数据以pg/ml表示。
1. 4 统计学方法 采用SPSS18.0统计学软件对数据进行统计分析。计量资料以均数±标准差( x-±s)表示, 采用t检验;计数资料以率(%)表示, 采用χ2检验。P<0.05表示差异具有统计学意义。
2 结果
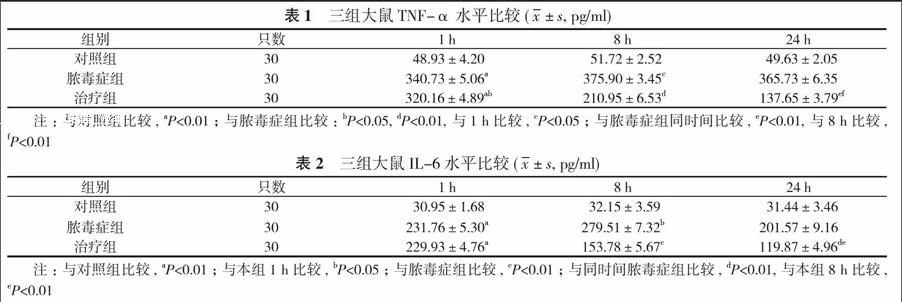
2. 1 三组大鼠血清TNF-α水平比较 CLP术后1 h, 脓毒症组及治疗组大鼠血清TNF-α含量明显高于对照组(P<0.01), 治疗组大鼠TNF-α水平低于脓毒症组大鼠(P<0.05);术后8 h, 脓毒症组大鼠TNF-α水平明显高于本组大鼠1 h时TNF-α水平(P<0.05), 而治疗组大鼠TNF-α含量较脓毒症组大鼠明显降低(P<0.01);术后24 h, 治疗组大鼠TNF-α含量较同时间点脓毒症组大鼠及本组8 h时间点大鼠均明显降低(P<0.01)。见表1。
2. 2 三组大鼠血清IL-6水平比较 CLP术后1 h, 脓毒症组及治疗组大鼠血清IL-6含量明显高于对照组大鼠(P<0.01);术后8 h, 脓毒症组大鼠IL-6水平明显高于本组大鼠1 h时IL-6水平(P<0.05), 而治疗组大鼠IL-6含量较脓毒症组大鼠明显降低(P<0.01);术后24 h, 治疗组大鼠IL-6含量较同时间点脓毒症组大鼠及本组8 h时间点大鼠均明显降低(P<0.01)。见表2。
3 讨论
脓毒症早期发生发展的中心环节是失控性的炎症反应。已有研究认为, 机体早期释放的细胞因子在该炎症反应中起到启动作用[4]。TNF-α是炎症反应中释放最早并且也是最重要的致炎因子, TNF-α也可产生调节IL-6和IL-8等其他炎症介质的释放, 产生级联效应, 进一步加重组织细胞损伤, 甚至发展为多器官功能障碍[5]。因此, 抗炎治疗尤其是早期抑制炎症反应是治疗脓毒症的重点。
SsA是柴胡根茎的主要活性提取物, 属于三萜皂苷化合物, 具有抗氧化、抗炎及肝脏保护等生物学活性。体外细胞实验证实, SsA可明显降低TNF-α、 IL-1β、IL-6及前列腺素E2等炎性因子水平[6]。在CCl4所诱导的大鼠肝炎模型中, SsA可明显降低大鼠血清中TNF-α, IL-1β, IL-6和IL-8水平[7]。但目前尚未见有关脓毒症早期使用SsA进行抗炎治疗的研究报道。
本研究显示, CLP术后1 h, 脓毒症组及治疗组大鼠血清TNF-α和IL-6含量明显高于对照组大鼠(P<0.01)。而CLP术后8 h, 与脓毒症组大鼠相比较, SsA治疗组大鼠TNF-α和IL-6水平明显降低(P<0.01)。术后24 h, SsA治疗组大鼠血清TNF-α和IL-6含量较同时间点脓毒症大鼠及本组8 h时间点大鼠明显降低(P<0.01), 提示SsA对脓毒症大鼠早期炎性因子的释放发挥了明显的抑制作用, 降低炎症反应程度, 阻断脓毒症早期炎症级联反应的过程, 为脓毒症临床早期干预性治疗提供了新思路。但需要指出, 本实验未对 SsA的内在抗炎作用机制进行阐明, 因此有待进一步研究。
参考文献
[1] Hotchkiss RS, Karl IE. The pathophysiology and treatment of sepsis. N Engl J Med, 2003, 348(2):138-150.
[2] Angus DC, Linde-Zwirble WT, Lidicker J, et al. Epidemiology of severe sepsis in the United States: analysis of incidence, outcome, and associated costs of care. Crit Care Med, 2001, 29(7):1303-1310.
[3] Rittirsch D, Huber-Lang MS, Flierl MA, et al. Immunodesign of experimental sepsis by cecal ligation and puncture. Nat Protoc, 2009, 4(1):31-36.
[4] Pinsky MR, Vincent JL, Deviere J, et al. Serum cytokine levels in human septic shock. Relation to multiple-system organ failure and mortality. Chest, 1993, 103(2):565-575.
[5] Blackwell TS, Christman JW. Sepsis and cytokines: current status. Br J Anaesth, 1996, 77(1):110-117.
[6] Kim SO, Park JY, Jeon SY, et al. Saikosaponin a, an active compound of Radix Bupleuri, attenuates inflammation in hypertrophied 3T3-L1 adipocytes via ERK/NF-κB signaling pathways. Int J Mol Med, 2015, 35(4):1126-1132.
[7] Wu SJ, Tam KW, Tsai YH, et al. Curcumin and saikosaponin a inhibit chemical-induced liver inflammation and fibrosis in rats. Am J Chin Med, 2010, 38(1):99-111.
[收稿日期:2015-11-23]

