咪唑啉酰胺在HCl/NH4Cl-H2O和H2S/NH4HS-H2O体系中对碳钢的缓蚀性能
刘公召,杨振声,张 艳,邱克强
(1.沈阳工业大学理学院,沈阳110870;2.沈阳工业大学材料与工程学院,沈阳110870)
咪唑啉酰胺在HCl/NH4Cl-H2O和H2S/NH4HS-H2O体系中对碳钢的缓蚀性能
刘公召1,杨振声2,张艳1,邱克强2
(1.沈阳工业大学理学院,沈阳110870;2.沈阳工业大学材料与工程学院,沈阳110870)
摘 要:采用失重法、电化学测试法,并结合扫描电镜和原子力显微镜观察,研究了在50℃条件下,N-(2-辛基-2咪唑啉)三亚乙基四酰胺(咪唑啉酰胺)分别在HCl/NH4Cl-H2O和H2S/NH4HS-H2O体系中对碳钢的缓蚀性能。结果表明:N-(2-辛基-2咪唑啉)三亚乙基四酰胺加量为15 mg/L时,缓蚀率接近90%,缓蚀效果明显;该缓蚀剂为抑制阳极型缓蚀剂,溶液中加入缓蚀剂后,碳钢试样形成较长的钝化区间,交流阻抗半径大,腐蚀电流明显减小。形貌观察显示N-(2-辛基-2咪唑啉)三亚乙基四酰胺能够在碳钢表面形成致密的保护膜。
关键词:缓蚀性能;HCl/NH4Cl;H2S/NH4HS;保护膜
炼油厂分馏装置(常减压分馏塔,加氢分馏塔,焦化分馏塔,催化裂化分馏塔)塔顶的冷凝冷却系统主要存在低温腐蚀(低于120℃)[1-2]。这是由于原油中含有无机盐、硫化物、环烷酸等杂质造成的[3-5],它们在加工过程中会转化为HCl、H2S[6-8]。当HCl、H2S处于干态时对钢材无腐蚀,但处于露点温度时就会形成十分强烈的腐蚀环境[9-11]。所以炼油厂为避免露点引起的强烈腐蚀,通常在露点之前通过注入有机胺或无机胺的方式中和干态的HCl和H2S,使之转化为NH4Cl,NH4HS等铵盐,从而形成平衡体系[12],然后再通过加注缓蚀剂的方式抑制腐蚀。
曾经采用7019、尼凡丁、兰4-A、乌洛托品(六次甲基四胺)等缓蚀剂[13-15]进行碳钢表面的防护。上述缓蚀剂或因保护膜易被H2S破坏,或因易在加剂釜底、阀门等处形成阻塞,缓蚀效果较差,大多已不被炼油厂采用。目前炼油厂普遍采用低毒、环保的咪唑啉类缓蚀剂,用于分馏塔顶的冷凝冷却系统防腐蚀[16]。咪唑啉型缓蚀剂能够在金属表面形成物理和化学双重吸附,有良好的缓蚀效果,已成为缓蚀剂领域的研究重点[17-24]。笔者采用壬酸、四乙烯五胺、冰乙酸等原料,先进行低温酰胺化反应,再通过高温闭环反应合成具有水溶性的咪唑啉酰胺[25]——N-(2-辛基-2咪唑啉)三亚乙基四酰胺,与早前开发的油溶性咪唑啉酰胺相比,水溶性咪唑啉酰胺在腐蚀介质中的溶解性更好,更容易在金属表面形成吸附。本工作通过静态挂片失重法和电化学测试方法,结合扫描电镜(SEM)和原子力显微镜(AFM)观察,研究在50℃条件下,N-(2-辛基-2咪唑啉)三亚乙基四酰胺分别在HCl/NH4Cl-H2O和H2S/NH4HS-H2O体系中对碳钢的缓蚀性能。探讨N-(2-辛基-2咪唑啉)三亚乙基四酰胺形成缓蚀膜的机理。以期为水溶性的咪唑啉酰胺——N-(2-辛基-2咪唑啉)三亚乙基四酰胺在石油行业,特别是炼油厂分馏装置防腐蚀方面的应用提供一定的指导和实际应用理论依据。
1 试验
腐蚀溶液的配制:选用分析纯浓盐酸配制成0.082 mol/L HCl溶液,再用氨水将p H调至7~8,使溶液中Cl-浓度为0.082 mol/L,配成HCl/NH4Cl-H2O腐蚀溶液;用20%质量分数的H2SO4和FeS反应生成H2S,配制成0.029 mol/L H2S溶液,再用氨水将p H调至7~8,使溶液中S2-浓度为0.029 mol/L,配制成H2S/NH4HS-H2O腐蚀溶液。在两种腐蚀溶液中分别加入自制的N-(2-辛基-2咪唑啉)三亚乙基四酰胺1.5,10,15,20 mg· L-1。
静态挂片试验参照石油天然气行业标准SY/T 5273-2000《油田采出水用缓蚀剂性能评价方法》进行。试验温度为50℃,试验时间6 h,试样材料为Q235碳钢,尺寸为40 mm×13 mm×2 mm。采用三组平衡试验,每组试验将两个试片相距1 cm平行悬挂在自制的含不同质量浓度N-(2-辛基-2咪唑啉)三亚乙基四酰胺的腐蚀介质中,通过腐蚀前后挂片的质量差及挂片的表面积,按下式计算腐蚀速率和缓蚀率。

式中:Δm为钢片的质量损失,g;S为钢片表面积,cm2;t为腐蚀时间,h;ρ为钢片密度,g·cm-3。

式中:η为缓蚀率,%;v2为空白试样的腐蚀速率,g· m-2·h-1;v1为加缓蚀剂试样的腐蚀速率,g·m-2· h-1。
选用CHI640A电化学工作站进行电化学测试。采用三电极体系,工作电极为10 mm×10 mm 的Q235碳钢,辅助电极为铂电极,参比电极为饱和甘汞电极(SCE)。文中电位若无特指,均相对于SCE。试验温度为50℃,扫描范围为-1.5~2.0 V,扫描速率为10 mV/s。测试试样在HCl/NH4Cl-H2O和H2S/NH4HS-H2O体系中添加不同质量浓度N-(2-辛基-2咪唑啉)三亚乙基四酰胺的动电位极化曲线。电化学阻抗谱在开路电位下测得,频率范围为0.1~105Hz,交流电压信号幅值为10 mV,再用Zsimp win分析软件对电化学阻抗谱进行分析。极化曲线法缓蚀率的计算式为:

式中:J空白和J加剂分别为未加和添加缓蚀剂后试样的腐蚀电流密度,μA·cm-2。
采用日立S-3400N扫描电子显微镜观察Q235碳钢试样在50℃条件下含不同质量浓度N-(2-辛基-2咪唑啉)三亚乙基四酰胺的HCl/NH4Cl-H2O溶液和H2S/NH4HS-H2O溶液中浸泡6 h后的表面形貌。采用Bruker Dimension Icon原子力显微镜观察经腐蚀溶液浸蚀2 h后试片表面的成膜情况。
2 结果与讨论
2.1 静态挂片失重法
由图1可见,未添加缓蚀剂时,Q235试片在两种腐蚀溶液中的腐蚀速率分别达到0.444 mm/a和1.322 mm/a。加入缓蚀剂后,随着缓蚀剂加入量的增多,腐蚀速率明显下降。当缓蚀剂加量达到15 mg/L时,腐蚀速率分别下降到0.051 mm/a和0.14 mm/a,缓蚀率分别为88.51%和89.41%,缓蚀效果明显,满足炼油厂腐蚀速率≤0.2 mm/a的要求。继续增加缓蚀剂的量,缓蚀率并没有进一步提高,这可能是由于当缓蚀剂的质量浓度达到临界保护质量浓度时,其在碳钢表面吸附与脱附已达到平衡[26]。结果表明,N-(2-辛基-2咪唑啉)三亚乙基四酰胺加入量为15~20 mg/L时缓蚀性能较好。
2.2 极化曲线
由图2和表1可见,与空白试验相比,添加缓蚀剂后,阳极区产生了明显的钝化区间,表明钝化区间的产生是缓蚀剂作用的结果。缓蚀剂加量较少时,其对腐蚀的阴极过程有较轻的抑制作用,体系的自腐蚀电位发生负移。随着缓蚀剂含量继续增加,它对阴极过程的抑制作用开始减弱,而对阳极过程的抑制能力有所增强。当缓蚀剂加量为15~20 mg/L时,自腐蚀电位由负移转变成正移,其缓蚀作用类型也从阴极型转变为阳极型。这种随缓蚀剂含量的增加,缓蚀作用类型发生改变的电化学行为,是绝大部分咪唑啉类缓蚀剂缓蚀作用的突出特征[27]。结合图2和表1可见,当缓蚀剂加量为15~20 mg/L时,腐蚀电流密度明显下降,缓蚀率可以达到90%左右,并在阳极区产生较长的钝化区间,且维钝电流较小,说明缓蚀剂起到了较好的保护作用。
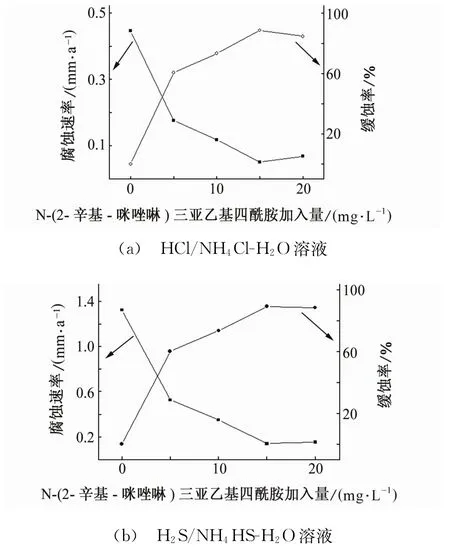
图1 N-(2-辛基-2咪唑啉)三亚乙基四酰胺加量对Q235试片在50℃、不同腐蚀溶液中腐蚀速率的影响Fig.1 Effect of N-(2-octyl-2 imidazoline)triehylen eteramine amide on corrosion rate of Q235 samples in HCl/NH4Cl-H2O solution(a)and H2S/NH4HS-H2O solution(b)at 50℃

图2 Q235试片在50℃、含不同质量浓度N-(2-辛基-2咪唑啉)三亚乙基四酰胺的腐蚀溶液中的极化曲线Fig.2 Polarization curves of Q235 samples in HCl/NH4Cl-H2O solution(a)and H2S/NH4HS-H2O solution(b)containing different concentrations of N-(2-octyl-2 imidazoline)triethylenetetramine amide at 50℃

表1 HCl/NH4Cl-H2O溶液和H2S/NH4HS-H2O溶液中试片的的极化曲线拟合参数Tab.1 Polarization parameters of samples in HCl/NH4Cl-H2O solution and H2S/NH4HS-H2O solution
2.3 电化学阻抗谱
由图3和表2可见,本试验条件下,缓蚀剂的阻抗复平面始终由单一容抗弧组成,只出现一个时间常数,且随缓蚀剂含量增加,容抗弧半径逐步增大,电极表面极化电阻Rs逐渐增大,界面电容Cc减小,表明缓蚀剂分子吸附在电极表面会阻碍界面电荷的转移,从而使极化电阻增大[28]。随着缓蚀剂含量增加,缓蚀剂分子中的5个氮原子在铁表面的吸附覆盖度逐渐增加,且缓蚀剂分子吸附层厚度比H2O吸附层更厚,故铁表面吸附的水分子被缓蚀剂替代,界面电容Cc下降[29],膜层孔隙率下降,孔隙变小,膜层致密度增加,屏蔽效应增强,缓蚀效果逐渐提高。当缓蚀剂加量为15mg/L时,阻抗弧半径最大,试样在两种溶液中的电荷转移电阻Rt分别为180.3Ω·cm2和4 665Ω·cm2,这与静态挂片失重法及极化曲线测试结果一致。对比静态挂片失重法及电化学极化曲线法的数据可以看出三种评价方法数据整体趋势吻合,随着缓蚀剂含量的增加,缓蚀率逐渐提高。该缓蚀剂在HCl/NH4Cl-H2O和H2S/NH4HS-H2O溶液中都有良好的缓蚀作用,当缓蚀剂含量为15~20mg/L时,缓蚀率较好。图4为阻抗谱等效电路拟合结果。

图3 Q235试片在50℃、含不同质量浓度N-(2-辛基-2咪唑啉)三亚乙基四酰胺的腐蚀溶液中的Nyquist图Fig.3 Nyquist plots of Q235 samples in HCl/NH4Cl-H2O solution(a)and H2S/NH4HS-H2O solution(b)containing different concentrations of N-(2-octyl-2 imidazoline)triethylenetetramine amide at 50℃

表2 Q235试片在不同腐蚀溶液中的EIS等效电路拟合参数Tab.2 The fitting parameters of equivalent circuit in different corrosion solutions

图4 等效模拟电路Fig.4 Equivalent circuit
2.4 表面形貌
由图5和图6可见,当缓蚀剂添加量为5 mg/L时,碳钢表面的腐蚀有所减缓,腐蚀速率降低,表明缓蚀剂添加量还不足以使金属表面成膜;当缓蚀剂添加量为10 mg/L时,腐蚀基本被抑制,局部区域仍存在轻微腐蚀;当缓蚀剂加量为15 mg/L时,腐蚀已经完全被抑制,碳钢表面形成一层光滑的化学吸附膜,有效隔离了金属与腐蚀介质,使金属表面完好无损,缓蚀效果较好,与静态挂片失重法和电化学测试结果基本相一致。
2.5 缓蚀机理
极化曲线结果表明,在HCl/NH4Cl-H2O溶液或H2S/NH4HS-H2O溶液中,随着N-(2-辛基-2咪唑啉)三亚乙基四酰胺缓蚀剂逐渐增加,体系的自腐蚀电位发生先负移后正移的现象。也就是N-(2-辛基-2咪唑啉)三亚乙基四酰胺缓蚀剂由阴极型缓蚀剂向阳极型缓蚀剂转变。这是因为缓蚀剂本身是弱碱性化合物,当缓蚀剂含量较低时,首先其与溶液中的H+中和,抑制了阴极的吸电子反应,会产生自腐蚀电位向负方向移动;但随着缓蚀剂含量的增加,腐蚀电流密度大幅度下降,自腐蚀电位发生正移,对阳极的抑制作用明显强于阴极并在阳极区产生钝化区间。特别是当N-(2-辛基-2咪唑啉)三亚乙基四酰胺缓蚀剂加量为15~20 mg/L时,产生的维钝电流密度最小,钝化区间较长,缓蚀效果最佳,见图2。这种较长的钝化区间产生与缓蚀剂的分子结构密切相关。由于N-(2-辛基-2咪唑啉)三亚乙基四酰胺上5个氮原子上的孤对电子与金属铁的3d6中的空轨道形成配位键,在金属表面形成稳定的化学吸附膜,而非极性的辛基碳链则背离金属表面形成一层疏水膜,起到了隔离作用,改变了金属表面的电荷分布和界面性质,形成了双层膜保护,使金属离子化过程受到阻碍,提高了腐蚀反应的活化能,腐蚀速率降低[29-32]。这种保护膜的形貌见图7。由图7可见,Q235碳钢表面呈凹凸不平的起伏状,是明显的打磨痕迹形成此三维形貌,表面粗糙度达20~30 nm,由图7(b)和(c)可见,试片表面较平整,表面粗糙度约5~7 nm,可以看出N-(2-辛基-2咪唑啉)三亚乙基四酰胺能够在Q235碳钢表面形成非均匀状态的缓蚀膜。局部缓蚀膜厚度较厚,这是因为N-(2-辛基-2咪唑啉)三亚乙基四酰胺同时可以在铁表面形成单分子层的化学吸附和多分子层的物理吸附,由于试验在静态条件下进行,局部区域可能缓蚀剂分子含量较高,从而形成较厚的缓蚀膜;通过chemsketch软件模拟N-(2-辛基-2咪唑啉)三亚乙基四酰胺的分子式可得该分子的密度约1.09 g/cm3,再根据阿伏伽德罗常数,通过以下公式可计算得到N-(2-辛基-2咪唑啉)三亚乙基四酰胺的分子直径约1.18 nm,通过图7也可知N-(2-辛基-2咪唑啉)三亚乙基四酰胺能够在铁表面形成多分子层吸附。

式中:d为分子直径,M为摩尔质量,ρ为密度,NA为阿伏伽德罗常数。

图5 Q235试片在含不同质量浓度N-(2-辛基-2咪唑啉)三亚乙基四酰胺的HCl/NH4Cl-H2O的溶液中浸泡6 h后的表面形貌Fig.5 SEM morphology of Q235 samples after immersing in HCl/NH4Cl-H2O solutions containing different concentrations of N-(2-octyl-2 imidazoline)triethylenetetramine amide for 6 h

图6 Q235试片在含不同质量浓度N-(2-辛基-2咪唑啉)三亚乙基四酰胺的H2S/NH4HS-H2O溶液中浸泡6 h后的表面形貌Fig.6 SEM morphology of Q235 samples after immersing in H2S/NH4HS-H2O solutions containing different concentrations of N-(2-octyl-2 imidazoline)triethylenetetramine amide for 6 h

图7 Q235碳钢及其在HCl/NH4Cl-H2O和H2S/NH4HS-H2O体系中添加15 mg·L-1缓蚀剂的AFM图Fig.7 AFM pictures of Q235 steel(a),Q235 carbon steel in HCl/NH4Cl-H2O(b)and H2S/NH4HS-H2O(c)solutions adding 15 mg·L-1inhibitor
AFM结果与之前加入N-(2-辛基-2咪唑啉)三亚乙基四酰胺的静态挂片失重和SEM分析结果一致。由于N-(2-辛基-2咪唑啉)三亚乙基四酰胺在铁表面生产一层保护膜,阻止了腐蚀介质与金属表面接触,抑制了腐蚀,所以SEM图显示铁表面比较光滑。
3 结论
(1)N-(2-辛基-2咪唑啉)三亚乙基四酰胺是一种性能较好的水溶性咪唑啉酰胺缓蚀剂。
(2)当N-(2-辛基-2咪唑啉)三亚乙基四酰胺加入量为15~20 mg/L时,缓蚀效果较好。在Cl-浓度为0.082 mol/L的HCl/NH4Cl-H2O溶液和S2-浓度为0.029 mol/L的H2S/NH4HS-H2O溶液中,缓蚀率都达到90%。
(3)极化曲线结果表明,缓蚀剂对阳极影响较大,是阳极型缓蚀剂。当缓蚀剂加入量为15~20 mg/L时,腐蚀电流最低,缓蚀率较高;电化学阻抗谱分析得到单一的容抗弧,容抗弧半径较大。说明电化学测试与静态挂片失重法结论一致。
(4)N-(2-辛基-2咪唑啉)三亚乙基四酰胺能在铁表面生成一层保护膜,可以有效减缓金属腐蚀,当加入量为15~20 mg/L时,Q235碳钢表面最光滑,腐蚀速率最小。
参考文献:
[1]李得志,凌文凯,陈革新,等.常减压蒸馏装置用缓蚀剂的研究现状及展望[J].石油化工腐蚀与防护,2009,26(1):8.
[2]赵敏,康强利,马红杰,等.炼油厂常减压蒸馏装置腐蚀防护现状[J].腐蚀科学与防护技术,2011,23(5):430-432.
[3]臧红武.常压塔的腐蚀与防腐[J].石油工程建设,2000(1):22-24.
[4]MORRIS D R,SAMPALEAUN L P,VEYSEY D N.The corrosion of steel by aqueous solutions of hydrogen sulfide[J].J Electrochem Soc,1980,127(6):1228.
[5]黄本生,尹文峰,王小红,等.常减压装置常用钢材在高温原油馏分中的腐蚀研究[J].中国腐蚀与防护学报,2013,33(5):377-382.
[6]于晓鹏,王登恕.常压塔腐蚀与防护[J].石油化工腐蚀与防护,2007,24(5):23-25.
[7]赵训跃,陈相.常压塔顶空气冷却器腐蚀失效分析[J].石油化工腐蚀与防护,2009,26(2):19-22,26.
[8]何永红,巩学梅.常压塔塔顶304不锈钢馏出线开裂分析[J].宁波工程学报,2009,21(4):64-67.
[9]叶国庆.常压塔塔顶系统设备腐蚀分析及对策[J].石油化工设备,2007,36(3):90-92.
[10]许文虎,贾军艳,黄平.石化常减压装置低温部位防腐蚀措施[J].腐蚀与防护,2012,33(1):85-87,92.
[11]刘香兰.常压蒸馏塔顶系统的腐蚀与防护[J].腐蚀科学与防护技术,2011,23(3):281-283.
[12]程光旭,马贞钦,胡海军,等.常减压装置塔顶低温系统露点腐蚀及铵盐沉积研究[J].石油化工设备,2014,43(1):1-8.
[13]张天胜.缓蚀剂[M].北京:化学工业出版社,2002:421-436.
[14]杨伙成.7019缓蚀剂在炼化公司的应用[J].石油化工腐蚀与防护,1998,15(2):42-43,57.
[15]艾中秋.加氢分馏塔顶缓蚀剂的筛选[J].石油化工腐蚀与防护,2001,18(1):40,56.
[16]CRUZ J,MARTINEZ R,GENESCA J,et al.Experimental and theoretical study of 1-(2-ethylamino)-2-methylimidazoline as an inhibitor of carbon steel corrosion in acid media[J].Journal of Electroanalytical Chemistry,2004,566(1):111-121.
[17]马文军,范峥,李稳宏,等.咪唑啉类缓蚀剂性能的评价及其机理研究[J].化学工程,2014,42(2):9-12.
[18]张光华,王腾飞,孙卫玲,等.硫脲基烷基咪唑啉类缓蚀剂的制备、缓蚀性能及其机理[J].材料保护,2011,44(2):21-23.
[19]ACHOURI M E,INFANTE M R,IZQUIERDO F,et al.Synthesis of some cationic gemini surfactants and their inhibitive effect on iron corrosion in hydrochloric acid medium[J].Corrosion Science,2001(43):19-35.
[20]ACHOURI M E,KERTIT S,GOUTTAYA H M,et al.Corrosion inhibition of iron in 1M HCl by some gemini surfactants in the series of alkanediyl-α,ω-bis-(dimethyl tetradecyl ammonium bromide)[J].Progress in Organic Coatings,2001(43):267-273.
[21]QIU L G,XIE A J,SHEN Y H.Understanding the effect of the spacer length on adsorption of gemini surfactants onto steel surface in acid medium[J].Applied Surface Science,2005(246):1-5.
[22]HEGAZY M A.A novel schiff base-based cationic gemini surfactants:synthesis and effect on corrosion inhibition of carbon steel in hydrochloric acid solution[J].Corrosion Science,2009(51):2610.
[23]WANG X M,YANG H Y,WANG F H.A cationic gemini-surfactant as effective inhibitor for mild steel in HCl solution[J].Corrosion Science,2010(52):1268.
[24]ASEFI D,ARAMI M,MAHMOODI N M.Electrochemical effect of cationic gemini surfactant and halide salts on corrosion inhibition of low carbon steel in acid medium[J].Corrosion Science,2010(52):794-800.
[25]刘公召,曲纪惠.影响水溶性咪唑啉酰胺合成及性能的因素的研究[J].化学世界,2014(6):345-347,351.
[26]宋伟伟,张静,杜敏.新型不对称双季铵盐缓蚀剂在HCl中对Q235钢的缓蚀行为[J].化学学报,2011,69(16):1851-1857.
[27]杨怀玉,陈家坚,曹楚南,等.H2S水溶液中的腐蚀与缓蚀用机理的研究Ⅴ.咪唑啉衍生物在H2S溶液中的缓蚀作用特征[J].中国腐蚀与防护学报,2001,21 (6):321-327.
[28]YANG L J,BASHIR R.Electrical/electrochemical impedance for rapid detection of foodborne pathogenic bacteria[J].Biotechnol Adv,2008,26(2):135.
[29]曹楚南,张鉴清.电化学阻抗谱导论[M].北京:科学出版社,2002:173.
[30]曹楚南.腐蚀电化学[M].北京:化学工业出版社,1994:134.
[31]GAO J C.Corrosion inhibition ofα,β-unsaturated carbonyl compounds on steel in acid medium[J].Petroleum Science,2009(6):201-207.
[32]张军,于维钊,燕友果,等.咪唑啉缓蚀剂在Fe(001)表面吸附行为的分子动力学模拟[J].物理化学学报,2010,26(5):1385-1390.
Corrosion Inhibition Performance of Imidazoline Amide for Carbon Steel in HCl/NH4Cl-H2O and H2S/NH4HS-H2OSolution
LIU Gong-zhao1,YANG Zhen-sheng2,ZHANG Yan1,QIU Ke-qiang2
(1.School of Science,Shenyang University of Technology,Shenyang 110870,China;2.School of Material Science and Engineering,Shenyang University of Technology Shenyang 110870,China)
Abstract:Weight-loss method,electrochemical methods,scanning electron microscopy and atomic force microscopy were used to study the corrosion inhibition performance of N-(2-octyl-2 imidazoline)triethylenetetramine amide for carbon steel in HCl/NH4Cl-H2O and H2S/NH4HS-H2O solution at 50℃.The results showed that the inhibition rate was close to 90%when 15 mg·L(-1)corrosion inhibiter was added.The corrosion inhibitor is an anodic type corrosion inhibitor.After adding the inhibitor,long passivation range for the steel was formed,ACimpedance radius became bigger,corrosion current decreased obviously.Microscopy result demonstrated that N-(2-octyl-2 imidazoline)triethylenetetramine amide could form a compact film on the surface of the carbon steel specimen to protect it from corrosion.
Key words:inhibition performance;HCl/NH4Cl;H2S/NH4HS;protective film
通信作者:刘公召(1963-),教授,博士,从事石油化工助剂的研究,13664149291,liugongzhao666@163.com
基金项目:国家重点基础研究发展计划“973”项目(2011CB606301)资助
收稿日期:2015-02-28
DOI:10.11973/fsyfh-201603002
中图分类号:TG174.42
文献标志码:A
文章编号:1005-748X(2016)03-0189-06

