酒石酸酯化物的合成与应用研究进展
刘 斌, 赵建强, 周鸣强,*
(1. 成都丽凯手性技术有限公司,四川 成都 610041; 2. 中国科学院 成都有机化学研究所,四川 成都 610041)
·综合评述·
酒石酸酯化物的合成与应用研究进展
刘斌1, 赵建强2, 周鸣强1,2*
(1. 成都丽凯手性技术有限公司,四川 成都610041; 2. 中国科学院 成都有机化学研究所,四川 成都610041)
摘要:综述了12种酒石酸酯化物的合成方法,重点介绍了酒石酸酯化物在手性助剂、手性配体、手性源合成配体、手性萃取选择剂等领域中的应用,提出了未来的研究方向和应用前景。参考文献69篇。
关键词:酒石酸酯化物; 合成; 手性助剂; 手性配体; 手性源合成配体; 手性萃取选择剂; 综述
酒石酸(2,3-二羟基丁二酸)广泛存在于植物中,在果实和叶中尤为常见,也存在于酶菌和地衣中,其结构中含有两个手性碳原子。因此,很多研究者选择从酒石酸着手来合成一些手性选择子。目前研究较多、应用较广的酒石酸酯类化合物是(D)-酒石酸酯和(L)-酒石酸酯(Chart 1)。自从Bowman[1]最早发现了酒石酸酯化物对对映体的手性识别作用,并通过溶剂萃取法拆分对映体后,酒石酸酯化物的合成及应用越来越受到化学工作者的青睐。
本文对近年来酒石酸二甲酯、酒石酸二乙酯、酒石酸正丙酯、酒石酸异丙酯等12种酒石酸酯化物的合成及应用两个方面的研究进展进行了简要综述。并重点介绍了酒石酸酯化物在手性助剂、手性配体、手性源合成配体、手性萃取选择剂等领域中的应用,提出了未来的研究方向,展望了应用前景。
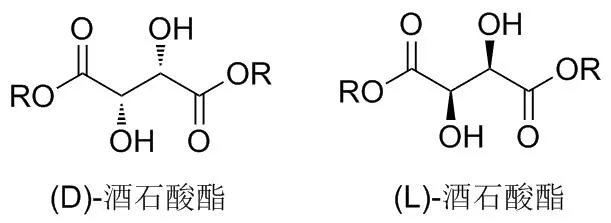
Chart 1
1酒石酸酯化物的合成
1.1酒石酸二甲酯的合成
以原甲酸三甲酯为酯化试剂,与酒石酸[以下如不特别说明,均为(L)-酒石酸]反应合成酒石酸二甲酯是研究较早的方法。早在1984年,Kocienski课题组[2]报道了用乙酰氯为催化剂催化酒石酸和原甲酸三甲酯反应,收率90.5%。 2014年,Bettina课题组[3]报道了酒石酸在DOWEX 50W-X8(NA)离子交换树脂作用下,以甲醇为溶剂,和原甲酸三甲酯反应,收率97%。
酸催化酒石酸和甲醇酯化反应是合成酒石酸二甲酯最简单、最经济的方法。在该反应中,催化剂酸既可以是布朗斯特酸,也可以是路易斯酸,还可以是固体酸等。
1987年,Musich课题组[4]首次报道了硫酸催化法合成酒石酸二甲酯。该方法以酒石酸为原料,分子筛为脱水剂,甲醇为溶剂,浓硫酸为催化剂,收率69%。 2008年,孟祥华等[5]也报道了硫酸催化酒石酸和甲醇反应合成酒石酸二甲酯,收率70%。 1994年,Selvapalam课题组[6]报道了固体酸催化的酒石酸和甲醇反应合成酒石酸二甲酯,收率85%。 1997年,南柱石[7]等报道了甲磺酸催化法合成酒石酸二甲酯的方法,收率达98%。 1998年,胡艾希等[8]研究了离子交换树脂催化合成酒石酸二甲酯。该方法以10%D72离子交换树脂为催化剂,酒石酸与甲醇的摩尔比为1 ∶9,以较高收率合成了酒石酸二甲酯,且D72树脂重复利用10次后,收率>80%。 1997年,Ram[9]报道了氯化镍催化法合成酒石酸二甲酯。该方法以10%NiCl2·6H2O(摩尔百分数)为催化剂,酒石酸为原料,甲醇为溶剂,回流条件下反应,收率87%。 2002年,Chattopadhyay[10]报道了酒石酸在氯化亚砜作用下生成酰氯,然后与甲醇酯化合成酒石酸二甲酯,收率61%。 2011年,姜艳等[11]同样报道了在氯化亚砜的作用下,酒石酸与甲醇反应,收率96%。
重氮甲烷是一种很好的甲基化试剂,可以与羧酸反应成酯。2000年,de Napoli课题组[12]报道了使用重氮甲烷为酯化试剂合成酒石酸二甲酯。该方法以一水合酒石酸为原料,乙醇为溶剂,将重氮甲烷乙醚溶液逐滴滴入反应液中制得酒石酸二甲酯产物,其收率几乎定量。
酯交换是从一种酯化物转化成另外一种酯化物的方法,通过该方法可以将不同的酒石酸酯与甲醇作用,转化成酒石酸二甲酯。2010年,Shinada课题组[13]报道了通过酯交换合成酒石酸二甲酯的方法。该方法使用酒石酸二乙酯为原料,甲醇为媒介,K2HPO4为催化剂,回流条件下反应,收率93%。 2011年,Baumho课题组[14]使用1%~10%Bu2SnO(摩尔百分数)为催化剂,催化酒石酸二乙酯与甲醇发生转移酯化得到酒石酸二甲酯,收率高达92%。
1.2酒石酸二乙酯的合成
酸催化合成酒石酸二乙酯是目前报道最多、最经济的方法。其中,催化剂可以为浓硫酸,浓盐酸,硼酸,对甲苯磺酸,酸性离子交换树脂,路易斯酸等。2007年,王帮贺等[15]报道了浓硫酸催化的酒石酸酯化法合成酒石酸二乙酯。该方法使用四氯化碳共沸带水,以酒石酸和乙醇为原料,浓硫酸为催化剂,收率95%。 2010年,Yang课题组[16]以同样的合成体系,以91%的分离收率得到酒石酸二乙酯。2008年,黄颜炯等[17]也报道了浓硫酸催化法合成酒石酸二乙酯。该方法以酒石酸和乙醇为原料,在浓硫酸催化下回流反应,收率87%。 2013年,Chen课题组[18]同样报道了催化量的浓硫酸催化酒石酸与乙醇直接回流酯化合成酒石酸二乙酯的方法,收率达到了98%。
Langer课题组[19]和Grachev课题组[20]分别在1979年和2007年报道了通过盐酸催化合成酒石酸二乙酯,收率高达95%。 2002年,叶秀林等[21]也通过盐酸催化酒石酸和乙醇在回流条件下直接合成酒石酸二乙酯,收率89%。 1993年,徐国春等[22]报道了对甲苯磺酸催化合成酒石酸二乙酯。该方法以酒石酸和95%乙醇为原料,苯为溶剂,对甲苯磺酸为催化剂,回流分水,收率90%。
2004年,Houston课题组[23]报道了硼酸催化法合成酒石酸二乙酯。该方法以酒石酸为原料,无水乙醇为溶剂,20%(摩尔百分数)硼酸为催化剂,于室温反应,收率97%。 2007年,王国胜等[24-25]也报道了硼酸催化酒石酸和乙醇反应生成酒石酸二乙酯。在n(酒石酸) ∶n(乙醇)=1 ∶5下,以四氯化碳为溶剂,硼酸为催化剂,酯化率能达96.7%,收率达90.7%。 Yamamoto[26-27]在2005年和2007年分别报道了使用B(III)催化的酯缩合反应合成酒石酸二乙酯。该方法以4-硼酸-N-甲基吡啶碘盐为催化剂,收率达92%。
2009年,吴桐等[28]使用732强酸性阳离子交换树脂催化合成了酒石酸二乙酯。以酒石酸和乙醇为原料,采用732强酸性阳离子交换树脂为催化剂,收率93%。该催化剂活性高,性质稳定,价廉易得,易于保存,使用方便,可重复使用,且催化剂留在反应器内可直接回用,是一种高效经济环保型的酯化反应催化剂。2012年,Pohmakotr课题组[29]报道了使用DOWEX 50 WX8(H+-form)树脂催化酒石酸酯化合成酒石酸二乙酯,收率95%。
2011年,Muraleedharan课题组[30]实现了SmCl3催化酯化法合成酒石酸二乙酯。该方法以0.1%~10%SmCl3(摩尔百分数)为催化剂,乙醇为溶剂,酒石酸为原料,一步合成了酒石酸二乙酯,收率98%。 Zhou课题组[31]和Zheng课题组[32]在2007年和2011年分别报道了在氯化亚砜作用下,酒石酸与乙醇酯化合成酒石酸二乙酯的方法,其收率几乎定量。该方法的原理是酒石酸与氯化亚砜反应生成活性很高的酰氯,酰氯进而与乙醇酯化得酒石酸二乙酯。
酒石酸和原甲酸三乙酯反应是合成酒石酸二乙酯的另外一种方法。1977年,Alazard等[33]报道了酒石酸和原甲酸三乙酯反应制备酒石酸二乙酯,收率达85%。
1.3酒石酸正丙酯的合成
酒石酸正丙酯的合成和酸催化合成酒石酸二甲酯和酒石酸二乙酯的方法类似。2003年,Trova[34]报道了酒石酸和正丙醇在浓硫酸催化下回流反应合成酒石酸正丙酯,但收率仅65%。
1.4酒石酸异丙酯的合成
酒石酸和异丙醇在催化剂作用下酯化是合成酒石酸二异丙酯的常规方法。2004年,Mombaini课题组[35]报道了Na2CO3/SOCl2调节酒石酸和异丙醇酯化制备酒石酸二异丙酯。该方法以等当量的Na2CO3和SOCl2为缩合剂,酒石酸为原料,异丙醇为溶剂,回流条件下反应,收率92%。
1.5酒石酸正丁酯的合成
2007年,魏燕等[36]报道了对甲苯磺酸催化合成酒石酸正丁酯。该方法以酒石酸和正丁醇为原料,对甲苯磺酸为催化剂,甲苯为溶剂,回流分水,酯化率达99%,收率>93%。
1.6酒石酸异丁酯的合成
2007年,黄灵芝等[37]报道了以酒石酸和异丁醇为原料合成手性拆分剂酒石酸异丁酯。并考察了带水剂用量、醇酸摩尔比、催化剂种类、催化剂用量对产品酯化率的影响。研究结果表明:最佳反应条件为对甲苯磺酸为催化剂,醇酸摩尔比为3 ∶1,催化剂的最佳用量为5%(摩尔百分数),带水剂甲苯用量为4 mL·g-1。在最佳反应条件下,酯化率可达99.4%,分离收率82%。
1.7酒石酸正戊酯的合成
2004年,陈国斌等[38]以对甲苯磺酸为催化剂,酒石酸和正戊醇为原料合成酒石酸正戊酯。并探索出最佳反应条件:n(正戊醇) ∶n(L-酒石酸)=2.8,催化剂对甲苯磺酸用量为2%,溶剂用量为酒石酸质量的2.5倍,于130~135 ℃回流分水。在最佳反应条件下,酯化率>99%,分离收率达78.4 %
1.8酒石酸正己酯的合成
2004年,陈国斌等[39]以甲苯为溶剂,对甲苯磺酸为催化剂,(D)-或(L)-酒石酸和正己醇为原料合成了手性选择体酒石酸正己酯。并确定了最佳反应条件:酒石酸100 mmol,n(酒石酸) ∶n(正己醇)=1.0 ∶2.8,甲苯45 mL,对甲苯磺酸0.30 g,回流反应53 min,酯化率>99%,收率达83%,且甲苯可回收使用
1.9酒石酸正辛酯的合成
2005年,唐课文等[40]报道了(D)-酒石酸正辛酯的合成。作者以(D)-酒石酸和正辛醇为原料合成了手性拆分剂酒石酸正辛酯,其结构经IR确证。通过正交实验得最优反应条件: 以酒石酸为标准计算,n(酒石酸) ∶n(正辛醇)=1.0 ∶2.8,对甲苯磺酸用量为3%(摩尔百分数),带水剂甲苯的用量为3.7 mL·g-1,慢速搅拌,酯化率>98%,收率达90%。
1.10酒石酸正癸酯的合成
2009年,吕迎春等[41]实现了对甲苯磺酸催化合成酒石酸正癸酯。该方法以酒石酸和正癸醇为原料,对甲苯磺酸为催化剂,甲苯回流分水,酯化率达96%,产率达81%。
1.11酒石酸二苄酯的合成
2014年,计海峰等[42]报道了硼酸催化合成酒石酸二苄酯。该方法以酒石酸和苯甲醇为原料,甲苯为溶剂,硼酸为催化剂合成酒石酸二苄酯,收率达83.6%。硼酸重复回收利用6次后,硼酸的损失量较小,收率只降低了2%左右。同年,计海峰等[43]研究了不同催化剂催化酒石酸和苯甲醇酯化合成酒石酸二苄酯的差别。结果表明:用732型强酸性阳离子树脂和对甲苯磺酸作为催化剂,反应稳定,产品的性状较好,催化剂可重复利用,但收率较低;浓硫酸为催化剂时,收率较高,但其有腐蚀性,且反应温度较高易发生副反应,催化剂不能重复使用;硼酸为催化剂时,反应稳定,反应温度可以控制,产品性状较好,催化剂也可以重复利用,收率较高。因此,合成酒石酸二苄酯最好的催化剂为硼酸。
1.12酒石酸十二酯的合成
2011年,杨涛等[44]报道了酒石酸与十二醇进行酯化反应合成酒石酸十二酯。并考察了对不同催化剂(浓硫酸,对甲苯磺酸,固体酸催化剂等)和反应溶剂(甲苯,甲醇,乙醇等)对反应的影响。结果表明最佳条件为对甲苯磺酸为催化剂,乙醇为溶剂,回流反应3 h。在最佳条件下,收率达81%。
2酒石酸酯化物的应用
2.1酒石酸酯作为手性助剂
手性助剂合成法是不对称合成中的重要技术,由德国Rhine-Westphalia研究所开发,称为SAMP、RAMP。手性助剂合成法是指在合成的某一阶段,引入一个手性辅助物,形成局部的诱导,产生一个新的手性中心。即:利用手性助剂R*与原料M结合成MR*进行不对称诱导反应,产生P*R*,然后脱去R*,则可得到新的手性化合物P*。
S-萘普生[(S)-(+)-2-( 6-甲氧基-2-萘基)丙酸]是一种新型非甾体消炎镇痛药物,已广泛应用于临床,且(S)-体的抗炎活性是(R)-体的28倍[45],因此光学纯S-萘普生的合成具有十分重要的意义。早在1984年,Giordano[46]就提出以原甲酸三乙酯为脱水剂,甲磺酸为催化剂制取中间体手性缩酮A的工业化方法,但收率仅63.3%。 1999年,胡艾希等[47-48]在国外学者的基础上,对该方法进行了简单的优化,以98.7%的收率得到缩酮产物A。 1996年,王来来等[49]使用离子交换树脂为催化剂,以(2R,3R)-酒石酸二甲酯为手性助剂,6-甲氧基-2-丙酰基萘为原料,经缩酮化得到(S)-萘普生的关键中间体A,收率89.1%(Scheme 1)。
2.2酒石酸酯作为手性源合成配体
手性源方法是合成手性化合物最常见最基本的方法,其通过底物中原有手性的诱导,在产物中形成新的手性中心。可简略表述为:原料为手性化合物M*,经不对称反应,得到另一手性化合物P*,即手性原料转化为反应产物。酒石酸酯类化合物具有两个手性中心,且每种化合的光学纯度都很高,因此是很好的手性源化合物。
1999年,邹贵祥等[50]以酒石酸二乙酯为原料,经过酸催化的缩酮化、还原、Ts保护、酮水解、再缩酮化等反应,以25%的总收率获得光学纯化合物(4S,5S)-4,5-双(对甲苯磺酸酯甲基)-2-(6-氯)正己基-1,3-二氧环戊烷(B, Scheme 2)。 B是合成一些手性膦配体的重要中间体。
2008年,黄颜炯等[17]以酒石酸二乙酯为原料,经过甲基化、水解、酰化等反应合成了(R,R)-(+)-2,3-二甲氧基-N,N,N′,N′-四环己丁二酰胺(C, Scheme 3)。 C是很重要的配体,可用于拆分2,2-二羟基-9,9′-螺双芴。
2010年,王德才等[51]以(D)-酒石酸二乙酯为手性源,首先与芳香醛发生缩醛化反应,然后氨解,合成了15个未见文献报道的手性庚铂类似物的关键中间体2-芳基-(4S,5S)-4,5-双(胺甲酰基)-1,3-二氧戊环(D, Scheme 4),收率49%~70%。
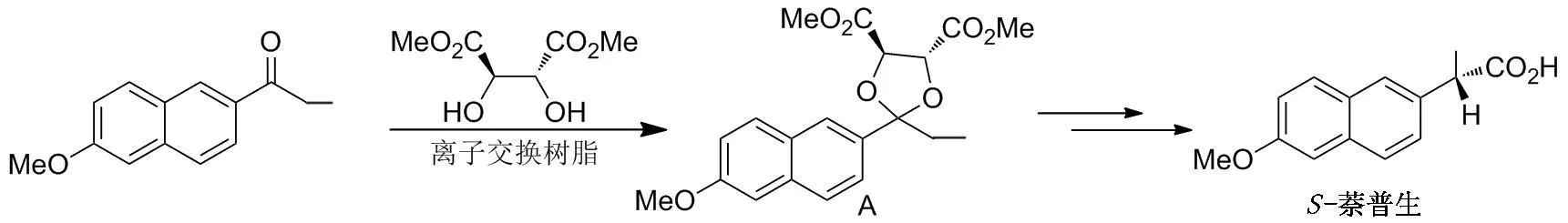
Scheme 1
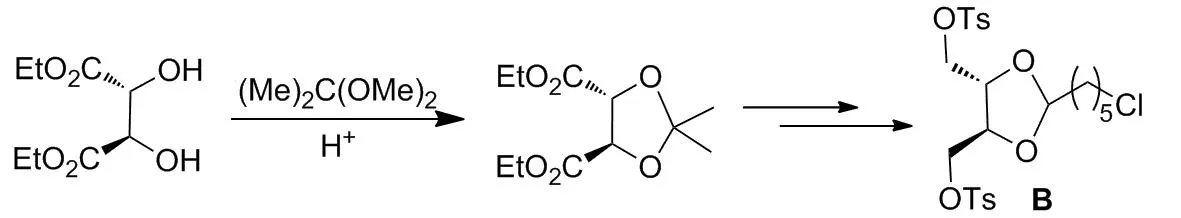
Scheme 2

Scheme 3

Scheme 4

Scheme 5
2010年,杜有国等[52]以酒石酸二乙酯为原料,通过缩醛化、还原、酰化、叠氮化、还原、配位、再配位等反应合成了抗肿瘤药物庚铂E(Scheme 5)。
2.3酒石酸酯作为手性萃取选择剂
手性是自然界本质属性之一,随着药物手性和药效关系的深入研究,人们逐渐认识到手性药物的临床意义,如何获得单一旋光手性药物成为当今国际药物研究的热门话题。目前,临床用药的手性药物已经超过50%,其中85%~90%为外消旋体,且不同构型的药物对药效及副作用影响很大,因此,对外消旋体药物的拆分研究显得尤为必要。针对手性药物的拆分,目前已开发了结晶法、酶促拆分法、色谱法等。近年来手性溶剂萃取分离外消旋体受到众多研究者的高度重视,其原理是:利用外消旋体的对映体在两种不溶(或微溶)溶剂中分配系数的不同,以及手性选择剂具有的立体选择性和手性识别功能,经过多级萃取来达到外消旋体的拆分。

酮洛芬(Ketoprofen, Chart 2)是一种优良的非甾体类消炎镇痛药物,临床上用于治疗慢性类风湿性关节炎、变形性关节炎外伤和术后疼痛等。2012年,周丹等[53]采用手性液-液萃取法萃取拆分酮洛芬对映体,以酒石酸酯为手性萃取剂,研究了手性选择体种类和酒石酸正丁酯浓度对分配系数K和分离因子α的影响。结果表明:(1)有机相中加入(L)-酒石酸酯为手性选择体时,α增大;有机相中加入(D)-酒石酸酯为手性选择体时,α减少。这说明(L)-酒石酸酯对酮洛芬的萃取分离效果明显强于(D)-酒石酸酯;(2)对于所有的(L)-酒石酸酯,KS>KR;而对于所有的(D)-酒石酸酯,KS
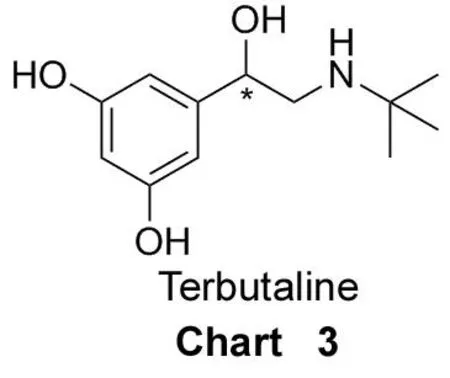
特布他林(Terbutaline, Chart 3)是β2-肾上腺素受体激动剂药物,对于β2-受体有拟交感活性,广泛用于治疗哮喘性支气管炎、支气管哮喘和肺气肿等疾病。目前,临床上使用是外消旋体。研究表明,R-构型的特布他林左旋体对β2-受体的激动作用是S-构型右旋体的200倍。因此,开发光学活性的手性特布他林具有十分重要的意义。2005年,焦飞鹏等[54]以L-酒石酸己酯(DHT)为手性选择剂,研究了特布他林对映体在水-有机溶剂两相体系中的萃取分配行为。基于实验已确定的萃取条件,采用液膜逆流萃取技术分离特布他林对映体。为证明该系统的可行性,作者进行了传质性能实验,产品光学纯度可达99%。
多巴(Dopa, Chart 4),又称二羟苯丙氨酸,是体内合成多巴胺的前体。1950年,瑞典科学家Arvid Carlsson首次证明多巴可以用于减轻帕金森综合症,并因此获得了2000年的诺贝尔生理学或医学奖。然而,左旋多巴的对映体D-dopa则具有毒性,在使用L-dopa和D-dopa的外消旋体药物时,由于活性和非活性成分不同的代谢而造成严重的副作用。因此,单一构型的多巴的制备和分离具有重要的社会价值。2009年陈春燕等[55]以酒石酸正己酯为手性选择剂,研究了多巴对映体在水-有机溶剂两相的萃取分配行为。研究表明:(1)酒石酸正己酯对多巴对映体具有手性识别作用,适合萃取分离外消旋体多巴;(2)酒石酸正己酯与R-多巴对映体形成非对映体复合物的稳定性要比与S-多巴对映体结合形成的非对映体复合物的稳定性更强一些,酒石酸正己酯更适合萃取分离R-多巴;(3)随着酒石酸正己酯浓度的增加,多巴对映体的分配系数(K)增大,分离系数(α)先增加后减小。

特非那定(Terfenadine, Chart 5),是一个抗过敏药,用于季节性和非季节性过敏性鼻炎、荨麻疹及枯草热的治疗。从结构可以看出,特非那定有一个手性中心,但目前临床上以消旋体给药。近年来的研究证明,该药物在人体内的代谢具有立体选择性,因此,合成分离单一构型的该药物具有重要意义。
2006年,盛盈等[56]研究了疏水性L-酒石酸酯萃取分离特非那定对映体。该方法以酒石酸酯为手性萃取选择剂,研究了不同酒石酸酯对特非那定对映体I和II分离效果的影响。结果表明:(1)对于所研究的所有的酒石酸酯,KII>KI,说明酒石酸酯与Ⅱ对映体形成的非对映异构体比与Ⅰ对映体形成的非对映异构体稳定性要强;(2)酒石酸正己酯的KII最大,说明酒石酸正己酯对特非那定在有机相-水中的分配能力最强;(3)酒石酸正己酯的α值最大,这说明酒石酸正己酯最适合萃取分离特非那定;(4)特非那定对映体的分配系数K值和分离因子α值都随着酯的浓度的增加而增加,当酯的浓度约为0.25 mol·L-1时,其分离因子α值达到最大;酯浓度继续增加时,α值反而开始下降。
氧氟沙星[Ofloxacin(OFLX), Chart 6]是喹诺酮类药物中的一种,具有广谱抗菌作用,对多数肠杆菌科细菌,如大肠埃希菌、克雷伯菌属、变形杆菌属、沙门菌属和流感嗜血杆菌、嗜肺军团菌、淋病奈瑟菌等革兰阴性菌有较强的抗菌活性。研究表明,对于革兰阴性菌和阳性菌,S-(-)-OFLX的抗菌活性是R-(+)-OFLX的8~128倍,是氧氟沙星外消旋体的2倍,其不良反应比氧氟沙星外消旋体低。因此,研究高光学纯度左旋氧氟沙星的制备方法成为近年热门课题之一。
2003年,唐课文等[57]以酒石酸酯为手性选择体,研究了氧氟沙星对映体在水-有机溶剂两相中的萃取分配行为。结果表明:(1)酒石酸酯构型上有光活性特征,对氧氟沙星具有立体选择性和手性识别功能,适合萃取分离外消旋氧氟沙星;(2)酒石酸酯与R-OFLX对映体形成的非对映体复合物在疏水相中的稳定性比与S-OFLX对映体形成的非对映体复合物好,即酒石酸对R-OFLX的萃取能力大于S-OFLX的萃取能力;(3)随酒石酸酯烷基链的增长,OFLX对映体立体选择性增强,分配系数增大。
奥昔布宁(Xxybutynin, Chart 7)是一种主要作用于副交感神经系统的药物,具有很强的平滑肌解痉作用,较强的镇痛作用,较弱的抗胆碱能作用及局部麻醉作用,可用于治疗尿急、尿频、尿失禁、夜间遗尿等疾病。
研究表明:奥昔布宁的S-型对映体比其消旋体药效高、副作用少。α-环己基扁桃酸(α-cyclohexyl-mandelicacid,简称CHMA, Chart 7)是合成奥昔布宁药物的关键前体,也可以用于合成多种具有重要生物活性及良好疗效的手性药物,因此,对光学纯度的α-环己基扁桃酸研究具有重大意义。2007年,唐课文研究小组[58]以酒石酸异丁酯和β-环糊精衍生物为手性萃取剂,采用双相(O/W)识别体系萃取拆分α-环己基扁桃酸消旋体。
结果表明:(1)有机相中不加酒石酸异丁酯时,α值总大于1,说明β-环糊精衍生物对R-CHMA识别能力大于对S-CHMA的识别能力,其中HP-β-CD识别能力最强;(2)当有机相中加入D-酒石酸异丁酯后,α值比不加时提高了很多,且K值均增大,这说明,加入D-酒石酸异丁酯萃取剂对R-CHMA识别能力进一步增大,且CHMA在两相中的分配能力增强;(3)当有机相中加入L-酒石酸异丁酯后,α值比不加时降低,说明L-酒石酸异丁酯能够增强手性萃取剂对S-CHMA识别能力,同样可以提高CHMA在两相中的分配能力。
自从双相(O/W)识别萃取体系被提出后,该萃取体系在分离外消旋体方面得到广泛的应用。2008年,唐课文等[59]以羟丙基-β-环糊精(HP-β-CD)和酒石酸异丁酯为手性萃取选择剂,采用双相(O/W)识别手性萃取分离萘普生对映体。研究表明:双相(O/W)识别手性萃取体系水相中的羟丙基β-环糊精对S-萘普生对映体的识别能力大于对R-萘普生对映体的识别能力,而有机相中的酒石酸异丁酯对R-萘普生对映体的识别能力大于对S-萘普生对映体的识别能力,且双相(O/W)识别手性萃取的分离能力比单相识别手性萃取的分离能力大。2012年,李洪建研究小组[60]同样以羟丙基-β-环糊精(HP-β-CD)以及L-酒石酸异丁酯(L-IBTA)为手性萃取选择剂,采用双相(O/W)识别体系对苯基琥珀酸对映体的萃取拆分过程进行动力学研究。
2.4酒石酸酯作为手性配体
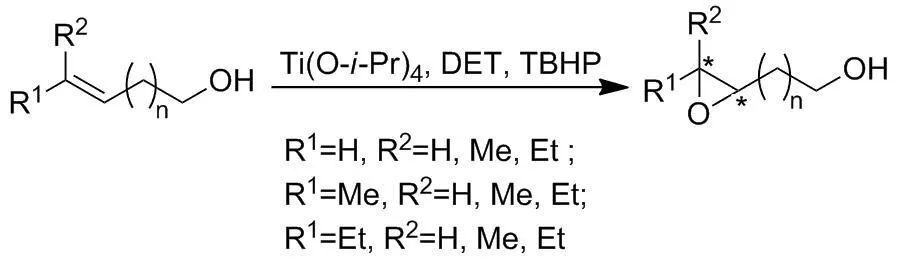
1980年,Sharpless课题组[61]报道了一种新的烯丙醇类化合物不对称环氧化试剂——Sharpless试剂,其组成为:酒石酸二乙酯,四异丙氧基钛和叔丁基过氧化氢(TBHP)。随后,烯丙醇不对称环氧化的相关报道越来越多[62-63]。1984年,Sharpless课题组[64]又报道了高烯醇的不对称环氧化反应,ee值达55%(Scheme 6)。
Scheme 6
手性端基烯丙醇(S)-1-十四烯-3-醇是合成白蛾性信息素最关键的手性合成子,因此,制备高光学纯度的(S)-1-十四烯-3-醇是关键。2004年,车超等[65]研究了手性酒石酸酯对不对称环氧化反应动力学拆分DL-1-十四烯-3-醇的催化选择性(Scheme 7)。该反应的原理是利用Sharpless不对称环氧化反应对二级烯丙醇底物具有对映选择性。用D-(-)-酒石酸酯作为手性配体,R-构型的环丙化速率远远大于S-构型的,因此没有反应的S-构型被回收。
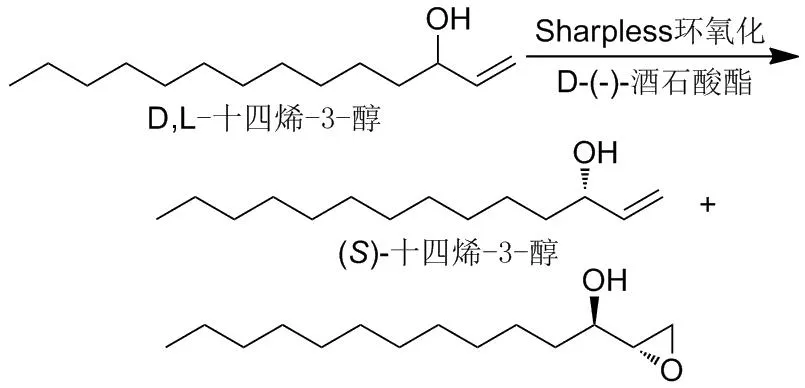
Scheme 7
作者对不同手性配体D-酒石酸酯进行了研究,结果表明:当过氧化叔丁醇(TBHP)的用量为0.6 eq.时,反应到4.5~7d可以达到理想的转化率,而且随着酒石酸酯的酯基的位阻变大,拆分得到的十四烯-3-醇对映选择性越高。比如用位阻较少的D-(-)-酒石酸乙酯,拆分得十四烯-3-醇,ee值仅90.0%;而用位阻较大的D-(-)-酒石酸环十二己酯,相应的醇的ee值高达99%。虽然D-(-)-酒石酸环十二己酯为手性配体拆分得到的ee值最高,但是其和底物烯丙醇较难分离,造成分离产率较低。而用0.7 eq.TBHP时,使用D-(-)-酒石酸环己酯为手性配体,拆分得十四烯-3-醇,ee>99%,且分离收率高达85%。综合考察,最好的手性配体为D-(-)-酒石酸环己酯。
手性亚砜具有广泛而重要的应用价值,它可以作为手性辅剂或中间体用于合成复杂的手性天然产物;也可以作为手性配体或手性催化剂用于多种不对称催化反应;同样可以作为手性药物,因此,光学纯的亚砜的合成很有意义。2008年,谢昆研究小组[66]以酒石酸二乙酯为配体,叔丁基过氧化氢为氧化剂,四异丙氧基钛为金属源,通过不对称氧化合成手性吡啶亚砜,立体选择性高达89%。
在有机合成中,手性高烯丙基醇是一类重要中间体,在许多医药和天然分子合成中都具有广泛的应用。其中,手性烯丙基硼试剂,手性烯丙基硅试剂,手性烯丙基锡试剂(Chart 8)等与醛的不对称烯丙基化反应是合成手性高烯丙基醇最直接最有效的方法,而酒石酸酯是合成这类试剂最重要的配体。
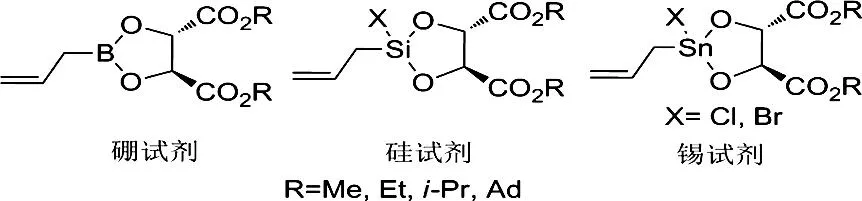
Chart 8
1985年Roush等[67]首次报道了酒石酸酯改性的烯丙基硼试剂和醛的不对称烯丙基化反应(Scheme 8)。使用烯丙基硼试剂与各种醛反应,收率最高能达到95%,反应的立体选择性高达87%。1987年,Umani-Ronchi课题组[68]首次报道了酒石酸酯改性的有机锡试剂与醛的不对称烯丙基化反应(Scheme 9)。

Scheme 8

Scheme 9
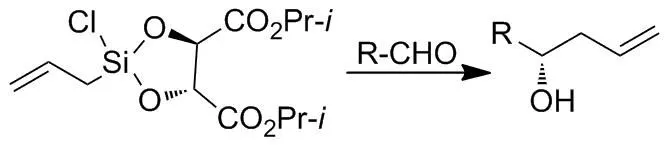
Scheme 10
1999年,Wang课题组[69]报道了用酒石酸二异丙酯和烯丙基三氯化硅反应得到手性烯丙基硅试剂,在路易斯酸的作用下与醛反应,以高达81%的ee值获得一系列高烯丙基醇化合物(Scheme 10)。
3结论与展望
目前,合成酒石酸酯类化合物的方法已经较多,但报道最多的方法是酒石酸和醇在酸的催化下酯化。而所用的催化剂酸既可以是布朗斯特酸(硫酸,盐酸,对甲苯磺酸,硼酸等),也可以是路易斯酸(氯化镍,氯化钐等),还可以是固体酸以及离子交换树脂[(DOWEX 50 WX8(H+-form, 732强酸性阳离子交换树脂,D72树脂等]。
随着手性药物的发展,酒石酸酯类化合物的应用越来越广泛。在手性源方面,酒石酸酯具有两个天然的手性中心,可以作为手性源来合成某些手性药物或重要中间体。同时可以以酒石酸酯为手性源合成一些手性配体(如膦配体),进而通过不对称方法来合成一些手性药物;在手性助剂方面,酒石酸酯本身就是一种很好的手性助剂。最典型的例子是用于合成S-萘普生;在手性配体方面,酒石酸也就是一种很好的配体,可以与金属络合进行不对称反应来合成手性药物,最典型的例子是不对称Shrapless环氧化反应;在药物拆分方面,酒石酸酯是一种很好的拆分剂,如可通过多级萃取拆分酮洛芬,特布他林等药物。同时,酒石酸酯可以和另外的手性拆分剂(如β-环糊精衍生物)一起使用来提高拆分效果。
虽然目前酒石酸酯类化合物的合成工艺比较成熟,但是随着人们对手性药物光学纯度的要求越来越高,往往用简单的酒石酸酯来拆分很难达到要求,且能用酒石酸酯拆分的药物有限。因此合成一些结构新颖、对药物拆分效果很理想的酒石酸酯很有必要。同时,可以设计并合成一类广谱的酒石酸酯,用于各类药物的拆分。当然,酒石酸酯在手性助剂和手性源方面的研究还有待更深入的研究,以期能更好的应用酒石酸酯类化合物。
参考文献
[1]Bowman N S, McCloud G T, Schweitzer G K. Partial resolutionn of some organic racemates by solvent extraction[J].J Am Chem Soc,1968,90(7):3848-3852.
[2]Kocienski P, Street S D A. An economical large scale preparation of (2S,3S)-4,5-dimethyl-2-phenyl-L,3- dioxolan[J].Synthetic Commun,1984,14(12):1087-1092.
[3]Meier B, Kollroser M, Presser A. An optimized synthetic route for the preparation of the versatile chiral building block 1,4-di-O-benzylthreitol[J].Monatshefte fuer Chemie,2014,145(2):305-309.
[4]Musich J A, Rapoport H. Synthesis of anthopleurine, the alarm pheromone from Anthopleura elegantissima[J].J Am Chem Soc,1978,100(15):4865-4872.
[5]孟祥华,施继成,童庆松,等. 含吡啶基的L-酒石酸衍生物的合成[J].合成化学,2008,16(6):648-651.
[6]Anand R C, Selvapalam N A. Convenient and mild pro cedure for the preparation of hydroxyesters from lactones and hydroxyacids[J].Synthetic Commun,1994,24(19): 2743-2747.
[7]南柱石,胥波. (2R, 3R)-酒石酸二甲酯制备的改进[J].中国医药工业杂志,1997,28(6):271-272.
[8]胡艾希,赵海涛,范国枝,等. 离子交换树脂催化合成(2R,3R)-酒石酸二甲酯[J].湖南大学学报,1998,25(1):23-26.
[9]Ram R N, Charles I. Selective esterification of aliphatic nonconjugated carboxylic acids in the presence of aromatic or conjugated carboxylic acids catalysed by NiCl2·6H2O[J].Tetrahedron,1997,53(21):7335-7340.
[10]Chatterjee T, Chattopadhyay S. A simple, convenient and expeditious route to methyl esters of carboxylic acids by thionyl chloride-methanol [J].Orient J Chem,2002,18(2):187-190.
[11]姜艳,卜云飞,李正义,等. 新型C2轴对称吡啶羧酸酯手性多齿配体的合成[J].合成化学,2011,19(1):81-84.
[12]de Napoli L, Messere A, Palomba D,etal. Studies toward the synthesis of pinolidoxin,a phytotoxic nonenolide from the fungus ascochyta pinodes.Determination of the configuration at the C-7,C-8,and C-9 chiral centers and stereoselective synthesis of the C6-C18fragment[J].J Org Chem,2000,65(11):3432-3442.
[13]Shinada T, Hamada M, Miyoshi K,etal. Mild and catalytic transesterification reaction using K2HPO4for the synthesis of methyl rsters[J].Synlett,2010(14):2141-2145.
[14]Baumhof P, Mazitschek R, Giannia A. A mild and effective method for the transesterification of carboxylic acid esters[J].Angew Chem Int Ed,2001,40(19):3672-3674.
[15]王帮贺,王国胜. L-酒石酸二乙酯的合成[J].当代化工,2007,36(2):134-135.
[16]Wu Z L, Huang Y J, Zhang C H,etal. A simple and efficient way to synthesize optically active polyamides by solution polycondensation of di-O-methyl-L-tartaryl chloride with diamines[J].J Appl Polym Sci,2010,117(6):3558-3567.
[17]黄颜炯,薛东桦,吴作林. (R,R)-(+)-2,3-二甲氧基-N,N,N′,N′-四环己丁二酰胺的合成与表征[J].长春工业大学学报(自然科学报),2008,29(6):637-642.
[18]Zeng J, Zhang Q, Zhang H K,etal. Practical synthesis of trans-dihydroxybutyrolactols as chiral C4building blocks and their application to the synthesis of polyhydroxylated alkaloids[J].RSC Adv,2013,3(43):20298-20307.
[19]Seebach D, Langer W. Enantioselective 1,4-additions of organometallic compounds to conjugated systems in the chiral medium DDB[J].Helv Chim Acta,1979,62(6):1710-1722.
[20]Belokon′ Yu N, Maleev V I, Gugkaeva Z T,etal. Tetraaryl-1,3-dioxolane-4,5-dimethanols as catalysts for the addition of trimethylsilyl cyanide to benzaldehyde and the oxirane ring[J].Russ Chem Bull,2007,56(8):1507-1514.
[21]林崇熙,柳敬元,王安,等. 酒石酸衍生物的合成及其结构与光学活性关系的探讨[J].北京大学学报(自然科学报),2002,38(6):739-743.
[22]徐国春,孙君坦,何炳林. 手性双麟配体(4S,5S)-(-)-DIOP的合成[J].高等学校化学学报,1993,14(10):1471-1472.
[23]Houston T A, Wilkinson B L, Blanchfield J T. Boric acid catalyzed chemoselective esterification ofα-hydroxycarboxylic acids[J].Org Lett,2004,6(5):679-681.
[24]王国胜,王红心,王祝敏,等. 硼酸催化合成L-(+)-酒石酸二乙酯[J].现代化工,2007,27(2):237-239.
[25]王国胜,宁志高. 利用硼酸催化合成手性L-或D-酒石酸二乙酯的方法:CN 101 100 428[P],2007.
[26]Maki T, Ishihara K, Yamamoto H.N-alkyl-4-boronopyridinium Halides versus boric acid as catalysts for the esterification ofα-hydroxycarboxylic acids[J].Org Lett,2005,7(22):5047-5050.
[27]Maki T, Ishihara K, Yamamoto H. New boron(III)-catalyzed amide and ester condensation reactions[J].Tetrahedron,2007,63(35):8645-8657.
[28]吴桐, 王国胜. 离子交换树脂催化合成L-(+)-酒石酸二乙酯的研究[J].化学工程师,2009,23(9):1-3.
[29]Thaharn W, Bootwicha T, Soorukram D,etal. Asymmetric synthesis of gem-difluoromethylenated dihydroxypyrrolizidines and indolizidines[J].J Org Chem,2012,77(19):8465-8479.
[30]Gopinath P, Nilaya S, Muraleedharan K M. Highly chemoselective esterification reactions and Boc/THP/TBDMS discriminating deprotections under samarium(III) catalysis[J].Org Lett,2011,13(8):1932-1935.
[31]Zhou X, Liu W J, Ye J L,elal. A versatile approach to pyrrolidine azasugars and homoazasugars based on a highly diastereoselective reductive benzyloxymethylation of protected tartarimide[J].Tetrahedron,2007,63(27):6346-6357.
[32]Zheng J L, Liu H, Zhang Y F,etal. A study on the racemization step in the synthesis of pyrrolidinols via cyclicα-hydroxyimides[J].Tetrahedron:Asymmetry,2011,22(3):257-263.
[33]Alazard J P, Kagan H B, Setton R. Nouveaux exemples d’utilisation du bisulfate de graphite et du nitrate de graphite en synthése organique[J].Bulletin de la Societe Chimique de France,1977,5-6:499-504.
[34]Trova M P, Gauuan P J F, Pechulis A D,etal. Superoxide dismutase mimetics.Part 2:Synthesis and structure-activity relationship of glyoxylate- and glyoxamide-derived metalloporphyrins[J].Bioorgan Med Chem,2003,11(13):2695-2707.
[35]Kazemi F, Kiasat A R, Mombaini B. Na2CO3/SOCl2:A mild and convenient reagent for the preparation of isopropyl carboxyl ates[J].Phosphorus,Sulfur,and Silicon and the Related Elements,2004,179(6):1187-1191.
[36]魏燕,韩小茜,李军,等. L-酒石酸正丁酯的合成[J].化学工程师,2007,139(4):1-2.
[37]黄灵芝,李丽峰,黄朋勉,等. L-酒石酸异丁酯的合成[J].长沙理工大学学报(自然科学版),2007,4(4):91-93.
[38]陈国斌,唐课文,陈铁华,等. 疏水性L-酒石酸正戊酯的合成[J].精细化工,2004,21(10):738-740.
[39]陈国斌,唐课文,陈铁华,等. L-酒石酸正己酯的合成[J].合成化学,2004,12(3):207-209.
[40]唐课文,陈国斌,李娟. D-酒石酸正辛酯的合成[J].合成化学,2005,13(1):77-79.
[41]吕迎春,赵丽,孙文卓. L-酒石酸正癸酯的合成[J].思茅师范高等专科学校学报,2009,25(3): 18-20.
[42]计海峰,王卫东,刘保雷,等. 硼酸催化合成L-(+)-酒石酸二苄酯[J].吉林化工学院学报,2014,31(11): 3-5.
[43]计海峰,刘保雷,刘放,等. L-(+)-酒石酸酯类化合物的合成研究[J].广州化工,2014,42(22):95-97.
[44]杨涛,周从山,彭彦舟,等. D-酒石酸十二酯的合成[J].广州化工,2011,39(23):39-41.
[45]Harrisonl T, Lewis B, Nelson P,etal. Nonsteroidial antiinflammatory agents 6-substituted -2-naphthylacetic acids[J].J Med Chem,1970,13(2):203-205.
[46]Giordano C, Castaldi G, Uggeri F. Synthesis of anti-Inflammatoryα-arylalkanoic acids by 1,2-aryl shift.New synthetic methods(42)[J].Angew Chem Int Ed Engl,1984,23(6):413-419.
[47]胡艾希,范国枝,赵海涛. (2S)-(+)-1-(6′-甲氧基-2′-萘基)丙-1-酮的不对称合成[J].有机化学,1999,19:93-96.
[48]胡艾希,范国枝,赵海涛,等. (1′S,4R,5R)-2-(1′-溴乙基) -2-(5-溴-6-甲氧基-2-萘基)-1, 3-二氧戊环-4, 5-二羧酸的不对称合成[J].应用化学,1999,16(1):110-112.
[49]王来来,高平,李红兵,等. 萘普生不对称合成的中间体缩酮制备方法改进[J].中国医药工业杂志,1996,27(8):371-372.
[50]邹贵祥,贾卫民,张遂之. (4S,5S)-4,5-双(对甲苯磺酸酯甲基)-2-(6-氯)正己基-1,3-二氧戊环的合成与表征[J].化学试剂,1999,21(3):129-130.
[51]王德才,徐伟,葛恒平,等. 2-芳基-(4S,5S)-4,5-双(胺甲酰基)-1,3-二氧戊环的合成[J].合成化学,2010,18(3):335-337.
[52]杜有国,宗在伟,李志敏,等. 新型抗肿瘤药庚铂的合成研究[J].化工时刊,2010,24(7):9-11.
[53]周丹,刘佳佳. L-酒石酸正丁酯萃取拆分酮洛芬外消旋体[J].化学试剂,2012,34(2):169-172.
[54]焦飞鹏,黄可龙,彭霞辉,等. 手性选择剂萃取分离特布他林对映体[J].应用化学,2005,22(8):818-822.
[55]陈春燕,谢佳琦,陈小明. 手性液-液萃取分离多巴对映体[J].湘潭大学自然科学学报,2009,31(3):85-89.
[56]盛盈,黄可龙,阎建辉. 疏水性L-酒石酸酯萃取分离特非那丁对映体[J].分析化学研究简报,2006,34(11):1583-1586.
[57]唐课文,周春山. 疏水性L-酒石酸酯萃取分离氧氟沙星对映体[J].化工学报,2003,54(12):1329-1372.
[58]唐课文,张国丽,黄可龙,等. 双相(O/W)识别手性萃取分离α-环己基扁桃酸对映体[J].中国科学B辑:化学,2007,37(5):463-467.
[59]唐课文,陈圆圆,刘佳佳. 双相(O/W)识别手性萃取分离萘普生对映体[J].中国药学杂志,2008,43(8):620-623.
[60]李洪建,唐有根,唐课文,等. 双相(O/W)识别手性萃取苯基琥珀酸对映体的动力学研究[J].中南大学学报(自然科学版),2012,43(2):440-444.
[61]Lockhart T P, Mallon C B, Bergman R G. 2,3-Di-propyl-1,4-dehydrobenzene[J].J Am Chem Soc,1980,102(18):5976-5978.
[62]Rossiter B E, Kabuki T, Sharpless K B. Asymmetric epoxidation provides shortest routes to four chiral epoxy alcohols which are key intermediates in syntheses of methymycin, erythromycin, leukotriene C-1, and disparlure[J].J Am Chem Soc.1981,103(2):464-465.
[63]Martin V S, Woodard S S, Katuki T,etal. Kinetic resolution of racemic allylic alcohols by enantioselective epoxidation.A route to substances of absolute enantiomeric purity[J].J Am Chem Soc,1981,103(20):6237-6240.
[64]Rossiter B E, Sharpless K B. Asymmetric epoxidation of homoallylic alcohols.Synthesis of (-)-.gamma.-amino-.beta.-(R)-hydroxybutyric acid(GABOB)[J].J Org Chem,1984,49(20):3707-3711.
[65]车超,张钟宁,黄桂兰,等. 手性酒石酸酯对不对称环氧化反应动力学拆分DL-1-十四烯-3-醇的催化选择性[J].有机化学,2004,24(10):1281-1283.
[66]谢昆. R基-3-吡啶基硫醚不对称氧化[J].重庆三峡学院学报,2008,24(110):97-99.
[67]Roush W R, Walts A E, Hoong L K. Diastereo- and enantioselective aldehyde addition reactions of 2-allyl-1,3,2-dioxaborolane-4,5-dicarboxylic esters,a useful class of tartrate ester modified allylboronates[J].J Am Chem Soc,1985,107(26):8186-8190.
[68]Boldrini G P, Lodi L, Tagliavini E,etal. Synthesis of enantiomerically enriched homoallylic alcohols and of 1,2-dien-1-ols using chiral tin(IV) complexes containing diethyl tartrate as an auxiliary ligand[J].J Org Chem,1987,52(54):5447-5452.
[69]Wang D, Wang Z G, Wang M W,etal. Asymmetric allylation of aldehydes and glyoxylates through ‘C-centered’ chiral pentacoordinate allylsilicates or promoted by Lewis acid[J].Tetrahedron:Asymmetry,1999,10(2):327-338.
Research Progress of Synthesis and Applications of Tartaric Esters
LIU Bin1,ZHAO Jian-qiang2,ZHOU Ming-qiang1,2*
(1. Chengdu Likai Chiral Tech. CO., Ltd., Chengdu 610041, China;2. Chengdu Institute of Organic Chemistry, Chinese Academy of Sciences, Chengdu 610041, China)
Abstract:The synthetic methods of twelve kinds of tartaric esters and the applications of tartaric esters in chiral auxiliaries, chiral ligands, synthesis of ligands as chiral pools and chiral-selector extraction were reviewed with 69 references. Future research orientation and application prospect are proposed.
Keywords:tartaric ester; synthesis; chiral auxiliary; chiral ligand; synthesis of ligand as chiral pool; chiral-selector extraction; review
中图分类号:O621.3; O623.624
文献标志码:A
DOI:10.15952/j.cnki.cjsc.1005-1511.2016.03.15410
作者简介:刘斌(1968-),男,汉族,四川成都人,硕士,主要从事手性药物及中间体的合成研究。 Tel. 028-85231007, E-mail: bliu@cioc.ac.cn通信联系人: 周鸣强,博士,助理研究员, Tel. 028-88201859, E-mail: screenfilm@foxmail.com
基金项目:中国科学院西部之光青年学者项目
收稿日期:2016-01-18

