一种合成多氟联苯类化合物的新方法
计燕萍, 杨 芸, 高广春
(嘉兴学院 医学院 药学系,浙江 嘉兴 314001)
·研究简报·
一种合成多氟联苯类化合物的新方法
计燕萍*, 杨芸, 高广春
(嘉兴学院 医学院 药学系,浙江 嘉兴314001)
摘要:以CuI为催化剂,芳胺与多氟苯经重氮化/偶联一锅反应合成了6个多氟取代的联苯类化合物(3a~3f),收率56%~82%,其结构经1H NMR, (19)F NMR和EI-MS确证。在最佳反应条件[1a 2 mmol, 20%CuI为催化剂,150%四丁基碘化铵为碘化试剂,V(DMSO) ∶V(MeCN)=1 ∶1为溶剂,于130 ℃反应4 h]下,3a收率75%。
关键词:偶联反应; 重氮化反应; 多氟联苯; 合成
多氟取代的联苯类化合物有着很重要的作用[1],在药物化学和材料化学等领域应用广泛[2-5]。因此,探索合成此类化合物的有效快捷方法是目前化学工作者的重要课题。目前,合成该类化合物,主要以卤代芳烃、芳香苯硼酸以及芳香羧酸[6-9]为原料,在过渡金属催化下,经C-C交叉偶联反应的方法实现。
芳香重氮盐由芳胺经重氮化反应制得,有较高的反应活性,作为一种良好的亲核试剂,广泛应用于过渡金属催化的Heck反应,Suzuki-Monaural反应和Sonogashira反应等交叉偶联中[10-12],但很少用于多氟取代联苯类化合物的合成。
本文以芳香苯胺(1a~1e)和多氟苯(2a, 2e~2f)为原料,在CuI的催化下,经重氮化/偶联一锅反应合成了多氟联苯类化合物(3a~3f, Scheme 1),其结构经1H NMR,19F NMR和EI-MS确证。并对反应条件进行了优化。
1实验部分
1.1仪器与试剂
Varian-400 MHz型核磁共振仪(DMSO-d6为溶剂, TMS为内标); Finnigan Trace DSQ或GCT Premier质谱仪(EI源)。
所用试剂均为分析纯,Aldrich公司。
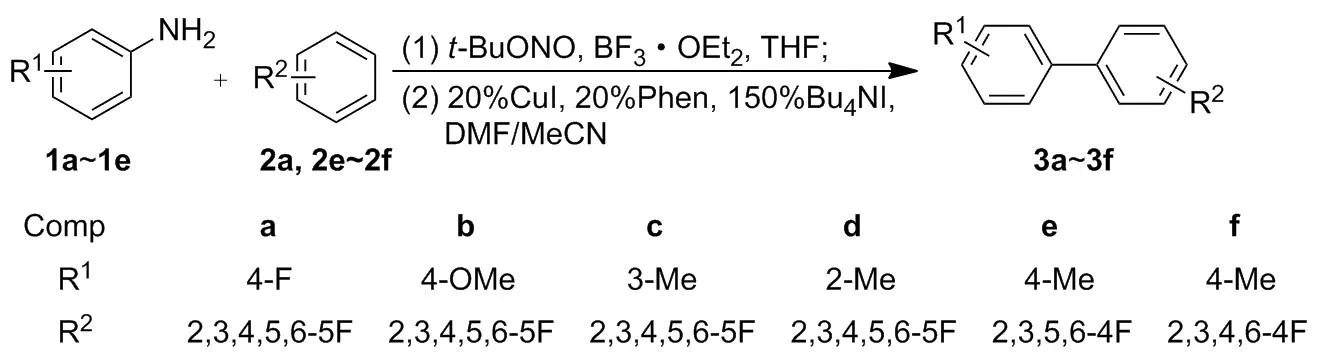
Scheme 1
1.23a~3f的合成通法
在圆底烧瓶中加入1 2 mmol, THF 1 mL和BF3·Et2O 0.30 g,搅拌下于室温反应1 h。转移至-15 ℃低温槽中,滴加叔丁基亚硝酸酯0.25 g(2.4 mmol)的THF(1 mL)溶液,滴毕,反应10 min;于0 ℃反应30 min;于25 ℃反应至终点(TLC监测)。减压浓缩,依次加入四丁基碘化铵(Bu4NI) 1.11 g,碘化亚铜0.08 g, 1,10-菲啰啉(Phen) 0.08 g,无水磷酸钾1.27 g, 2 6 mmol, DMSO 1.5 mL和MeCN 1.5 mL,氮气球保护下于130 ℃反应4 h(TLC监测)。用乙酸乙酯20 mL稀释,用饱和食盐水(3×20 mL)洗涤。水相用乙酸乙酯(3 ×20 mL)萃取,合并有机相,用无水硫酸钠干燥,减压蒸馏后经硅胶柱层析[洗脱剂:V(乙酸乙酯)∶V(石油醚)=1∶1]纯化得白色固体3a~3f。
3a: 收率75%, m.p.111~112 ℃;1H NMRδ: 7.36~7.42(m, 2H), 7.51~7.58(m, 2H);19F NMRδ: -162.70~-162.56(m, 2F), -156.17~-155.98(m, 1F), -143.61(dd,J=7.5 Hz, 22.5 Hz, 2F), -111.88~-111.80(m, 1F); EI-MSm/z: 262[M+]。
3b: 收率82%, m.p.114~115 ℃;1H NMRδ: 3.79(s, 3H), 7.03~7.06(m, 2H), 7.37(d,J=8.0 Hz, 2H);19F NMRδ: -162.89~-162.75(m, 2F), -156.97(t,J=22.5 Hz, 1F), -143.90(dd,J=7.5 Hz, 22.5 Hz, 2F); EI-MSm/z: 274[M+]。
3c: 收率70%, m.p.46~47 ℃;1H NMRδ: 2.36(s, 3H), 7.21~7.28(m, 3H), 7.36~7.39(m, 1H);19F NMRδ: -162.69~-162.56(m, 2F), -156.36~-156.20(m, 1F), -143.50(dd,J=7.5 Hz, 22.5 Hz, 2F); EI-MSm/z: 258[M+]。
3d: 收率56%, m.p.40~42 ℃;1H NMRδ: 2.14(s, 3H), 7.28~7.35(m, 2H), 7.39~7.45
(m, 2H);19F NMRδ: -162.59~-162.45(m, 2F), -155.96(t,J=22.5 Hz, 1F), -141.48(dd,J=7.5 Hz, 22.5 Hz, 2F); EI-MSm/z: 244[M+]。
3e: 收率75%, m.p.88~89 ℃;1H NMRδ: 2.38(s, 3H), 7.33~7.39(m, 4H), 7.89(s, 1H);19F NMRδ: -144.33~-144.21(m, 2F), -139.63~-139.51(m, 2F); EI-MS: 235[M+]。
3f: 收率65%, m.p.71~72 ℃;1H NMRδ: 2.35(s, 3H), 7.28~7.34(m, 4H), 7.83~7.88(m, 1H);19F NMRδ: -167.3~-167.1(m, 1F), -141.3(d,J=22.5 Hz, 2F), -126.8(d,J=11.4 Hz, 1F); EI-MSm/z: 235[M+]。
2结果与讨论
2.1反应条件优化
以3a的合成为模板反应,考察催化剂的种类及其用量、辅助试剂及其用量、反应溶剂及反应温度对3a收率的影响,寻找最佳反应条件。
(1) 催化剂的种类及其用量
1a 2 mmol,其余反应条件同1.2,考察催化剂的种类及其用量对3a收率的影响,结果见表1。
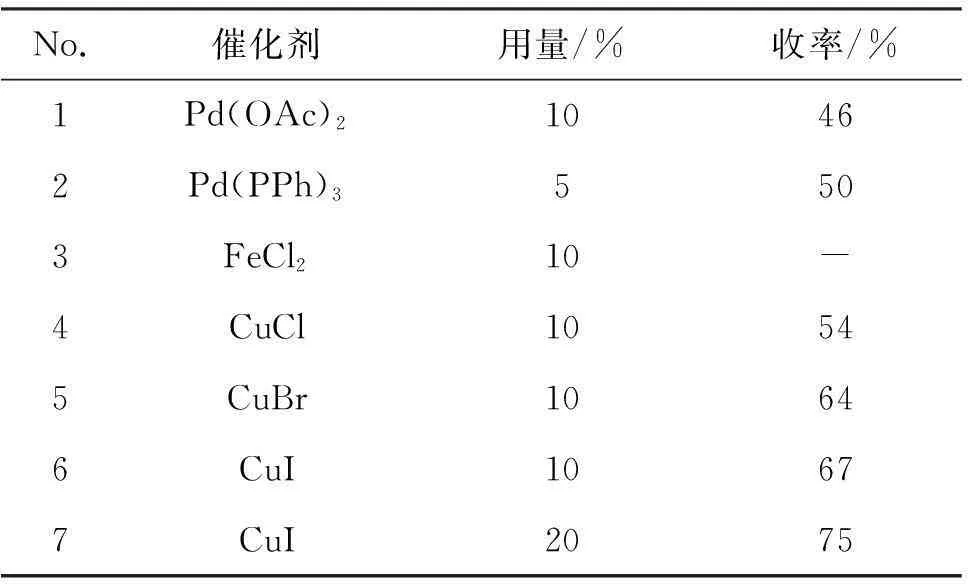
表1 催化剂及其用量对3a收率的影响*
*1a 2 mmol,其余反应条件同1.2。
由表1可见,过渡金属催化剂Pd和Cu均能催化该反应,其中,Cu催化剂的催化效果更佳,而Fe催化剂不能催化该反应(No.3)。Cu的反应活性高于Pd;在相同的反应条件(No.6~No.7)下,CuI用量为20%(摩尔百分数)时,收率更高(75%)。因此,催化剂确定为20%CuI。
(2) 碘化试剂及其用量
以20%CuI为催化剂,其余反应条件同2.1(1),考察碘化试剂对3a收率的影响,结果见表2。由表2可见,KI, NaI和Bu4NI均能有效辅助反应,进而发生C-C交叉偶联反应;但以100%KI或NaI作为辅助试剂时,收率较低(No.1~No.2);以100%Bu4NI为辅助试剂时,收率提高至67%(No.3);增加Bu4NI的用量至150%时,收率提升至75%(No.4);进一步增加其用量,收率无明显提升。因此,较优的碘化试剂为150%Bu4NI。
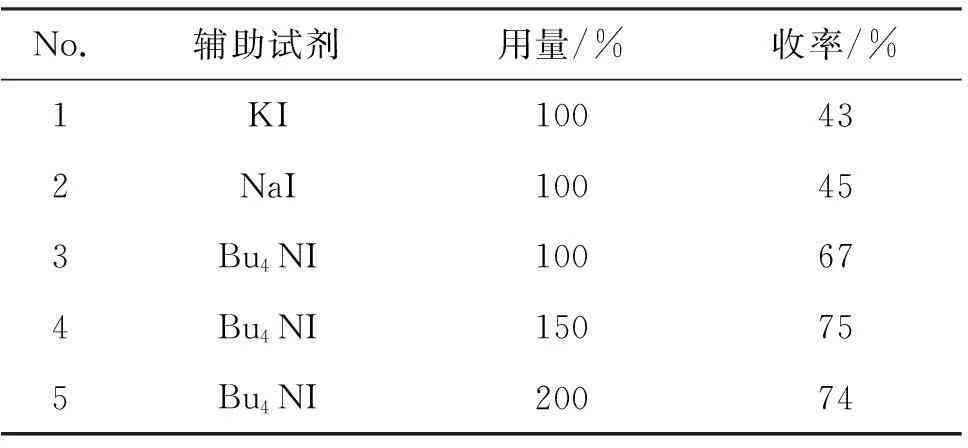
表2 碘化试剂及其用量对3a收率的影响*
*20%CuI为催化剂,其余反应条件同表1。
(3) 反应溶剂
以150%四丁基碘化铵为碘化试剂,其余反应条件同2.1(2),考察溶剂对3a收率的影响,结果见表3。
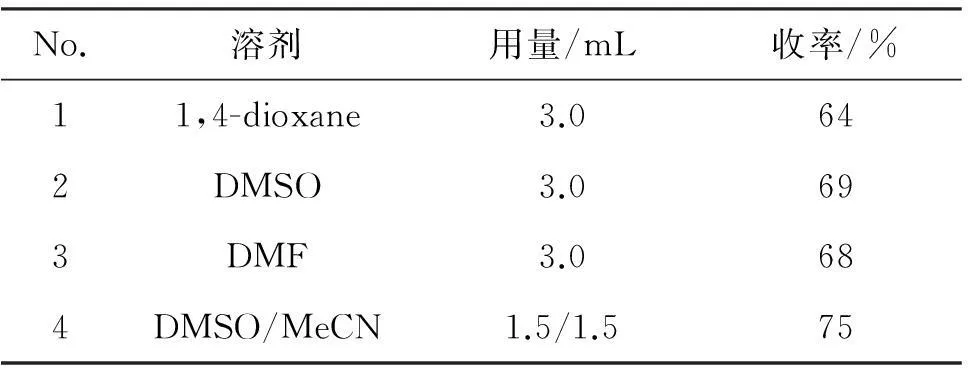
表3 反应溶剂对3a收率的影响*
*150%Bu4NI为碘化试剂,其余反应条件同表2。
由表3可见,反应溶剂对反应收率的影响较小。以1,4-二氧六环, DMSO或DMF为反应溶剂时,收率分别为64%, 69%和68%;以混合溶剂(DMSO/MeCN)为溶剂时,收率较佳(75%, No.4)。因此,较优的反应溶剂为V(DMSO) ∶V(MeCN)=1 ∶1。
(4) 反应温度对反应的影响
以V(DMSO) ∶V(MeCN)=1 ∶1为溶剂,其余反应条件同2.1(3),考察温度对3a收率的影响,结果见表4。由表4可见,反应温度对反应收率的影响较大。当温度过低时,反应基本无法进行(No.1);适当提高温度,反应收率有所提高;当温度为130 ℃时,收率较佳(75%, No.3);继续提高温度,反应收率反而降低。因此,较优的反应温度为130 ℃。
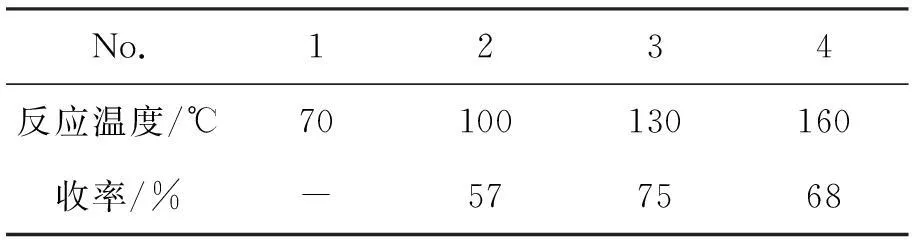
表4 反应温度对3a收率的影响*
*V(DMSO) ∶V(MeCN)=1.5 ∶1.5为溶剂,其余反应条件同表3。
综上所述,合成3a的较优反应条件为:1a 2 mmol, 20%CuI为催化剂,150%Bu4NI为碘化试剂,V(DMSO) ∶V(MeCN)=1 ∶1为溶剂,于130 ℃反应4 h,收率75%。
2.2反应机理
根据反应情况推测,可能的反应机理是不稳定的重氮盐分解,失去一分子N2后与催化剂CuI2、配体Phen形成络合物;络合物在碱作用下失去氢正离子的多氟取代芳香负离子发生偶联反应生成多氟取代的联苯类化合物。
一般的芳香族化合物,由于电负性较弱,无法形成稳定的芳香负离子。而本文介绍的芳香族化合物均为四氟或五氟取代,此类化合物较一般的芳香族化合物电负性强,能形成相对稳定的芳香负离子,进而能发生本文介绍的偶联反应。
以CuI为催化剂,芳香苯胺和多氟苯经重氮化/偶联一锅反应生成多氟取代的联苯类化合物(3a~3f)。该方法的原料易得、官能团的耐受性好。
在最佳反应条件[1a 2mmol, 20%CuI为催化剂,150%四丁基碘化铵为碘化试剂,V(DMSO) ∶V(MeCN)=1 ∶1为溶剂,于130 ℃反应]下,3a收率75%。
参考文献
[1]Purser S, Moore P R, Swallow S,etal. Fluorine in medicinal chemistry[J].Chem Soc Rev,2008,37(2):320-330.
[2]Zahn A, Brotschi C, Leumann C. Pentafluorophenyl-phenyl interactions in biphenyl-DNA[J].J Chem Eur J,2005,11(7):2125-2129.
[3]Babudri F, Farinola G M, Naso F,etal. Fluorinated organic materials for electronic and optoelectronic applications:The role of the fluorine atom[J].Chem Commun,2007,10:1003-1022.
[4]Tang M L, Reichardt A D, Miyaki N,etal. Ambipolar,high performance,acene-based organic thin film transistors[J].J Am Chem Soc,2008,130(19):6064-6065.
[5]Wang Y, Watson M D. Transition-metal-free synthesis of alternating thiophene-perfluoroarene copolymers[J].J Am Chem Soc,2006,128(8):2536-2537.
[6]Lafrance M, Rowley C N, Woo T K,etal. Catalytic intermolecular direct arylation of perfluorobenzenes[J].J Am Chem Soc,2006,128(27):8754-8756.
[7]Lafrance M, Shore D, Fagnou K. Mild and general conditions for the cross-coupling of aryl halides with pentafluorobenzene and other perfluoroaromatics[J].Org Lett,2006,8(22):5097-5100.
[8]Wei Y, Su W P. Pd(OAc)(2)-catalyzed oxidative C-H/C-H cross-coupling of electron-deficient polyfluoroarenes with simple arenes[J].J Am Chem Soc,2010,132(46):16377-16379.
[9]Wei Y, Kan J, Wang M,etal. Palladium-catalyzed direct arylation of electron-deficient polyfluoroarenes with arylboronic acids[J].Org Lett,2009,11(15):3346-3349.
[10]Nan G, Ren F, Luo M. Suzuki-Miyaura cross-coupling reaction of 1-aryltriazenes with arylboronic acids catalyzed by a recyclable polymer-supportedN-heterocyclic carbene-palladium complex catalyst[J].Beilstein J Org Chem,2010,6:70-72.
[11]Coy B E D, Jovanovic L, Sefkow M. One-pot,Pd-catalyzed synthesis of trans-dihydrobenzofurans fromO-aminophenols[J].Org Lett,2010,12(9):1976-1979.
[12]Fan Y M, Qiu D, Yu J. A base-free, one-pot diazotization /cross-coupling of anilines with arylboronic acids[J].Tetrahedron Letters,2011,52(4):518-522.
A New Method for Synthesis of Multiple Fluorine Substituted Biaryl Compounds
JI Yan-ping*,YANG Yun,GAO Guang-chun
(Pharmacy Department, Medical College, Jiaxing University, Jiaxing 314000, China)
Abstract:A new one-pot synthetic method to prepare multiple fluorine substituted biaryl compounds(3a~3f) by diazotization/cross-coupling of aromatic anilines with polyuoroarenes had been developed. The yields were 56%~82%. The structures were confirmed by1H NMR, (19)F NMR and EI-MS.Under the optimized conditions[1a 2 mmol, 20%CuI as the catalyst,150%Bu4NI as the iodide reagent, V(DMSO) ∶V(MeCN)=1 ∶1 as the solvent, at 130 ℃ for 4 h], the yield of 3a was 75%.
Keywords:coupling reaction; diazotization; fluorobiphenyl; synthesis
中图分类号:TQ241.3; O621.3
文献标志码:A
DOI:10.15952/j.cnki.cjsc.1005-1511.2016.03.15359
作者简介:计燕萍(1987-),女,汉族,浙江嘉兴人,硕士,助理实验师,主要从事药物的合成与提取研究。 E-mail: echoypj@163.com
收稿日期:2015-12-25

