茅台酱香型酒曲中黄酮、多酚含量的测定
王兴东,牟明月,杨毓溥,杨承月,李梦洁,张前军,周清娣,卫 钢(1.贵州大学精细化工研究开发中心,贵州贵阳00;.贵州大学化学与化工学院,贵州贵阳00;.贵州茅台酒股份有限公司,贵州仁怀601;.澳大利亚悉尼大学化学学院,澳大利亚悉尼1797;.澳大利亚联邦科学与工业研究组织材料科学与工程,澳大利亚新南威尔士州070)
茅台酱香型酒曲中黄酮、多酚含量的测定
王兴东1,2,牟明月3,杨毓溥2,杨承月2,李梦洁2,张前军2,周清娣4,卫钢5
(1.贵州大学精细化工研究开发中心,贵州贵阳550025;2.贵州大学化学与化工学院,贵州贵阳550025;3.贵州茅台酒股份有限公司,贵州仁怀564501;4.澳大利亚悉尼大学化学学院,澳大利亚悉尼1797;5.澳大利亚联邦科学与工业研究组织材料科学与工程,澳大利亚新南威尔士州2070)
摘要:建立酱香型酒曲中总黄酮、多酚含量测定方法。以槲皮素为对照品,采用紫外分光光度法测定茅台酱香型酒曲中总黄酮含量;以没食子酸为对照品,用Folin-Ciocateau比色法测定酒曲中多酚含量。结果表明,槲皮素及没食子酸对照品分别在浓度0.0210~0.1050 g/L( r= 0.9976)和0.00051~0.00565 g/L( r =0. 9997)范围内与吸光度呈良好线性关系,茅台酱香型酒曲中黄酮和多酚含量分别为9.70 mg/g和1.84 mg/g。此方法简便易行,重现性好,结果稳定、准确,适用于酱香型酒曲总黄酮和多酚的定量测定。
关键词:酱香型酒曲;黄酮;多酚;分光光度法;Folin-Ciocateau法
酒曲是以米粉或麸皮等作为原料,接入母曲,在控制温度和湿度的条件下制成的[1]。茅台酱香型酒曲在制备过程中,赤水河流域特有的微生物群在曲坯上生长繁殖,产生了各种各样复杂的生物化学变化,并形成各种代谢物,对白酒风味、质量起着重要作用。目前有关酒曲研究主要为酒曲中的酶系分析,化学成分研究报道很少,因此,本研究对茅台酱香型酒曲的化学成分进行系统研究,以期阐明茅台酱香型酒曲的物质基础,为酒曲应用提供参考性依据。
1 材料与方法
1.1材料、试剂及仪器
原料:茅台酱香型酒曲(产自贵州省仁怀市茅台镇)。
试剂:槲皮素对照品(中国药品生物制品药物检定所),没食子酸(贵州迪大生物有限公司),水为重蒸水,硝酸铝、亚硝酸钠、氢氧化钠、钨酸钠、钼酸钠、硫酸锂、磷酸、碳酸钠、浓盐酸和溴水;其他试剂均为分析纯。
仪器设备:紫外分光光度计(上海仪电分析仪器有限公司)。
1.2黄酮含量测定方法
1.2.1供试品溶液制备
称取酒曲5.000 g于250 mL的圆底烧瓶中,加入150 mL 75 %vol乙醇回流2 h,回流3次,将3次滤液合并,旋干,用60 %vol的乙醇溶液溶解,置于100 mL容量瓶中,补加60 %vol乙醇溶液至刻度,摇匀,作为供试品溶液[2]。
1.2.2槲皮素标准曲线制作[3]
精密称取槲皮素标准品0.0208 g,用60 %的乙醇定容于100 mL容量瓶中,得0.207 g/L的对照品溶液。
分别取标准品溶液0.0 mL、2.5 mL、5.0 mL、7.5 mL、10.0 mL、12.5 mL,置于25 mL容量瓶中,前5瓶补加60 %vol的乙醇至12.5 mL。再加5 % NaNO20.75 mL,摇匀,放置5 min,加入10 % Al(NO3)30.75 mL,摇匀,放置5 min,加入4 % NaOH 10 mL;分别用60 %vol的乙醇定容至刻度,摇匀,放置15 min[4]。以第一瓶做空白,在510 nm处分别测其吸光度,实验结果见表1。
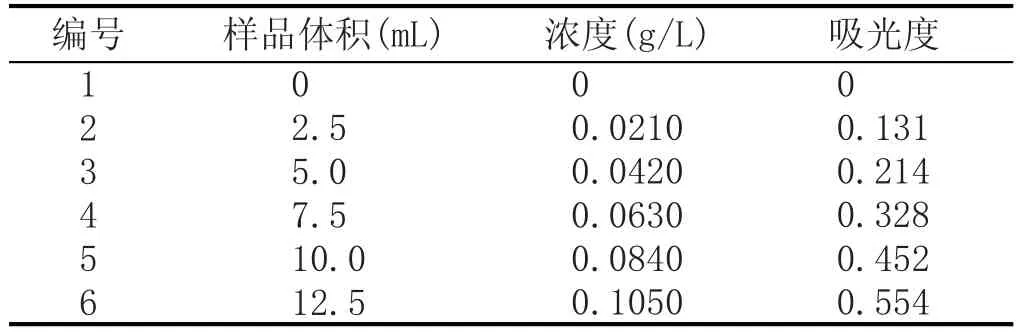
表1 槲皮素标准曲线线性范围实验结果
以对照品浓度为横坐标,以吸光度为纵坐标,绘制标准曲线,线性回归方程为y=5.2150x+0.0064(R2=0.9979)。槲皮素对照品在0.0210~0.1050 g/L范围内呈良好的线性关系。
1.2.3稳定性试验
取同一供试品溶液5.0 mL置于25 mL的容量瓶中,参照1.2.2方法配制后分别放置0 min、15 min、30 min、45 min、60 min后测定吸光度,分别为0.507、0.501、0.510、0.501、0.505,RSD为0.77 %。说明供试品溶液制备后1 h内稳定,吸光度无明显变化。
1.2.4精密度测定
取同一供试品溶液5.0 mL共5份,参照1.2.2方法配制后以不加供试品的相应溶液作为空白试剂,测定其吸光度,分别为0.510、0.509、0.505、0.510、0.511。RSD为0.46 %,说明该方法测定酱香型酒曲总黄酮含量精密度良好。
1.2.5重复性试验
称取同一批酒曲5份,每份5.000 g,重复1.2.1步骤得到待用供试品溶液,取5.0 mL溶液置于25 mL的容量瓶中,参照1.2.2方法配制后,以不加供试品的相应溶液作为空白试剂,测量其吸光度,分别为0.510、0.490、0.530、0.521、0.510,吸光度平均值为0.512,黄酮含量的平均值为9.695 mg/g,RSD为1.77 %。表明该方法测定酱香型酒曲总黄酮含量重现性良好。
1.2.6加样回收试验[4]
称取同一批酒曲5份,每份2.5000 g,参照1.2.1步骤得到待用供试品溶液,称取25.0 mg对照品配制成100 mL的溶液,分别从5份供试品中吸取5.0 mL置于25 mL容量瓶中,再分别吸取5.0 mL的对照品置于上述5瓶溶液中,依照1.2.2方法配制后以不加供试品和对照品的相应溶液作为空白试剂,测定其吸光度,实验结果见表2。
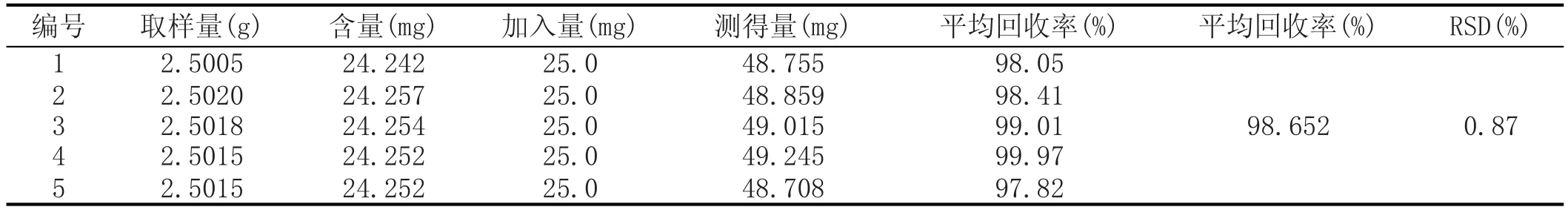
表2 黄酮加样回收率实验结果
1.3总酚含量测定
1.3.1供试品的制备
酒曲干燥粉碎后称取约2 g置于100 mL容量瓶中,加入30 mL无水乙醇,加热回流10 h,抽滤后减压浓缩成浸膏,用无水乙醇溶解至100 mL容量瓶,过滤,滤液作为供试品溶液[5]。
1.3.2福林酚试剂的制备(FC试剂)
称取钨酸钠25 g、钼酸钠6.25 g,然后加175 mL的水、12.5 mL的85 %磷酸、25 mL浓盐酸,置于500 mL的圆底烧瓶中,加入沸石,加热回流10 h,冷却,再加硫酸锂37.5 g、水12.5 mL和溴水适量,加热煮沸15 min,得金黄色溶液,冷却,过滤至250 mL的棕色容量瓶中,加水稀释至刻度。临用前加水1倍,摇匀[6]。
1.3.3对照品溶液的制备
精密称取没食子酸0.0257 g,用60 %vol乙醇溶解,转移至100 mL棕色容量瓶中,用60 %vol乙醇稀释至刻度,摇匀,即得0.257 g/L储备标准品溶液[6]。
1.3.4显色条件的确定[6]
(1) FC试剂体积的确定。精密吸取没食子酸0.2 mL 6份分别置于25 mL容量瓶中,其中5瓶分别加入1.0 mL、1.5 mL、2.0 mL、2.5 mL、3.0 mL FC试剂和4.0 mL 10 %Na2CO3溶液,蒸馏水定容,摇匀,在室温下显色40 min,以相应溶液为空白试剂,在765 nm处测定吸光度。
(2) Na2CO3体积的确定。精密吸取没食子酸0.2 mL 7份分别置于25 mL容量瓶中,其中6瓶分别加入2.0 mL、3.0 mL、4.0 mL、5.0 mL、6.0 mL、7.0 mL的10 % Na2CO3溶液和2.0mL的FC试剂,蒸馏水定容,摇匀,在室温下显色40 min,以相应溶液为空白试剂,在765 nm处测定吸光度。
(3)显色时间的确定
精密吸取没食子酸0.2 mL置于25 mL容量瓶中,加入2.0 mL的FC试剂和4.0 mL的10 % Na2CO3溶液,用蒸馏水定容,以不加入没食子酸的为空白试剂,在室温下显色不同时间,分别在765 nm处测吸光度。
2 结果与分析
2.1标准曲线的制作
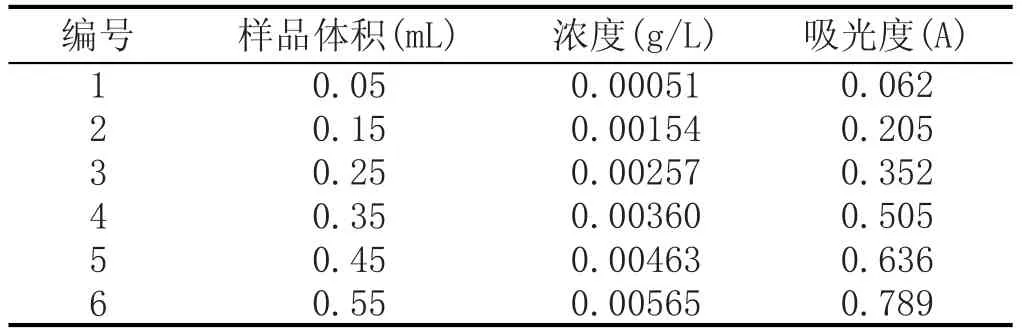
表3 没食子酸标准曲线线性范围实验结果
标准曲线线性回归方程为Y=141.14X-0.0103,R2= 0.9997,没食子酸在0.00051~0.00565 g/L与吸光度线性关系良好。
2.2FC试剂体积的确定

图1 FC试剂加入量对总酚含量测定的影响
由图1可知,FC试剂的加入量会影响总酚的测定值,吸光度的值先减小然后再增大,当加入量为2.5 mL时,测得吸光度为最大,继续加入FC试剂时吸光度减小,因此FC试剂显色剂的最佳加入量为2.5 mL。
2.3Na2CO3体积的确定
由图2可知,10 % Na2CO3缓冲溶液加入量影响总酚的测定值。随着加入量的增大,吸光度随着增大,当10 %Na2CO3加入量达到5 mL时,吸光度达到最大值。此后加入10 % Na2CO3后吸光度逐渐减小,并趋于稳定。因此10 % Na2CO3的加入量最佳值为5.0 mL。

图2 Na2CO3体积对多酚含量的影响
2.4显色时间的确定
精密吸取没食子酸溶液0.2 mL 5份分别置于25 mL容量瓶中,分别加入2 mL FC试剂和4.0 mL Na2CO3,蒸馏水定容,相应溶液做空白对照,在室温下显色不同时间后,在765 nm波长处测定其吸光度。
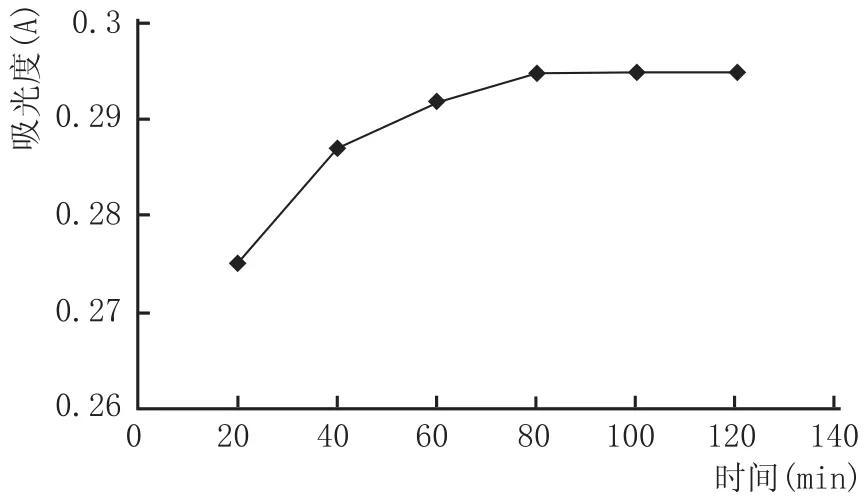
图3 总酚含量随显色时间的变化
由图3可知,显色时间影响总酚的测定值,当显色80 min时,吸光度最大,之后随着时间的延长而无明显变化。
2.5各实验测定
精密吸取0.00、0.05 mL、0.15 mL、0.25 mL、0.35 mL、0.45 mL、0.55 mL对照品溶液置于25 mL容量瓶中,分别加入2.5 mL的FC试剂、5 mL 10 % Na2CO3溶液,用蒸馏水定容,摇匀,室温下显色80 min,以第1瓶为空白试剂,在波长为765 nm处分别测定吸光度[7]。
2.5.1精密度实验[7]
精密吸取同一供试品溶液0.0 mL、5份0.8 mL分别置于25 mL容量瓶中,分别加入2.5 mL的FC试剂、4.0 mL 的10 % Na2CO3溶液,蒸馏水定容至刻度,摇匀,室温下显色80 min,以第1瓶为空白试剂,在765 nm处平行测定吸光度,分别为0.156、0.159、0.155、0.156、0.155,RSD= 2.13 %。
2.5.2稳定性实验[7]
精密吸取0.0、0.8 mL供试品溶液至25 mL容量瓶中,分别加入2.5 mL的FC试剂和4.0 mL的10 % Na2CO3溶液,蒸馏水定容至刻度,摇匀,室温下显色80 min,以第1瓶为空白试剂,在765 nm处每隔10 min测定1次吸光度,测定5次。吸光度分别为0.160、0.157、0.156、0.156、0.154,可以看出在显色80 min后的40 min内吸光度值基本保持不变,稳定性良好。
2.5.3重复性实验
取同一批的酒曲5份,每份约2 g,置于100 mL容量瓶中,加入30 mL无水乙醇,加热回流10 h,抽滤,抽滤后减压浓缩成浸膏,用无水乙醇定容至100 mL,作为供试品。精密吸取0.8 mL供试品溶液,置于25 mL容量瓶中,分别加入2.5 mL的FC试剂和4.0 mL的10 % Na2CO3溶液,用蒸馏水定容至刻度,摇匀,室温下显色80 min,以不加供试品的相应溶液为空白试剂,在765 nm处测定吸光度,分别为0.156,0.156,0.159,0.155,0.155。吸光度平均值为0.156,多酚平均含量为1.841 mg/g,RSD=7.8 %。
2.5.4加样回收实验[7]
称取同一批酒曲5份,每份约1.000 g,按照上述操作制备5份供试品,从中吸取0.8 mL置于5个25 mL容量瓶中,再分别加入0.8 mL对照品溶液,2.5 mL的FC试剂,5 mL10 % Na2CO3溶液,蒸馏水定容,摇匀,相应溶液做空白,在室温下显色80 min后测定其吸光度。以不加供试品和对照品的相应溶液作为空白试剂,测量其吸光度,实验结果见表4。
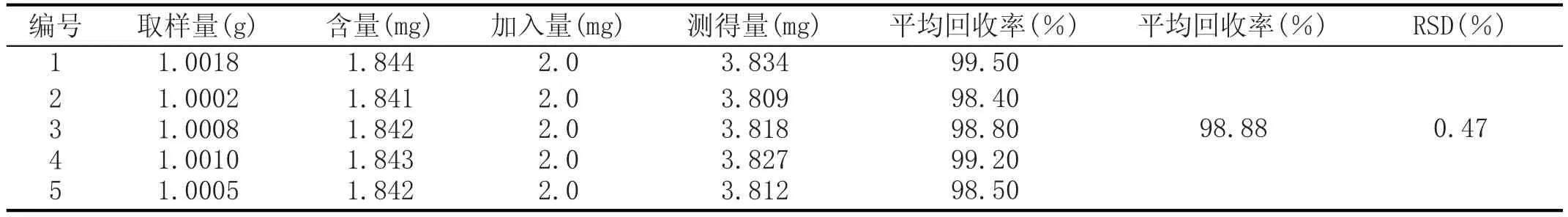
表4 多酚加样回收率实验结果
3 结论
本实验分别以槲皮素和没食子酸为标准品,用Na-NO2-Al(NO3)3-NaOH为显色剂,采用紫外分光光度法测定茅台镇酒曲总黄酮含量,利用福林比色法测定多酚含量,结果表明,茅台酱香型酒曲中黄酮含量为9.695 mg/g,多酚含量为1.841 mg/g。该方法操作简单,结果准确可靠,可作为测定酱香型酒曲黄酮和总酚含量的检测方法。
参考文献:
[1]李健容,蔡爱群.民间传统酒曲主要微生物的分离及鉴定[J].酿酒科技, 2007(5):111-115.
[2]李敏,杨建华,李渊,等.酒花黄酮提取工艺和含量测定[J].食品科学,2011,32(6):16-19.
[3]王敏,高锦明,王军,等.苦荞茎叶粉中总黄酮酶法提取工艺研究[J].中药材,2006,37(11):1645-1646.
[4]李传宽,张前军,康文艺,等.饿蚂蝗中总黄酮含量的测定[J].中国实验方剂学杂志,2011,23(17):58-59.
[5]吴晓青,陈丹,邱红鑫,等.芙蓉李中总多酚含量测定方法的优选[J].中国中医药科技,2011,2(18):131-133.
[6]王岸娜,徐山宝,刘小彦,等.福林法测定猕猴桃多酚含量的研究[J].食品科学,2008,29(7):398-401.
[7]刘顺航,孟宪军,牛涛,等.葡萄籽中总多酚成分的测定[J].中国中医药杂志,2013,22(10):715-716.
Determination of Total Flavonoids and Total Polyphenols Content in Jiangxiang Daqu
WANG Xingdong1,2, MU Mingyue3, YANG Yupu2, YANG Chengyue2, LI Mengjie2, ZHANG Qianjun2, ZHOU Qingdi4and WEI Gang5
(1.Fine Chemical Engineering Research Center, Guizhou University, Guiyang, Guizhou 550025; 2. School of Chemistry and Chemical Engineering,Guizhou University, Guiyang, Guizhou 550025; 3. Maotai Distillery Co.Ltd., Renhuai, Guizhou 564501; 4. College of Chemistry, Sydney University, Sydney 1797,Australia; 5.CSIRO Materials Science and Engineering, Lindfield, NSW 2070,Australia)
Abstract:The method for the determination of total flavonoids and polyphenols content in Jiangxiang Daqu had been developed as follows: total flavonoids content determined by visible spectrophotometry (quercetin as the reference substance) and total polyphenols content determined by Folin-Ciocateau colorimetry (gallicacid as the reference substance). The method had a good linearity in the range of 0.0210~0.1050 g/L of quercetin (r=0.9976) and 0.00051~0.00565 g/L of gallicacid.(r=0.9997). The results showed that the content of total flavonoids and polyphenols in Jiangxiang Daqu were 9.70 mg/g and 1.84 mg/g respectively. Such method was simple to operate with good accuracy and reproducibility and it was suitable for quantitative determination of flavonoids or polyphenols in Jiangxiang Daqu.
Key words:Jiangxiang Daqu; flavonoids; polyphenols; spectrophotometry; Folin-Ciocateau colorimetry
通讯作者:张前军,女,博士,教授,研究方向:天然产物化学,E-mail:qianjunzhang@126.com;卫钢,男,博士,教授,研究方向:有机材料,E-mail:gangwei@csiro.au。
作者简介:王兴东(1987-),男,在读硕士研究生,研究方向:天然产物化学。
收稿日期:2015-09-10;修回日期:2015-11-09
基金项目:教育部“春晖计划”项目(Z2015003)。
DOI:10.13746/j.njkj.2015372
中图分类号:TS261.1;TS62.3;TS261.7
文献标识码:A
文章编号:1001-9286(2016)03-0115-04
优先数字出版时间:2015-12-30;地址:http://www.cnki.net/kcms/detail/52.1051.TS.20151230.0950.009.html。

