化脓性肝脓肿伴发急性肾损伤的危险因素分析
张玉玲,蔡均均,韩涛,周静(天津医科大学第三中心临床学院 天津市第三中心医院,天津300170)
化脓性肝脓肿伴发急性肾损伤的危险因素分析
张玉玲,蔡均均,韩涛,周静(天津医科大学第三中心临床学院 天津市第三中心医院,天津300170)
摘要:目的探讨化脓性肝脓肿(PLA)伴发急性肾损伤(AKI)的危险因素。方法回顾性分析554例PLA患者性别、年龄、伴发疾病、实验室检查指标、治疗及转归等资料,探讨PLA伴发AKI的危险因素。结果PLA伴发AKI的发生率为12.3%(68/554),AKI 1、2、3期各占54.4%、20.6%、25.0%。PLA合并AKI患者(AKI组)年龄>65岁,合并高血压、胆道疾病,行肾脏替代治疗、发生感染性休克或死亡的比例均高于不伴有AKI患者(非AKI组)(P均<0.05),AKI组平均动脉压低于非AKI组(P<0.05)。AKI组白细胞、中性粒细胞比例、AST、尿素氮及血肌酐、国际标准化比值均高于非AKI组,血红蛋白、血小板计数、白蛋白、血钠、凝血酶原活动度、肾小球滤过率均低于非AKI组,两组比较P均<0.05。多因素Logistic回归分析显示,血肌酐升高、高血压、感染性休克是AKI发生的独立危险因素(OR分别为1.269、19.411、34.117,P均<0.05)。结论血肌酐升高、高血压、感染性休克是PLA伴发AKI的独立危险因素。
关键词:化脓性肝脓肿;急性肾损伤;感染性休克;高血压
化脓性肝脓肿(PLA)是消化系统严重且常见的感染性疾病之一。急性肾损伤(AKI)是一种常见的临床综合征,可继发于各种感染性疾病,尤其是重症感染。据报道,败血症或脓毒症合并AKI的发生率为11%~56%[1~4],感染性休克患者AKI发生率高达61%[5]。尽管有许多关于重症感染患者伴发AKI的研究,但有关PLA伴发AKI的研究较少。本研究分析PLA伴发AKI患者的临床特点,探讨其发生的危险因素。
1资料与方法
1.1临床资料选择2006年10月~2014年9月天津市第三中心医院收治的PLA患者554例,男369例、女185例,年龄18~90(57.9±13.6)岁。PLA诊断根据症状、体征,实验室(生化指标和病原菌)、影像学检查(腹部超声、腹部超声造影、腹部CT)及肝穿刺活检等结果。其中369例行肝穿刺脓液细菌培养,阳性率为73.4%(271/369);166例行血培养,阳性率为32.5%(54/166)。根据临床经验或药敏试验结果均给予广谱抗生素(头孢类、氨曲南或喹诺酮类等)或联合替硝唑/甲硝唑治疗,其中393例行超声引导下经皮穿刺抽脓及置管引流,24例单纯行超声引导下经皮穿刺抽脓,11例行外科开腹脓肿引流,9例行外科手术切除。排除阿米巴肝脓肿、结核性肝脓肿、恶性肿瘤。PLA患者按照是否发生AKI分为非AKI组486例、AKI组68例。AKI组包括AKI 1期37例(54.4%),肾脏替代治疗2例、死亡3例;2期14例(20.6%),肾脏替代治疗1例、死亡2例;AKI 3期17例(25.0%),肾脏替代治疗4例、死亡3例。AKI的诊断和分期参考2012年全球改善肾脏病预后工作组提出的KDIGO标准[6]。
2结果
2.1两组基本资料及实验室检查结果比较基本资料共纳入10个指标。AKI组年龄<40岁1例、40~65岁34例、>65岁33例,男42例、女26例,平均动脉压(87.9±16.8)mmHg,伴发糖尿病37例、肝硬化1例、高血压42例、胆道疾病35例,合并感染性休克15例,行肾脏替代治疗7例,死亡8例。非AKI组年龄<40岁51例、40~65岁316例、>65岁119例,男327例、女159例,平均动脉压(93.1±11.6)mmHg,伴发糖尿病232例、肝硬化14例、高血压132例、胆道疾病173例,合并感染性休克4例,行肾脏替代治疗2例,死亡3例。两组年龄、平均动脉压、伴发高血压及胆道疾病、合并感染性休克、行肾脏替代治疗、死亡相比,P均<0.05;两组其余指标相比,P均>0.05。
实验室检查共纳入17个指标。AKI组血常规:白细胞计数13.9×109/L[(10.1~18.3)×109/L]、中性粒细胞比率89%(83%~93%)、Hb 110(101~125)g/L、PLT 179×109/L[(94~301)×109/L]、ALB(30.3±6.3)g/L,肝功能:ALT (127±211)U/L、AST (202±418)U/L、碱性磷酸酶125(99~201)U/L、γ-谷氨酰转肽酶114(63~236)U/L、总胆红素17.7(9.2~34.2)μmol/L,肾功能:尿素氮(BUN)11.5(8.5~15.8)mmol/L、血肌酐(SCr)132(111~183)μmol/L,血生化:血钠(134.3±6.2)mmol/L、血钾(4.0±0.6)mmol/L,凝血酶原活动度(PTA)77%±21%,国际标准化比值(INR)1.3±0.4,肾小球滤过率(eGFR)43.9(27.1~53.8)mL/(min·1.73 m2)。非AKI组血常规:白细胞计数10.7×109/L [(8.1~13.9)×109/L]、中性粒细胞比率81%(75%~88%)、Hb 121(110~133)g/L、PLT 265×109/L[(181~364)×109/L]、ALB(34.0±5.2)g/L,肝功能:ALT (74±105)U/L、AST (56±86)U/L、碱性磷酸酶134(98~193)U/L、γ-谷氨酰转肽酶145(81~243)U/L、总胆红素12.2(8.7~19.1)μmol/L,肾功能:BUN 4.4(3.5~5.9)mmol/L、SCr 63(51~73)μmol/L,血生化:血钠(136.2±4.5)mmol/L、血钾(3.9±0.5)mmol/L,PTA 90%±15%,INR 1.1±0.1,eGFR 113.0(93.3~139.0)mL/(min·1.73 m2)。两组白细胞计数、中性粒细胞比率、Hb、PLT、ALB、AST、总胆红素、BUN、SCr、血钠、PTA、INR、eGFR相比,P均<0.05;两组其余指标相比,P均>0.05。
2.2PLA伴发AKI的多因素分析多因素Logistic回归分析显示,SCr升高、高血压、感染性休克是AKI发生的独立危险因素(OR分别为1.269、19.411、34.117,P均<0.05)。见表3。
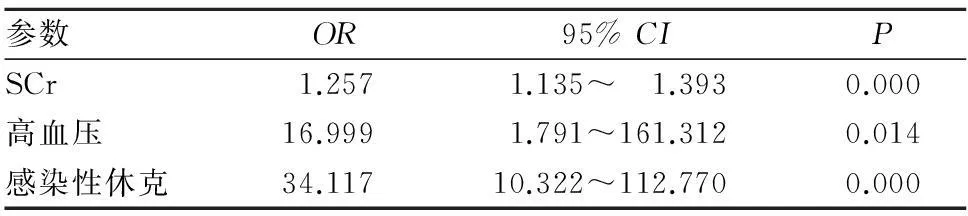
表3 PLA伴发AKI的多因素logistic回归分析
3讨论
PLA是细菌侵入肝脏后引起的,以炎细胞浸润、肝组织液化坏死为特征的化脓性感染性疾病。如救治不及时,可导致败血症、感染性休克,甚至多脏器衰竭[7]。AKI是多种原因导致的常见临床综合征,主要表现为肾功能急剧减退,伴水钠潴留、电解质紊乱,严重者需进行肾脏替代治疗,预后较差。细菌感染是导致AKI发生的重要诱因,同时也是患者预后不良的危险因素。研究表明,肝脓肿伴发AKI患者的病死率显著高于非AKI患者[8]。
Sriramnaveen等[9]报道,PLA伴发AKI的发生率为32.6%,AKI 1、2、3期患者分别占26.7%、40%、33.3%,但该研究的样本量只有46例;Yun等[8]报道,PLA合并AKI的发生率为33.9%,根据RIFLE标准,危险、损伤、衰竭三层患者所占比例分别为35.8%、47.4%、16.5%。上述报道的PLA合并AKI的发生率均较高,且多数为AKI 2期患者。本研究PLA合并AKI的发生率为12.3%,AKI 1期患者所占比例最大,其原因可能与人种、疾病严重程度、医疗环境和治疗措施不同有关。
多数PLA患者表现为白细胞计数(尤其是中性粒细胞比率增加)、低蛋白血症、转氨酶(ALT和AST)水平升高、血沉时间延长,严重者可有贫血、凝血功能障碍(PTA、PLT降低,INR升高)[10~12]。本研究两组上述指标比较均有统计学差异,且AKI组肝功能状态更差、eGFR降低、进行肾脏替代治疗者比例更高,可能与PLA合并AKI患者肝细胞损伤程度、感染程度更严重有关。
本研究结果显示,SCr升高、合并高血压、发生感染性休克是PLA患者发生AKI的独立危险因素,且AKI组平均动脉压低于非AKI组,与其他研究[8,13~15]结论一致。有研究发现,伴发急性肾功能衰竭的败血症患者平均动脉压较低,即使有较高的中心静脉压或肺动脉楔压,也需要积极液体复苏,且使用血管活性药物的比例增加[13]。Bagshaw等[14]研究表明,合并高血压等基础疾病的感染性休克患者更易发生AKI,且长时间低血压和抗感染治疗的延迟可能促进AKI的发生。感染性休克患者发生AKI的机制可能是系统性低血压导致肾血流灌注减少,但该机制不能完全解释未发生休克的败血症患者伴发AKI的原因。Langenberg等[15]发现,液体复苏和维持肾血流灌注并不能阻止GFR的下降,而治疗败血症后GFR可恢复。因此认为,感染性休克患者发生AKI的原因不仅是系统性低血压和肾灌注不足,更主要是肾血管床内环境紊乱。
综上所述,AKI是PLA患者常见且严重的并发症,尤其是高龄或伴有高血压、感染性休克、肝功能状态较差的肝脓肿患者。因肝脓肿伴发AKI的病死率较高,临床医生应给予足够的认识和警惕,监测高危患者的上述指标以预测AKI的发生、发展,及时调整治疗方案,避免不良预后。
参考文献:
[1] 臧芝栋,严洁.以提高肾脏病整体预后工作组诊断标准分析脓毒症相关急性肾损伤患者的临床特点[J].中华内科杂志,2013,52(4):299-304.
[2] Wang X, Jiang L, Wen Y, et al. Risk factors for mortality in patients with septic acute kidney injury in intensive care units in Beijing, China: a multicenter prospective observational study[J]. Biomed Res Int, 2014,2014:172620.
[3] Yegenaga I, Hoste E, Van Biesen W, et al. Clinical characteristics of patients developing ARF due to sepsis/systemic inflammatory response syndrome: results of a prospective study[J]. Am J Kidney Dis, 2004,43(5):817-824.
[4] Bagshaw SM, George C, Bellomo R. Early acute kidney injury and sepsis: a multicentre evaluation[J]. Crit Care, 2008,12(2):R47.
[5] Plataki M, Kashani K, Cabello-Garza J, et al. Predictors of acute kidney injury in septic shock patients: an observational cohort study[J]. Clin J Am Soc Nephrol, 2011,6(7):1744-1751.
[6] Kidney Disease: Improving Global Outcomes (KDIGO). Acute Kidney Injury Work Group. KDIGO Clinical Practice Guideline for Acute Kidney Injury[J]. Kidney Int, 2012(2):1-138.
[7] Chen W, Chen CH, Chiu KL, et al. Clinical outcome and prognostic factors of patients with pyogenic liver abscess requiring intensive care[J]. Crit Care Med, 2008,36(4):1184-1188.
[8] Yun SE, Jeon DH, Kim MJ, et al. The incidence, risk factors, and outcomes of acute kidney injury in patients with pyogenic liver abscesses[J]. Clin Exp Nephrol, 2015,19(3):458-464.
[9] Sriramnaveen P, Sridhar A, Sandeep Y, et al. Acute kidney injury in patients with pyogenic liver abscess[J]. Ren Fail, 2011,33(5):551-552.
[10] 刘小方,郭玉宁,戴玉婷,等.糖尿病并发细菌性肝脓肿25例临床分析[J].山东医药,2009,49(16):39-40.
[11] 李俊,赵鸿.肝脓肿患者肝脏损害特点的回顾性分析[J].中华实验和临床病毒学杂志,2012,26(3):202-204.
[12] Tai WP, Lin XC, Wang HY, et al. The report of four cases of pyogenic liver abscess and literature review in China[J]. Gastroenterol Nurs, 2014,37(2):177-182.
[13] Hoste EA, Lameire NH, Vanholder RC, et al. Acute renal failure in patients with sepsis in a surgical ICU: predictive factors, incidence, comorbidity, and outcome[J]. J Am Soc Nephrol, 2003,14(4):1022-1030.
[14] Bagshaw SM, Lapinsky S, Dial S, et al. Acute kidney injury in septic shock: clinical outcomes and impact of duration of hypotension prior to initiation of antimicrobial therapy[J]. Intensive Care Med, 2009,35(5):871-881.
[15] Langenberg C, Wan L, Egi M, et al. Renal blood flow and function during recovery from experimental septic acute kidney injury[J]. Intensive Care Med, 2007,33(9):1614-1618.
(收稿日期:2015-7-14)
中图分类号:R575.4
文献标志码:B
文章编号:1002-266X(2016)08-0049-03
doi:10.3969/j.issn.1002-266X.2016.08.019
通信作者:韩涛(E-mail: hantaomd@126.com)
基金项目:“艾滋病和病毒性肝炎等重大传染病防治”科技重大专项课题(2012ZX10002004-011)。

