不同提取温度对蛤蒌叶粗多糖抗氧化作用的影响研究
陈丹丹,郭源鑫,陈建平,谌素华,钟赛意,王维民,秦小明(广东海洋大学食品科技学院,广东湛江 524088)
不同提取温度对蛤蒌叶粗多糖抗氧化作用的影响研究
陈丹丹,郭源鑫,陈建平,谌素华,*钟赛意,王维民,秦小明
(广东海洋大学食品科技学院,广东湛江524088)
摘要:采用热水浸提法分别在不同提取温度(40,60,80,100℃)下提取得到4种蛤蒌叶粗多糖,并测定其总多酚和蛋白质的含量。然后测定4种粗多糖对羟基自由基、DPPH自由基和超氧阴离子自由基的清除能力,以及粗多糖的还原能力来评价提取温度对其抗氧化活性的影响。结果显示,蛤蒌叶粗多糖中总多酚和蛋白质的含量随着提取温度的升高而下降。提取温度在40~100℃内,随着提取温度的升高,蛤蒌叶粗多糖对羟基自由基、DPPH自由基和超氧阴离子自由基的清除能力均呈下降趋势,而提取温度对其还原能力的影响没有明显差别。结果表明,提取温度对于蛤篓叶粗多糖的抗氧化活性有显著影响,主要是通过影响粗多糖中的总多酚和蛋白质含量来影响其抗氧化活性。
关键词:蛤蒌叶;多糖;抗氧化活性;提取温度
蛤蒌(Piper sarmentosum Roxb)又名蒟酱、青蒟、芦子、槟榔蒟,属胡椒科胡椒属植物,具有祛风散寒、行气化痰、消肿止痒等功能,用于治疗感冒咳嗽、哮喘、风湿痛、胃寒痛、妊娠水肿等疾患。蛤蒌广泛分布在我国东南沿海地区和东南亚国家,是广为使用的调味品和民间药用植物。细胞内自由基产生的损伤可以导致癌症、心血管疾病和免疫系统衰退等多种退变性疾病[1],摄入外源性的抗氧化剂能有效地预防或抑制这些疾病的发生。因此,天然抗氧化剂受到越来越多的关注[2]。近年来,天然植物活性多糖的抗氧化研究成为热点,如夏枯草多糖[3]、刺五加多糖[4]、黄瓜多糖[5]等。然而,目前国内外对蛤蒌叶多糖的研究未见相关报道。本文以蛤蒌叶为原料,采用热水浸提法提取蛤蒌叶粗多糖,通过清除羟基自由基、DPPH自由基、超氧阴离子自由基和还原能力的测定来探讨不同提取温度对蛤蒌叶粗多糖抗氧化作用的影响,为功能性蛤蒌叶多糖的提取和开发这一丰富的植物资源奠定基础。
1 材料与方法
1.1材料与试剂
新鲜蛤蒌叶,采自湛江湖光岩;无水乙醇、三氯乙酸、硫酸亚铁、过氧化氢、六氰合铁酸钾、三氯化铁,以及VC,DPPH,邻苯三酚,K2HPO4,KH2PO4,均为分析纯,购于国药集团上海化学试剂有限公司。
1.2仪器与设备
BLF-500型打浆机,永康市江南欧川电机厂产品;GZX-92 MBE型数显鼓风干燥箱,上海博讯实业有限公司医疗设备厂产品;TDL-40B型离心机,上海安亭科学仪器厂产品;AY120型岛津托盘电子天平,岛津公司产品;LGJ-10C型冷冻干燥机,北京四环科学仪器厂有限公司产品;YLE-2000型数显式电热恒温水浴锅,上海跃进医疗器械厂产品;UV-3200PC型紫外可见分光光度计,上海美谱达仪器有限公司产品;美国丹佛UB-7/10型精密pH仪,南京承正科学仪器有限公司产品。
1.3原料的预处理
将新鲜的蛤蒌叶采摘后,用蒸馏水洗净,放入干燥箱干燥至易碎,简单破碎后放入打浆机中打碎成粉末状,将粉末过60目筛,对粉末样品进行恒温干燥,至恒质量,装入密封袋在干燥器中常温保存。
1.4蛤蒌叶粗提液的提取和组分测定
将试验设为4组,每组称取50g蛤蒌叶粉末于烧杯中,在料液比为1∶15的前提下,采用热水浸提法分别在温度为40,60,80,100℃下提取2 h。经抽滤后,将粗提液于转速4 000 r/min条件下离心10min得到上清液,此上清液即为蛤蒌叶的粗提液。然后,采用苯酚-硫酸比色法[6]、3,5-二硝基水杨酸法[7]分别测定粗提液中的总糖含量、还原性糖含量。
1.5蛤蒌叶粗多糖的分离提取和组分测定
通过1.4中方法得到不同提取温度下的粗提液,然后分别缓慢加入3倍体积的95%乙醇溶液(边加边搅拌),静置24 h,以转速4 000 r/min离心10min,得到粗多糖沉淀;少量蒸馏水溶解沉淀,过滤后得到水溶性多糖和水不溶性多糖,冷冻干燥,得到蛤蒌叶的粗多糖。然后,通过Folin-Ciocalteu比色[8]、Folin-酚试剂法测定粗多糖中总多酚和蛋白质的含量。
1.6蛤蒌叶粗多糖的抗氧化活性测定
1.6.1蛤蒌叶粗多糖对羟基自由基的清除能力测定
参考许海顺等人[9]的方法进行测定,取4支10 mL试管,分别加入9.0 mmol/L FeSO4溶液1.0 mL、10.0 mmol/L水杨酸-乙醇溶液1.0 mL,然后分别加入1.0 mL质量浓度为0.1,0.4,0.7,1.0 mg/mL的蛤蒌叶粗多糖溶液,加蒸馏水定容至5.0 mL,再加入6.0 mmol/L H2O2各1.0 mL,置于37℃水浴中反应10min,于波长510 nm处测定吸光度。空白对照组用相同体积的蒸馏水代替粗多糖样品。以VC作为阳性对照,质量浓度分别为0.1,0.4,0.7,1.0 mg/mL。将试验重复3次,按照下列公式计算羟基自由基清除率。
羟基自由基清除率
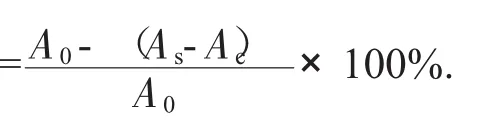
式中:A0——空白对照液吸光度,只加入水杨酸-乙醇、FeSO4和H2O2,不加入蛤蒌叶粗多糖溶液的吸光度;
As——加入水杨酸-乙醇、蛤蒌叶粗多糖溶液、
FeSO4和H2O2的吸光度;
Ac——加入水杨酸-乙醇、蛤蒌叶粗多糖溶
液、FeSO4,不加H2O2的吸光度。
1.6.2蛤蒌叶粗多糖对DPPH自由基的清除能力测定
参考许海顺等人[9]的方法进行测定,取0.1,0.4,0.7,1.0 mg/mL的粗多糖溶液各2.0 mL,置于10 mL试管中,加入0.08%的DPPH溶液3.0 mL,于室温避光反应30min后,以蒸馏水作为空白,于波长517 nm处测定其吸光度。以VC作为阳性对照,质量浓度分别为0.02,0.08,0.14,0.2,0.4,0.7,1.0 mg/mL。按照下列公式计算DPPH自由基清除率,将试验重复3次,取其平均值。
式中:A0——2.0 mL蒸馏水+ 3.0 mL DPPH溶液的吸光度;
As——2.0 mL样品溶液+ 3.0 mL DPPH溶液的吸光度;
Ac——2.0 mL样品溶液+ 3.0 mL蒸馏水的吸光度。
1.6.3蛤篓叶粗多糖对超氧阴离子自由基的清除能力
邻苯三酚自氧化曲线的测定,参考王宗君[10]的方法进行。取pH值为8.2,50 mmol/L的Tris-HCl缓冲液4.5 mL,加入4.2 mL去离子水,混匀后置于25℃的水浴中保温20min,取出后立刻加入已在25℃水浴中预热过的3 mmol/L邻苯三酚溶液0.3 mL(用10 mmol/L的HCl溶液代替邻苯三酚作为空白),混匀后马上将反应液倒入比色皿中,于波长325 nm处测定吸光度,每30 s记录数值,总共5min。得到随着时间变化的曲线即邻苯三酚自氧化曲线,做直线回归方程后得到的斜率,即为邻苯三酚自氧化的速率。
邻苯三酚自氧化曲线见图1。
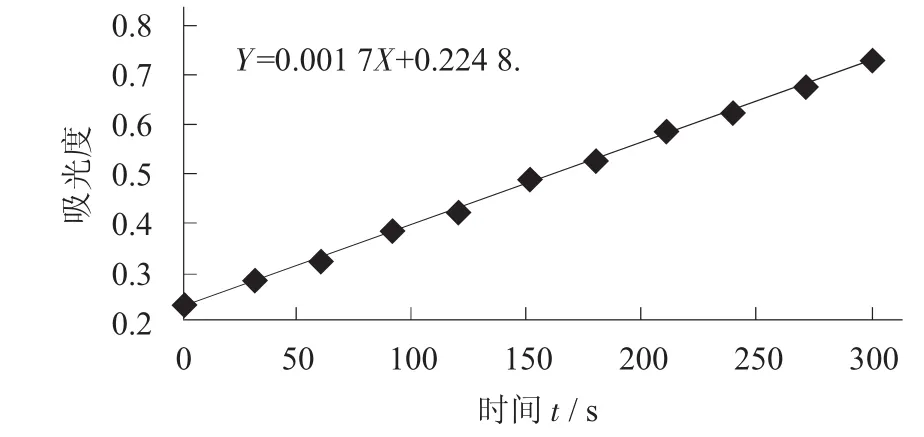
图1 邻苯三酚自氧化曲线
样品清除超氧阴离子速率V1的测定:将邻苯三酚自氧化曲线的制作方法里添加的4.2 mL去离子水替换成3.2 mL去离子水和1 mL样品溶液,其他步骤同上。VC做为阳性对照,质量浓度为0.1,0.2,0.3,1.4,0.5,0.6 mg/mL。以时间为横坐标、吸光度为纵坐标,做直线回归得到的斜率即为样品清除超氧阴离子的速率。每个质量浓度重复3次,取平均值。超氧阴离子清除率计算公式为:
式中:V0——邻苯三酚自氧化的速率;
V1——样品清除超氧阴离子的速率。
1.6.4蛤蒌叶粗多糖的还原能力测定[9,11]
量取2.5 mL不同质量浓度的粗多糖样品,质量浓度分别为0.1,0.4,0.7,1.0 mg/mL(空白对照用1 mL蒸馏水代替,其他试剂依次同下),各加入0.2 mol/L pH值为6.6的磷酸盐缓冲液2.5 mL和1%的K3Fe(CN)6溶液2.5 mL,混匀,置于50℃水浴中反应20min,然后迅速冷却,再加入2.5 mL的10%三氯乙酸溶液,量取反应的溶液5 mL,加入蒸馏水5 mL和0.1%的FeCl3溶液1 mL,混合均匀,反应10min后于波长700 nm处测定其吸光度。VC做为阳性对照,质量浓度分别为0.02,0.08,0.14,0.2 mg/mL。将试验重复3次,测吸光度,求平均值。
2 结果与讨论
2.1蛤蒌叶粗提液和粗多糖中组分的测定
不同提取温度对蛤蒌叶粗提液中的总糖、还原性糖及粗多糖中总多酚和蛋白质的影响。
不同提取温度下提取得到的蛤蒌叶粗提液和粗多糖的组成成分分析(±S)见表1。
表1 不同提取温度下提取得到的蛤蒌叶粗提液和粗多糖的组成成分分析(±S)
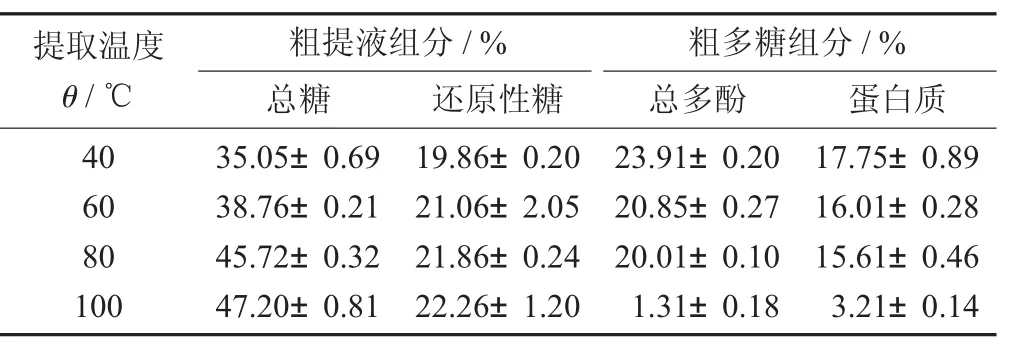
表1 不同提取温度下提取得到的蛤蒌叶粗提液和粗多糖的组成成分分析(±S)
提取温度θ/℃粗提液组分/% 粗多糖组分/%总糖 还原性糖 总多酚 蛋白质40 60 80 100 35.05±0.69 38.76±0.21 45.72±0.32 47.20±0.81 19.86±0.20 21.06±2.05 21.86±0.24 22.26±1.20 23.91±0.20 20.85±0.27 20.01±0.10 1.31±0.18 17.75±0.89 16.01±0.28 15.61±0.46 3.21±0.14
由表1可知,在试验提取温度内,随着提取温度的升高,粗提液中总糖和还原性糖的含量呈上升趋势,说明在一定温度范围内,提取温度越高,提取的总糖和还原性糖就越多。然而,提取温度越高,得到的粗多糖中总多酚和蛋白质的含量却逐渐降低,这可能是由于提取温度升高,粗多糖中的一些酚类物质发生了氧化,从而导致总多酚含量的下降;而蛋白质在高温下容易失活,从而导致蛋白质含量下降。
2.2蛤蒌叶粗多糖对羟基自由基的清除能力
不同提取温度对不同质量浓度的蛤蒌叶粗多糖清除羟基自由基的影响见图2,不同提取温度对不同质量浓度的蛤蒌叶粗多糖清除羟基自由基的影响(±S)见表2。
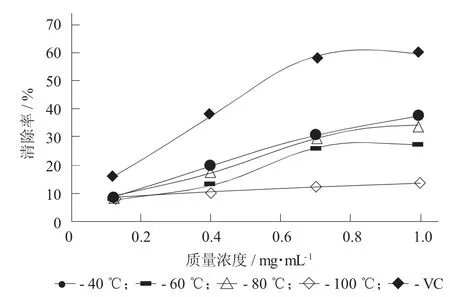
图2 不同提取温度对不同质量浓度的蛤蒌叶粗多糖清除羟基自由基的影响
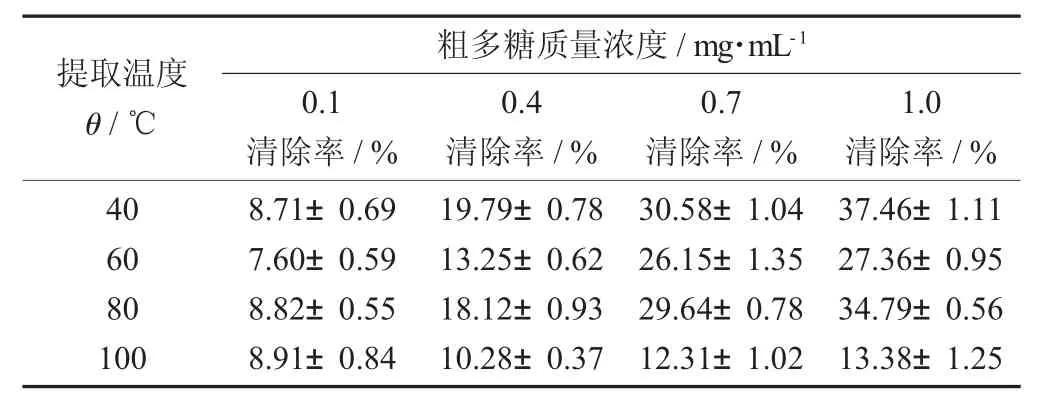
提取温度θ/℃粗多糖质量浓度/mg·mL-10.1清除率/%0.4清除率/%0.7清除率/%1.0清除率/%40 60 80 100 8.71±0.69 7.60±0.59 8.82±0.55 8.91±0.84 19.79±0.78 13.25±0.62 18.12±0.93 10.28±0.37 30.58±1.04 26.15±1.35 29.64±0.78 12.31±1.02 37.46±1.11 27.36±0.95 34.79±0.56 13.38±1.25
由图2和表2可知,当蛤蒌叶粗多糖质量浓度为0.1~1.0 mg/mL,4种提取温度下提取得到的蛤蒌叶粗多糖对羟基自由基的清除率,均随着其质量浓度的增加而逐渐加强,呈现量效关系。而且,不同提取温度下提取的蛤蒌叶粗多糖对羟基自由基的清除能力有显著不同,升高提取温度会降低蛤蒌叶多糖对羟基自由基的清除能力,这可能是由于提取温度升高,粗多糖中总多酚和蛋白质的含量下降导致的。相比其他提取温度,当蛤蒌叶在40℃提取的粗多糖质量浓度为1.0 mg/mL时,表现出对羟基自由基最强的清除效果,其清除率达37.46%,表明蛤蒌叶粗多糖具有一定的清除羟基自由基能力,但是相比阳性对照VC,蛤蒌叶粗多糖对羟基自由基的清除能力要低于阳性对照VC对羟基自由基的清除率(60.10%)。
2.3蛤蒌叶粗多糖对DPPH自由基的清除能力
不同提取温度对不同质量浓度的蛤蒌叶粗多糖清除DPPH自由基的影响见图3,不同提取温度对不同质量浓度的蛤蒌叶粗多糖清除DPPH自由基的影响(±S)见表3。
由图3和表3可知,在试验质量浓度范围内,4种不同提取温度下提取得到的蛤蒌叶粗多糖对DPPH自由基的清除率均随着粗多糖质量浓度的提高而增大。而且,随着提取温度的升高,提取得到的蛤蒌叶粗多糖对DPPH自由基的清除能力呈逐渐下降趋势,这可能是由于提取温度升高,粗多糖中总多酚和蛋白质的含量下降导致其对DPPH自由基的清除能力下降。当粗多糖质量浓度在1.0 mg/mL时,所有样品对DPPH自由基的清除率都能达到40%以上。然而,其清除率仍要远低于阳性对照VC。
2.4蛤蒌叶粗多糖对超氧阴离子自由基的清除能力
不同提取温度对不同质量浓度的蛤蒌叶粗多糖清除超氧阴离子自由基的影响见图4,不同提取温度对不同质量浓度的蛤蒌叶粗多糖清除超氧阴离子自由基的影响(±S)见表4。
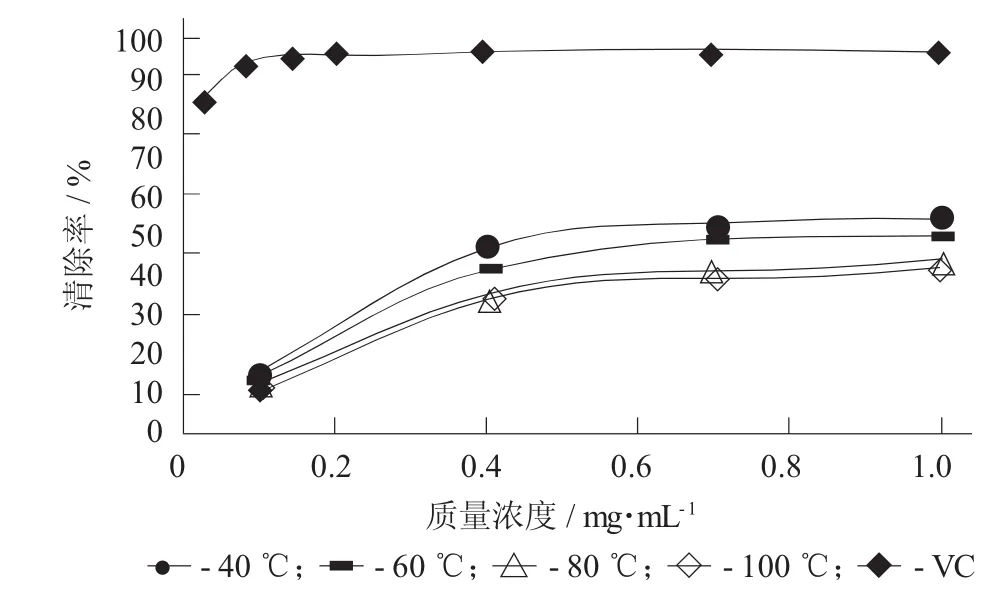
图3 不同提取温度对不同质量浓度的蛤蒌叶粗多糖清除DPPH自由基的影响
表3 不同提取温度对不同质量浓度的蛤蒌叶粗多糖清除DPPH自由基的影响(±S)
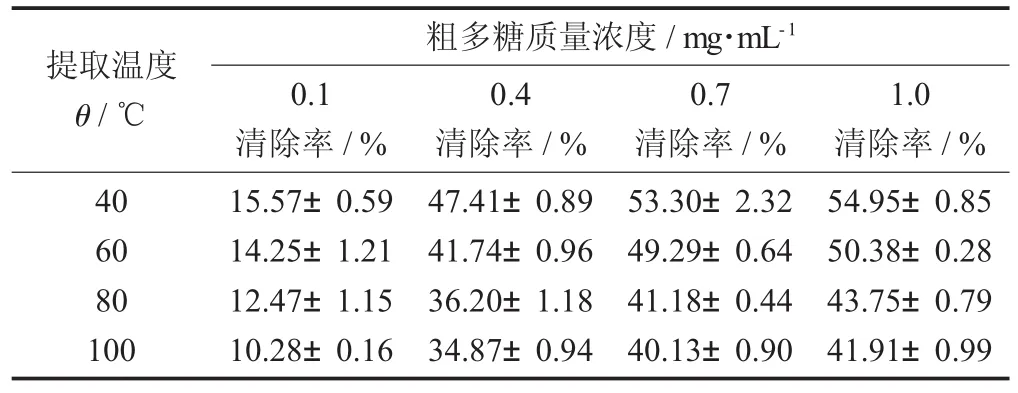
表3 不同提取温度对不同质量浓度的蛤蒌叶粗多糖清除DPPH自由基的影响(±S)
提取温度θ/℃粗多糖质量浓度/mg·mL-10.1清除率/%0.4清除率/%0.7清除率/%1.0清除率/%40 60 80 100 15.57±0.59 14.25±1.21 12.47±1.15 10.28±0.16 47.41±0.89 41.74±0.96 36.20±1.18 34.87±0.94 53.30±2.32 49.29±0.64 41.18±0.44 40.13±0.90 54.95±0.85 50.38±0.28 43.75±0.79 41.91±0.99
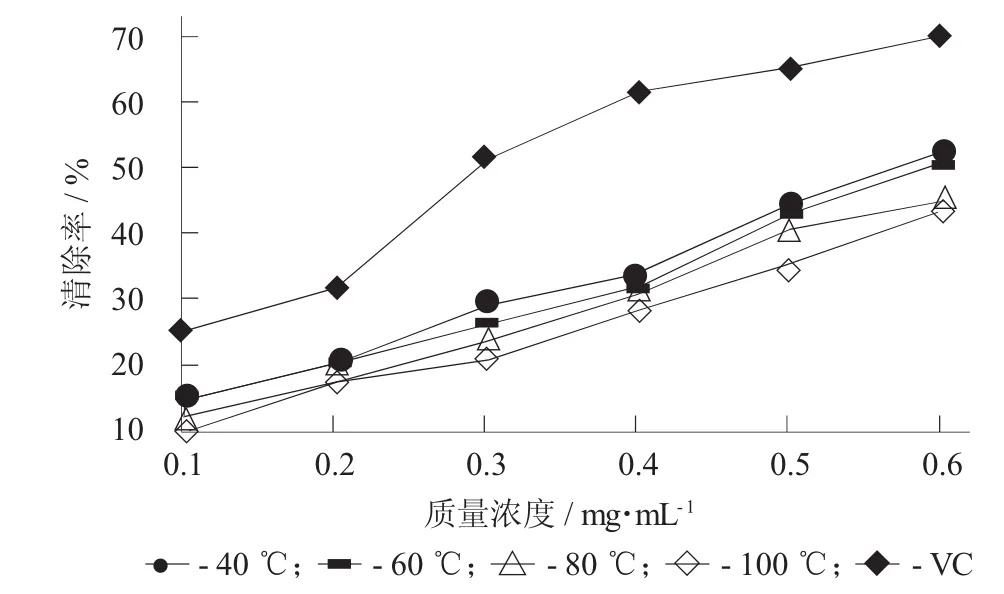
图4 不同提取温度对不同质量浓度的蛤蒌叶粗多糖清除超氧阴离子自由基的影响
由图4和表4可知,在试验质量浓度范围内,4种不同提取温度下提取得到的蛤蒌叶粗多糖对超氧阴离子自由基的清除率均随着粗多糖质量浓度的增加而增大。而且,相对其他提取温度提取的粗多糖,40℃提取的粗多糖对超氧阴离子自由基的清除率较高,100℃提取的粗多糖其清除率最低,表明随着提取温度的升高,提取得到的蛤蒌叶粗多糖对超氧阴离子自由基的清除能力呈逐渐下降趋势,这可能是由于提取温度升高,粗多糖中总多酚和蛋白质的含量下降导致其对超氧阴离子自由基的清除能力下降。而且,蛤蒌叶粗多糖对超氧阴离子自由基的清除率也要低于阳性对照VC。
2.5蛤蒌叶粗多糖的还原能力
不同提取温度对不同质量浓度的蛤蒌叶粗多糖还原能力的影响见图5,不同提取温度对不同质量浓度的蛤蒌叶粗多糖还原能力的影响(±S)见表5。
表4 不同提取温度对不同质量浓度的蛤蒌叶粗多糖清除超氧阴离子自由基的影响(±S)
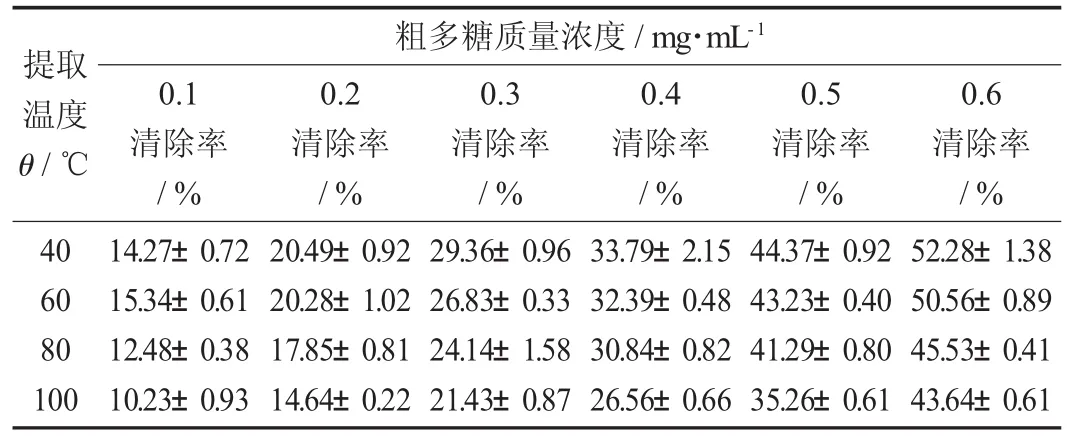
表4 不同提取温度对不同质量浓度的蛤蒌叶粗多糖清除超氧阴离子自由基的影响(±S)
提取温度θ/℃粗多糖质量浓度/mg·mL-10.1清除率/%0.2清除率/%0.3清除率/%0.4清除率/%0.5清除率/%0.6清除率/%40 60 80 100 14.27±0.72 15.34±0.61 12.48±0.38 10.23±0.93 20.49±0.92 20.28±1.02 17.85±0.81 14.64±0.22 29.36±0.96 26.83±0.33 24.14±1.58 21.43±0.87 33.79±2.15 32.39±0.48 30.84±0.82 26.56±0.66 44.37±0.92 43.23±0.40 41.29±0.80 35.26±0.61 52.28±1.38 50.56±0.89 45.53±0.41 43.64±0.61
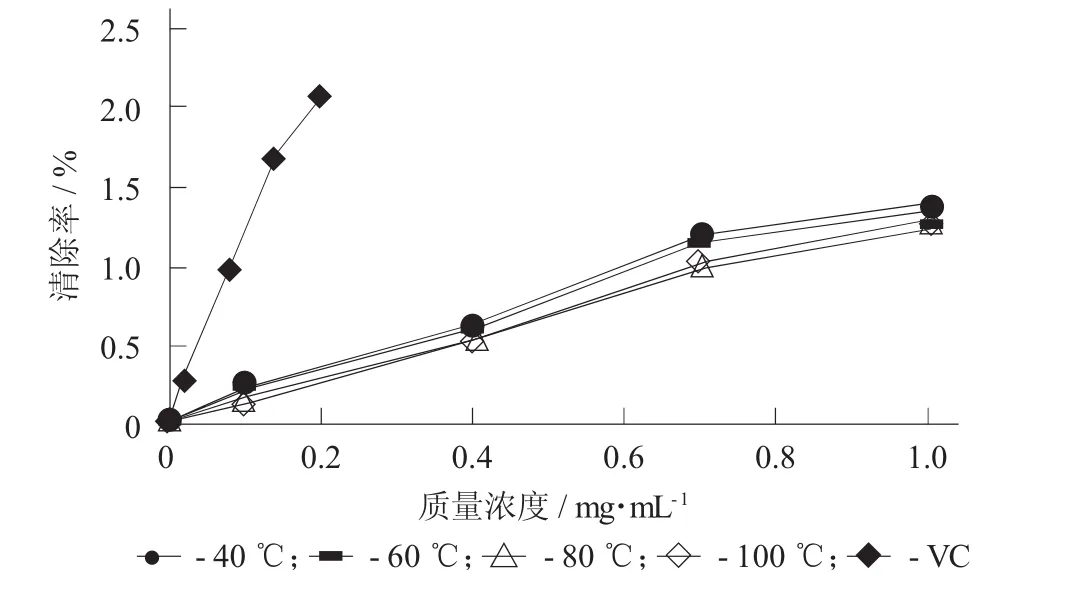
图5 不同提取温度对不同质量浓度的蛤蒌叶粗多糖还原能力的影响
表5 不同提取温度对不同质量浓度的蛤蒌叶粗多糖还原能力的影响(±S)
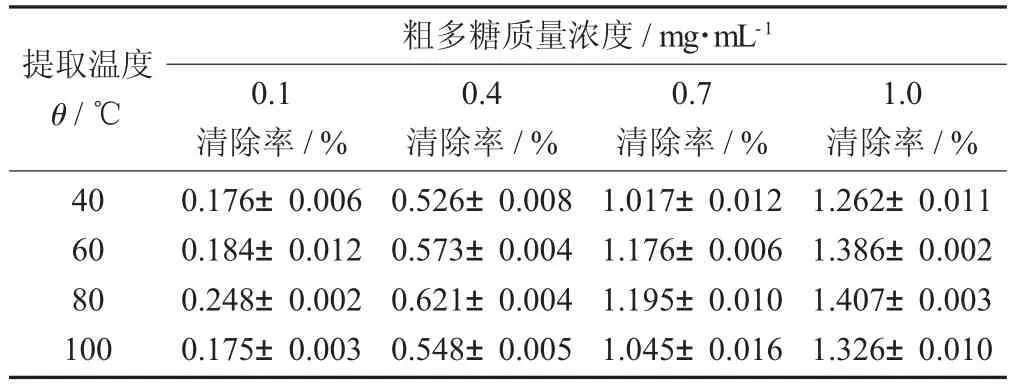
表5 不同提取温度对不同质量浓度的蛤蒌叶粗多糖还原能力的影响(±S)
提取温度θ/℃粗多糖质量浓度/mg·mL-10.1清除率/%0.4清除率/%0.7清除率/%1.0清除率/%40 60 80 100 0.176±0.006 0.184±0.012 0.248±0.002 0.175±0.003 0.526±0.008 0.573±0.004 0.621±0.004 0.548±0.005 1.017±0.012 1.176±0.006 1.195±0.010 1.045±0.016 1.262±0.011 1.386±0.002 1.407±0.003 1.326±0.010
由图5和表5可知,在试验质量浓度范围内,4种不同提取温度下提取得到的蛤蒌叶粗多糖的还原
能力均随着粗多糖质量浓度的增加而增大。但是,不同提取温度下提取得到的粗多糖之间的还原能力差异不显著,这可能是因为提取温度升高,粗多糖中还原性糖的含量相差不大导致的。
3 结论
通过测定不同提取温度下得到的蛤蒌叶粗多糖对羟基自由基、DPPH自由基和超氧阴离子自由基的清除能力及其还原能力,并评价提取温度对蛤蒌叶粗多糖抗氧化活性的影响。结果表明,提取温度能够显著影响蛤蒌叶粗多糖的抗氧化活性,表现为提取温度越高,蛤蒌叶粗多糖对羟基自由基、DPPH自由基和超氧阴离子自由基的清除能力就越低;提取温度对于蛤蒌叶粗多糖的还原能力影响不显著。不同提取温度下得到的蛤蒌叶粗多糖均表现出一定的抗氧化活性,但是均要弱于VC。蛤蒌叶粗多糖的抗氧化活性强弱与其中的总多酚和蛋白质含量呈正相关。
参考文献:
[1]Jiang S H,Wang C L,Chen Z Q,et al.Antioxidant properties of the extract and subfractions from old leaves of Toona sinensisroem(meliaceae)[J].J Food Biochem.,2009,33(3):425-441.
[2]Gioti E M,Fiamegos Y C,Skalkos D C,et al.Antioxidant activity and bioactive components of the aerial parts of Hypericum perforatum L.from Epirus,Greece[J].Food Chem.,2009,117(3):398-404.
[3]张德华.夏枯草多糖的分离纯化与抗氧化活性研究[J].云南植物研究,2006(4):410-414.
[4]孟繁磊,陈瑞战,张敏,等.刺五加多糖的提取工艺及抗氧化活性研究[J].食品科学,2010(10):168-174.
[5]许平.黄瓜多糖抗氧化活性研究[J].重庆工商大学学报(自然科学版),2009(1):54-56.
[6]张青,张天民.苯酚-硫酸比色法测定多糖含量[J].山东食品科技,2004(7):17-18.
[7]陈钧辉,李俊,张冬梅,等.生物化学实验[M].北京:科学出版社,2008:20-65.
[8]贾荣,倪海镜,赵春芳,等.山葡萄籽提取物中总多酚的含量测定[J].吉林大学学报(医学版),2009(5):877-879.
[9]许海顺,蒋剑平,徐攀,等.红参多糖抗氧化活性的研究[J].浙江中医药大学学报,2011(6):909-912.
[10]王宗君.茶树菇多糖提取与抗氧化性研究[D].南宁:广西大学,2007.
[11]Oyaizu M.Studies on products of browning reaction antioxidative activities of products of browning reaction prepared from glucosamine[J].Japanese J Nutr.,1986,44(6):307-315.
Study on Effect of Different Extraction Temperatures on Antioxidant Activity of Crude Polysaccharides from Piper sarmentosum Roxb
CHEN Dandan,GUO Yuanxin,CHEN Jianping,CHEN Suhua,*ZHONG Saiyi,WANG Weiming,QIN Xiaoming
(Food Technology College,Guangdong Ocean University,Zhanjiang,Guangdong 524088,China)
Abstract:The crude polysaccharides is extracted by the methods of hot water extraction technology under four different temperatures(40,60,80,100℃).Then,total polyphenol and protein content of crude polysaccharides are measured.Moreover,the antioxidant activity of crude polysaccharides extracted with different temperatures is measured by scavenging hydroxyl free radicals assay,scavenging DPPH free radicals assay,scavenging superoxide anion and its reduce power to evaluate the effect of temperature on the antioxidant activity of polysaccharides,and the antioxidant activities.The results show that with the temperature increased,the total polyphenol and protein content of crude polysaccharides are decreased.At the extraction temperature from 40 to 100℃,with the increasing of temperature,the scavenging ability of crude polysaccharides on hydroxyl free radicals,DPPH free radicals and superoxide anions are decreased.However,the effect of temperature on the reduce power of crude polysaccharides is no obvious difference.Our results demonstrate that the temperature has significant effect on the antioxidant activity of crude polysaccharides by affecting its total polyphenol and protein content.
Key words:Piper sarmentosum Roxb;polysaccharides;antioxidant activity;extraction temperature
文章编号:1671-9646(2016)02a-0001-04
*通讯作者:钟赛意(1979—),男,博士,副教授,研究方向为食品功能因子及功效评价。
基金项目:广东省公益研究与能力建设专项资金项目(2015A020209166);广东省大学生科技创新培育专项资金项目(PDJH2015B0254)。
作者简介:陈丹丹(1995—),女,本科,研究方向为植物化学成分的分离提取。
收稿日期:2015-12-09
中图分类号:S182
文献标志码:A
doi:10.16693/j.cnki.1671-9646(X).2016.02.001

