电刺激抗胃食管反流的作用及其相关神经通路的初步探讨*
电刺激抗胃食管反流的作用及其相关神经通路的初步探讨*
杜植鹏#王斌&张伟刘晟宋鑫仇明&
第二军医大学附属长征医院普外三科(200003)
背景:局部电刺激下食管括约肌(LES)作为治疗胃食管反流病的新理念正处于起步阶段。目的:探索局部电刺激的理想参数,并初步探讨抑制LES收缩的局部神经反射通路。方法:构建抗胃食管反流的电刺激活体动物模型。观察胃食管反流量变化,探索电刺激抗胃食管反流的理想参数。在理想参数刺激下,分别加入不同药物干预,观察对胃食管反流量的影响。结果:频率10 Hz和脉冲0.4 ms时,电压10 V或15 V的胃食管反流量明显减少(P<0.001);电压10 V和脉冲0.4 ms时,频率10 Hz的胃食管反流量明显减少(P<0.001);电压10 V和频率10 Hz 时,脉冲0.4 ms的胃食管反流量显著降低(P<0.001)。食管壁局部浸润筒箭毒碱或辣椒素可显著提高胃食管反流量(P<0.05);给予NK1受体阻断剂L-732,138或NO合酶抑制剂L-NAME后,胃食管反流量显著减少(P<0.05)。结论:考虑到电能对组织的损伤,理想电刺激参数为电压10 V、频率10 Hz和脉冲0.4 ms。食管壁内TRPV-1阳性的初级传入速激肽类神经元与肌间氮能神经元组成的局部反射通路可削弱电刺激诱发的LES收缩。
关键词胃食管反流病;电刺激;食管括约肌,下段;反射通路;辣椒素
Effect of Electrical Stimulation on Anti-reflux of Gastroesophageal Junction and Preliminary Exploration of Related Neural Pathway
DUZhipeng,WANGBin,ZHANGWei,LIUSheng,SONGXin,QIUMing.DepartmentofGeneralSurgery,ChangzhengHospital,theSecondMilitaryMedicalUniversity,Shanghai(200003)
Co-correspondence to: WANG Bin, Email: wangbin12048@163.com; QIU Ming, Email: qium127@sina.com
Background: As a new concept of treatment for gastroesophageal reflux disease (GERD), local electrical stimulation on lower esophageal sphincter (LES) is still in a preliminary stage. Aims: To explore the ideal local electrical stimulation parameters for LES contraction and the local neural reflex path that inhibits LES contraction. Methods: Anti-gastroesophageal reflux model with electrical stimulationinvivowas established. The changes of gastroesophageal reflux were observed to explore the ideal electrical stimulation parameters for LES contraction. Effects of different drugs on gastroesophageal reflux in condition with ideal electrical stimulation parameters were observed. Results: When frequency was 10 Hz and pulse was 0.4 ms, gastroesophageal reflux in voltage 10 V or 15 V groups was significantly decreased (P<0.001). When voltage was 10 V and pulse was 0.4 ms, gastroesophageal reflux in frequency 10 Hz group was significantly decreased (P<0.001). When voltage was 10 V and frequency was 10 Hz, gastroesophageal reflux in pulse 0.4 ms group was significantly decreased (P<0.001). Local infiltration of tubocurarine or capsaicin on LES could significantly increase gastroesophageal reflux (P<0.05). The administration of NK1 receptor blocker L-732,138 or NO synthase inhibitor L-NAME could significantly decrease gastroesophageal reflux (P<0.05). Conclusions: In view of the injury of electrical energy on tissue, the ideal electrical stimulation parameters are voltage of 10 V, frequency of 10 Hz and pulse of 0.4 ms. Local neural reflex path consisted of primary TRPV-1-positive tachykininergic neurons and nitrergic neurons in the muscle layer of esophagus could inhibit LES contraction evoked by electrical stimulation
Key wordsGastroesophageal Reflux Disease;Electric Stimulation;Esophageal Sphincter, Lower;
Reflex Path;Capsaicin
下食管括约肌(lower esophageal sphincter, LES)松弛是胃食管反流病(gastroesophageal reflux disease, GERD)的重要发病机制之一[1]。针对这一病因,目前最常用的抗反流术式为腹腔镜下胃底折叠术,抗反流效果较好,但术后可发生严重的并发症如吞咽困难、上腹部饱胀感、打嗝困难等。最近有学者提出新的治疗理念,即对LES行局部电刺激迷走神经末梢释放乙酰胆碱,引起括约肌收缩,提高LES压力(LES pressure, LESP),进而加强胃食管的抗反流屏障功能[2]。该方法符合生理解剖特点,强度可调控,同时具有手术时间短、不会影响术后正常吞咽功能的优势。但这种治疗理念目前仍处于起步阶段,引起LES收缩的理想参数(频率、电流、脉冲、持续时间等)仍鲜有文献报道。有研究发现,在GERD发病机制中,LES松弛可能与抑制性神经递质如一氧化氮(nitric oxide, NO)、血管活性肽、神经肽等有关,这些神经递质与乙酰胆碱共同作用于食管运动终板,拮抗乙酰胆碱的作用[3]。这些分泌抑制性神经递质的神经元分布于食管壁肌层。由此推测,食管壁肌层可能存在抑制LES收缩的局部反射通路,但目前该通路的神经元组成尚不清楚。既往相关研究均在离体条件下完成,本研究通过构建电刺激抗胃食管反流的活体动物模型,旨在探索局部电刺激抗胃食管反流的理想参数,以及在理想参数刺激和不同药物的干预下,初步探讨抑制LES收缩的肌间神经反射通路。
材料与方法
一、实验动物和主要器材
健康5月龄新西兰大白兔30只(第二军医大学实验动物中心),雌雄不拘,体质量2.5~3.0 kg;置于普通级动物饲养室,室温20~24 ℃,光照和黑暗各12 h交替,自由进食标准颗粒饲料和饮水。
电刺激系统采用生物机能实验系统BL-420F(成都泰盟科技有限公司)。
二、研究方法
1. 电刺激模型的建立:大白兔术前48 h禁食,禁水6 h,腹腔注射10%水合氯醛(3 mL/kg)进行麻醉。取剑突下正中切口,充分暴露并游离食管下端和胃食管交界区,经口插入10 Fr双腔导尿管,手指探查确认导尿管末端至胃贲门处,向外拔出4 cm至LES上方1~2 cm处,气囊内注入3 mL 0.9% NaCl溶液固定导尿管。导尿管的另一端在体外接延长管,延长管的出水口置于电子天平上换药碗上方3 cm 处。结扎胃幽门,灌洗清除胃腔内食物残渣。静脉输液管一端置入胃腔内,另一端连接输液袋(500 mL 0.9% NaCl溶液)。电刺激开始前,将0.9% NaCl溶液以恒定的压力(280~300 mm Hg)(1 mm Hg=0.133 kPa)灌胃,并排空输液管和导尿管中的残留气体。将两个电极针(长约0.5 cm,直径0.3 mm)沿食管纵轴方向固定于食管壁LES肌层中,两个电极针呈180°对称。电极针外接金属导线,连于脉冲发生器。按照预先设定的参数进行电刺激,刺激时间为20 s,记录每次电刺激期间从胃腔反流至食管的0.9% NaCl溶液的流量(精确到0.01 g),实验重复3次,取均值。每次电刺激间隔约 3 min。术后处死动物。
2. 理想参数的设置:取15只新西兰大白兔,按照不同的电刺激参数采集三组数据。A组固定频率和脉冲(频率10 Hz,脉冲0.4 ms),改变电压:A0无电刺激(生理条件下);A1电压5 V;A2电压10 V;A3电压15 V。B组固定电压和脉冲(电压10 V,脉冲0.4 ms),改变频率:B0无电刺激(生理条件下);B1频率5 Hz;B2频率10 Hz;B3频率20 Hz。C组固定电压和频率(电压10 V,频率10 Hz),改变脉冲:C0无电刺激(生理条件下);C1脉冲0.4 ms;C2脉冲0.8 ms;C3脉冲1.2 ms。
3.药物干预效果:取剩余15只大白兔,用浸泡药物溶液的纱布条(3 cm×1 cm)覆盖于大白兔腹段食管上,充分接触并浸润食管壁10 min后去除纱条,然后进行电刺激,电刺激方法和设备同前,参数为上文得到的理想电刺激参数。15只大白兔按不同的药物干预分为Ⅰ、Ⅱ、Ⅲ组,每组各5只。Ⅰ组采集2组数据,Ⅰa为空白对照组(电刺激+无药物干预);Ⅰb为筒箭毒碱干预组[电刺激+5 μmol/L筒箭毒碱溶液(上海思域化工科技有限公司)]。Ⅱ组采集3组数据,Ⅱa为空白对照组(电刺激+无药物干预);Ⅱb为辣椒素干预组[电刺激+10 μmol/L辣椒素(美国Sigma公司)];Ⅱc为NK1受体阻断剂L-732,138干预组[电刺激+10 μmol/L辣椒素+1 μmol/L L-732,138(美国Sigma公司)]。Ⅲ组采集3组数据,Ⅲa为空白对照组(电刺激+无药物干预);Ⅲb组为辣椒素干预组(电刺激+10 μmol/L辣椒素);Ⅲc组为NO合酶抑制剂L-NAME干预组[电刺激+10 μmol/L辣椒素+ 100 μmol/L L-NAME(上海北诺生物科技有限公司)]。
三、统计学分析
结果
一、理想电刺激参数
A0、B0、C0三组胃食管反流量差异无统计学意义(P=0.975)。给予电刺激后,除A1组与A0组无明显差异外,A2、A3、B1、B2、B3、C1、C2、C3组的胃食管反流量均显著低于各自对照组(P<0.05)(表1)。
1. 电压:给予电刺激后,A1组与A0组胃食管反流量无明显变化(t=0.245,P=0.810),A2组和A3组胃食管反流量显著降低(P<0.05),而A2组和A3组之间差异无统计学意义(t=1.755,P=0.101)。说明固定频率10 Hz和脉冲0.4 ms的条件下,电压10 V和15 V均能使胃食管反流量减少,考虑电压越大,对活体损伤越大,可认为10 V为较适宜的刺激电压。
2. 频率:B1、B2、B3三组胃食管反流量相比差异有统计学意义(F=6.860,P=0.001),进一步分析发现,B2组又显著低于B1和B3组(t=-24.40,P<0.001;t=-27.05,P<0.001)。说明在固定电压10 V和脉冲0.4 ms的条件下,10 Hz为较适宜的刺激频率;
3. 脉冲:C1、C2、C3三组胃食管反流量相比差异有统计学意义(F=2.055,P<0.038),进一步分析发现,C1组又显著低于C2和C3组(t=-15.13,P<0.001;t=-25.03,P<0.001)。说明在固定电压10 V和频率10 Hz的条件下,0.4 ms为较适宜的刺激脉冲。
二、药物干预效果
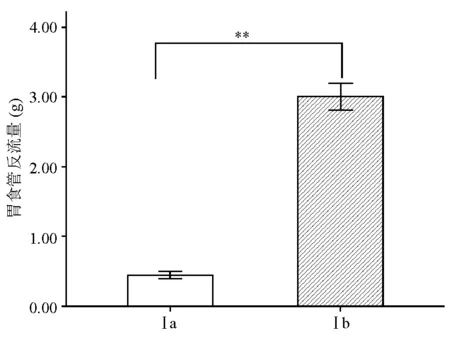
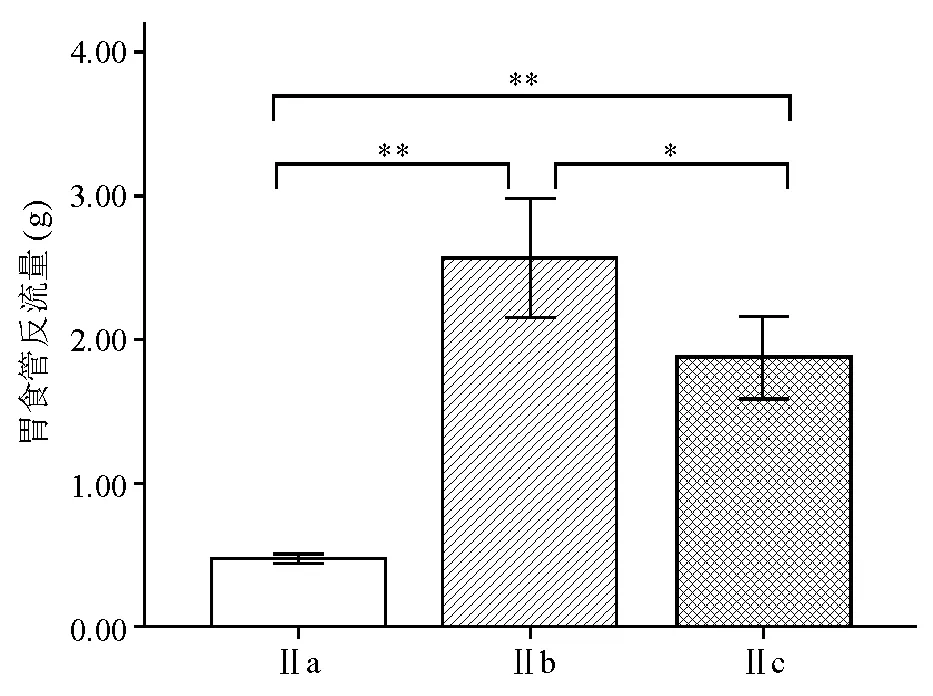
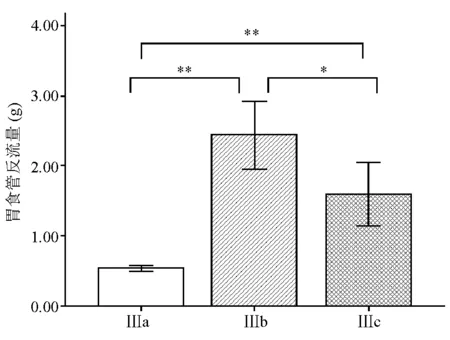
在理想电刺激参数(电压10 V、频率10 Hz和脉冲0.4 ms)的刺激下,Ⅰa组胃食管反流量显著低于Ⅰb组(t=-37.658,P<0.001)(图1),说明筒箭毒碱可显著抑制电刺激诱导的LES收缩。Ⅱa、Ⅱb、Ⅱc组之间胃食管反流量相比差异有统计学意义(F=103.893,P<0.001),进一步分析发现,Ⅱa组显著低于Ⅱc组(t=-14.573,P<0.001),Ⅱc组显著低于Ⅱb组(t=3.097,P=0.036)(图2),说明辣椒素可显著抑制电刺激诱导的LES收缩,而NK1受体抑制剂可明显削弱辣椒素对LES收缩的抑制作用。Ⅲa、Ⅲb、Ⅲc组之间胃食管反流量相比差异有统计学意义(F=46.913,P<0.001),进一步分析发现,Ⅲa组显著低于Ⅲc组(t=-6.690,P=0.003),Ⅲc组显著低于Ⅲb组(t=4.233,P=0.013)(图3),说明NO合酶抑制剂同样可显著降低辣椒素对LES收缩的抑制作用。
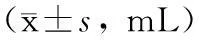
表1 各组胃食管反流量
**P<0.01
*P<0.05,**P<0.01
*P<0.05,**P<0.01
目前食管括约肌的局部电刺激疗法在国内外还处于探索阶段,一些问题仍尚待解决,如引起LES收缩的理想参数(频率、电流、脉冲、持续时间等)、电极片植入食管的解剖层面、距离LES的距离以及两个电极片之间的距离等。刺激能量过小达不到提高LESP的效果,能量过大会产生致命性心律失常的风险。国外研究[4-6]采用的电刺激参数差异较大,刺激电流为3~15 mA,电波脉冲为200 μs~375 ms,刺激频率更是从6次/min至20 Hz不等。食管环肌收缩可提高LESP,纵肌则反之。两者对电流频率的反应不同,引起环肌收缩的频率为5~20 Hz,高于20 Hz则环肌的收缩效应会降低,而引起纵肌收缩的频率为10~40 Hz[7],因此5~10 Hz的频率可能同时引起环肌收缩和纵肌松弛,对于提高LESP也许是理想的频率。本研究证实电压10 V、频率10 Hz、脉冲0.4 ms是理想的电刺激参数。
GERD是一种典型的食管活动异常,主要病因为胃酸高分泌、LES异常松弛以及食管体部廓清能力降低[8]。食管动力受迷走运动神经元与肌间神经元双重支配,特别是兴奋性胆碱能神经元和抑制性氮能神经元。一些食管疾病的病理机制可能与神经调控失调有关,尤其是兴奋性神经元和抑制性神经元的失衡[9]。食管肌层收缩主要受中枢神经系统的迷走神经支配,而食管蠕动主要由外源性神经元而非内源性神经元调控[10-11]。本研究结果显示,局部湿敷乙酰胆碱受体抑制剂筒箭毒碱可显著抑制LES收缩,导致胃食管反流量增多,证实削弱迷走神经释放乙酰胆碱,可有效抑制LES收缩,降低LESP。有研究显示,给予游离大鼠食管电刺激迷走神经,可诱发食管肌肉的收缩反应;而在离体条件下,在浸有食管的溶液中加入辣椒素和胡椒碱,可削弱迷走神经释放乙酰胆碱,从而阻断迷走神经介导的食管收缩[12]。
本研究还发现,局部湿敷辣椒素同样可有效抑制LES收缩。辣椒素为速激肽类传入神经元和肌间氮能神经元的激动剂,可激活食管壁肌间抑制性神经元,说明速激肽类传入神经元和肌间氮能神经元可拮抗乙酰胆碱的功能。辣椒素并非直接作用于乙酰胆碱和迷走神经,由此推测,哺乳动物食管肌层内可能存在局部神经反射通路,该通路虽不能直接阻断迷走运动神经元释放乙酰胆碱,但可拮抗乙酰胆碱对LES运动终板的兴奋作用。该反射弧包括对辣椒素敏感的初级传入神经元。而有研究发现,食管肌层中的初级神经元为速激肽类传入神经元,该神经元表达瞬时感受器电位香草酸受体1(transient receptor potential vanilloid-1, TRPV-1)[13]。辣椒素为TRPV-1高选择性激动剂[13],通过激活TRPV-1促进速激肽类神经元释放速激肽,介导LES舒张[9]。本研究加入速激肽NK1受体阻滞剂L-732,138后,胃食管反流量明显减小,证实速激肽类神经元参与该局部反射通路;而加入NO合酶抑制剂L-NAME可大大降低辣椒素对LES收缩的抑制效应,说明NO参与调节LES的松弛,进而证实肌间氮能神经元为肌间局部反射通路的组成部分。该肌间局部反射通路包括TRPV-1阳性的初级传入速激肽类神经元和肌间氮能神经元,可拮抗乙酰胆碱能神经元对LES的收缩效应。
本研究首次构建活体胃食管反流测量模型,通过实验中的观察和体会,总结以下经验:①本实验大白兔的LES较适宜的电刺激参数为经验数据,并未考虑电压、频率和脉冲同时改变的相互影响,将在进一步实验中完善这一数据;②因考虑Forley导尿管气囊过分充盈会对食管功能产生影响,前期出现气囊灌注不足,造成1只大白兔误吸;1只过量灌注(8 mL)导致食管破裂,后改为以最小灌注量(约3 mL)使导尿管固定为宜;③实验过程中,尝试电刺激迷走神经使LES收缩,2 min后1只大白兔心跳呼吸骤停死亡,考虑电刺激迷走神经存在较大风险,不建议在活体行迷走神经电刺激法;④结扎幽门处不宜过低,实验中1只大白兔结扎位置位于幽门远端2 cm处,后在测反流过程中,由于十二指肠壁压力过大,造成十二指肠壁破裂,需再次调整结扎位置,建议于幽门处结扎为宜;⑤虽然禁食48 h可排空大部分胃内容物,但仍会存留少部分残渣,若残渣颗粒较大,会封堵Forley导尿管开口,影响反流液体的流动。因此,测量数据前,务必将胃腔残渣彻底清理。
总之,本研究成功地构建了抗胃食管反流的电刺激活体动物模型,并探索了电刺激的理想参数,初步探讨了抑制LES收缩的局部神经通路;为进一步探索GERD的发病机制和局部电刺激治疗的疗效提供了坚实的基础。
参考文献
1 Wong WM, Lai KC, Hui WM, et al. Pathophysiology of gastroesophageal reflux diseases in Chinese -- role of transient lower esophageal sphincter relaxation and esophageal motor dysfunction[J]. Am J Gastroenterol, 2004, 99 (11): 2088-2093.
2 Rodríguez L, Rodriguez P, Gómez B, et al. Two-year results of intermittent electrical stimulation of the lower esophageal sphincter treatment of gastroesophageal reflux disease[J]. Surgery, 2015, 157 (3): 556-567.
3 Wu M, Majewski M, Wojtkiewicz J, et al. Anatomical and neurochemical features of the extrinsic and intrinsic innervation of the striated muscle in the porcine esophagus: evidence for regional and species differences[J]. Cell Tissue Res, 2003, 311 (3): 289-297.
4 Rodríguez L, Rodríguez P, Neto MG, et al. Short-term electrical stimulation of the lower esophageal sphincter increases sphincter pressure in patients with gastroesophageal reflux disease[J]. Neurogastroenterol Motil, 2012, 24 (5): 446-450, e213.
5 Banerjee R, Pratap N, Kalpala R, et al. Effect of electrical stimulation of the lower esophageal sphincter using endoscopically implanted temporary stimulation leads in patients with reflux disease[J]. Surg Endosc, 2014, 28 (3): 1003-1009.
6 Rodríguez L, Rodriguez P, Gómez B, et al. Electrical stimulation therapy of the lower esophageal sphincter is successful in treating GERD: final results of open-label prospective trial[J]. Surg Endosc, 2013, 27 (4): 1083-1092.
7 Lund GF, Christensen J. Electrical stimulation of esophageal smooth muscle and effects of antagonists[J]. Am J Physiol, 1969, 217 (5): 1369-1374.
8 Grossi L, Cappello G, Marzio L. Effect of an acute intraluminal administration of capsaicin on oesophageal motor pattern in GORD patients with ineffective oesophageal motility[J]. Neurogastroenterol Motil, 2006, 18 (8): 632-636.
9 Boudaka A, Wörl J, Shiina T, et al. Key role of mucosal primary afferents in mediating the inhibitory influence of capsaicin on vagally mediated contractions in the mouse esophagus[J]. J Vet Med Sci, 2007, 69 (4): 365-372.
10Clouse RE, Diamant NE. Motor function of the esophagus. In: Johnson LR Ed. Physiology of the gastrointestinal tract[M]. 4th ed. Burlington: Elsevier Academic Press, 2006: 913-926.
11Goyal RK, Chaudhury A. Physiology of normal esophageal motility[J]. J ClinGastroenterol, 2008, 42 (5): 610-619.
12Shiina T, Shimizu Y, Boudaka A, et al. Tachykinins are involved in local reflex modulation of vagally mediated striated muscle contractions in the rat esophagus via tachykinin NK1 receptors[J]. Neuroscience, 2006, 139 (2): 495-503.
13Yang F, Xiao X, Cheng W, et al. Structural mechanism underlying capsaicin binding and activation of the TRPV1 ion channel[J]. Nat Chem Biol, 2015, 11 (7): 518-524.
(2015-10-12收稿;2015-10-22修回)
*基金项目:上海市卫生和计划生育委员会科研课题青年项目(20144Y0199);长征医院青年启动基金(2013czqn08)
DOI:10.3969/j.issn.1008-7125.2016.02.004
#Email: dolivy@163.com
&本文共同通信作者,王斌,Email: wangbin12048@163.com;仇明,Email: qium127@sina.com

