茂原链霉菌产谷氨酰胺转氨酶发酵培养基优化
汪 燕, 罗水忠, 蔡 静, 钟昔阳, 姜绍通, 郑 志
(1.合肥工业大学 生物与食品工程学院,安徽 合肥 230009; 2.安徽省农产品精深加工重点实验室,安徽 合肥 230009)
茂原链霉菌产谷氨酰胺转氨酶发酵培养基优化
汪燕1,2,罗水忠1,2,蔡静1,2,钟昔阳1,2,姜绍通1,2,郑志1,2
(1.合肥工业大学 生物与食品工程学院,安徽 合肥230009; 2.安徽省农产品精深加工重点实验室,安徽 合肥230009)
摘要:文章考察了不同培养基成分对茂原链霉菌产谷氨酰胺转氨酶的影响,以酶活和生物量为测定指标,采用单因素试验和正交试验确定发酵培养基最适成分及其质量浓度,以期为未来菌株扩大培养和发酵中试化提供参考。试验结果表明,优化后的培养基为:葡萄糖40 g/L,蛋白胨40 g/L,硝酸铵1 g/L,酵母膏2 g/L,硫酸镁2 g/L,磷酸氢二钾2 g/L。该条件下酶活可达(1.30±0.07) U/mL,生物量为(9.69±0.23) g/L。
关键词:茂原链霉菌;谷氨酰胺转氨酶;发酵培养基;正交试验
0引言
谷氨酰胺转氨酶(Transglutaminase,EC.2.3.2.13,TG酶),又称转谷氨酰胺酶,可以催化蛋白质赖氨酸上的ε-氨基和谷氨酸上的γ-酰胺基结合,从而导致蛋白质(或多肽分子)之间发生共价交联,形成相应的聚合产物[1]。
TG酶有着“21世纪超级黏合剂”的美称,在食品加工领域应用广泛。它可以改善肉制品的质构,提高原料的利用率[2-3];增加乳制品的凝胶强度,减少脂肪含量[4-5];生产可食性薄膜,利于食品的包装和贮藏[6-7]等。这些优越的特性使得TG酶成为近年来研究的热点,同时获得高产量高酶活的TG酶也成为研究的关键。目前,研究主要集中于诱变育种筛选高效产酶菌株[8-9]、菌株发酵条件优化[10-11]、发酵酶液分离纯化[12-13]和通过基因工程技术对现有的微生物进行基因改造[14-15]等。
微生物发酵法是工业上生产TG酶的主要方法,微生物代谢产酶的能力,除受菌株自身特性影响外,还受发酵条件如培养基、培养温度[16]、摇床转速等诸多客观因素的影响[17]。文献[18-19]报道对链霉菌HS-1进行培养基优化,酶活分别提高了16.04%和16.40%,因此,优化菌株产酶发酵条件对产物质量浓度、产量和产率具有重要的意义。本文通过单因素试验和正交试验对茂原链霉菌产TG酶的发酵培养基组成进行优化,为TG酶的工业化应用提供参考。
1材料与方法
1.1材料与试剂
1.1.1菌种
茂原链霉菌(Streptomycesmobaraensis)为合肥工业大学农产品加工研究院选育。
1.1.2培养基
斜面保存培养基:可溶性淀粉 20 g/L,KNO31 g/L,MgSO4·7H2O、K2HPO4·H2O、NaCl均为0.5 g/L,FeSO4·H2O 0.01 g/L,琼脂20 g/L,pH值为7.2~7.4。
液体种子培养基:可溶性淀粉和蛋白胨各为20 g/L,酵母膏、MgSO4、K2HPO4均为2 g/L,pH值为7.0。
基础发酵培养基:可溶性淀粉和蛋白胨各为30 g/L,酵母膏、NH4(SO4)2、MgSO4、K2HPO4均为2 g/L,pH值为7.0。
1.1.3主要试剂
N-α-CBZ-Gln-Gly和L-谷氨酸-γ-单羟肟酸,美国Sigma公司;还原型谷胱甘肽,北京索莱宝科技有限公司;其他均为国产分析纯试剂。
1.2方法
1.2.1培养方法
液体种子的培养方法为:用接种环挑取少许生长良好的菌种置于新鲜斜面培养基上,28 ℃恒温培养7 d。经活化后的菌种再接入种子培养基中,30 ℃,170 r/min,培养48 h。
摇瓶发酵的培养方法为:初始pH值为7.0,250 mL三角瓶装液量25 mL,接种量10% (体积分数),30 ℃、170 r/min培养72 h。
1.2.2培养基优化试验设计
分别考察发酵培养基中不同碳源及其质量浓度(可溶性淀粉、蔗糖、麦芽糖、葡萄糖、甘油)、不同有机氮源及其质量浓度(胰蛋白胨、鱼粉蛋白冻、酪蛋白、蛋白胨、玉米浆)、不同无机氮源及其质量浓度(硫酸铵、硝酸铵、硝酸钠)对茂原链霉菌发酵产TG酶的影响。根据单因素试验确定的培养基成分及其质量浓度范围,设计三因素三水平正交试验。试验因素水平见表1所列。

表1 正交试验因素水平 g/L
1.2.3测定方法
(1) TG酶活的测定。按Grossowicz比色法[20]测定酶活:反应液A由0.2 mol/L Tris-HCl(pH=6.0)、0.1 mol/L盐酸羟胺、0.01 mol/L还原型谷胱甘肽和0.03 mol/L N-α-CBZ-Gln-Gly组成,终止液B由3 mol/L盐酸、12% 三氯乙酸、5% 六水三氯化铁(溶解于0.1 mol/L盐酸中)3种试剂等体积混合而成。样品测定时,取200 μL酶液加入1 mL试剂A于37 ℃反应10 min后,加入1 mL试剂B终止反应,4 ℃、7 000 r/min离心10 min后在525 nm处比色。对照组为200 μL样品先加试剂终止液B后于37 ℃反应10 min,再加试剂A,其他操作相同。1单位TG酶活性定义为:37 ℃条件下反应,每1 min生成1 μmol 的单羟肟酸所需的酶量,单位为U/mL。
(2) 菌体生物量(DCW)的测定。事先称好过滤用的定量滤纸,将发酵液过滤后,用蒸馏水洗涤菌体3次,105 ℃干燥至恒质量。在干燥器中降至室温后称质量,菌体生物量为2次滤纸质量差,单位为g/L。
1.3数据处理
每组试验重复3次,结果取平均值,试验数据以“平均值±标准差”表示。
2结果与分析
2.1碳源种类对发酵的影响
不同碳源种类对发酵的影响如图1所示。
碳源在微生物生长和代谢过程中有着举足轻重的作用,是提供细胞生命活动所需能量和合成产物的碳架[21]。由图1可知,不同碳源条件下培养茂原链霉菌产TG酶,其酶活和菌体生长差别较大。葡萄糖作为碳源时,酶活和生物量均为最大,分别为(0.86±0.01)U/mL和(8.11±0.11) g/L。因此,选择适宜的碳源为葡萄糖。

图1 不同碳源种类对发酵的影响
2.2碳源添加量对发酵的影响
不同葡萄糖质量浓度对发酵的影响如图2所示。
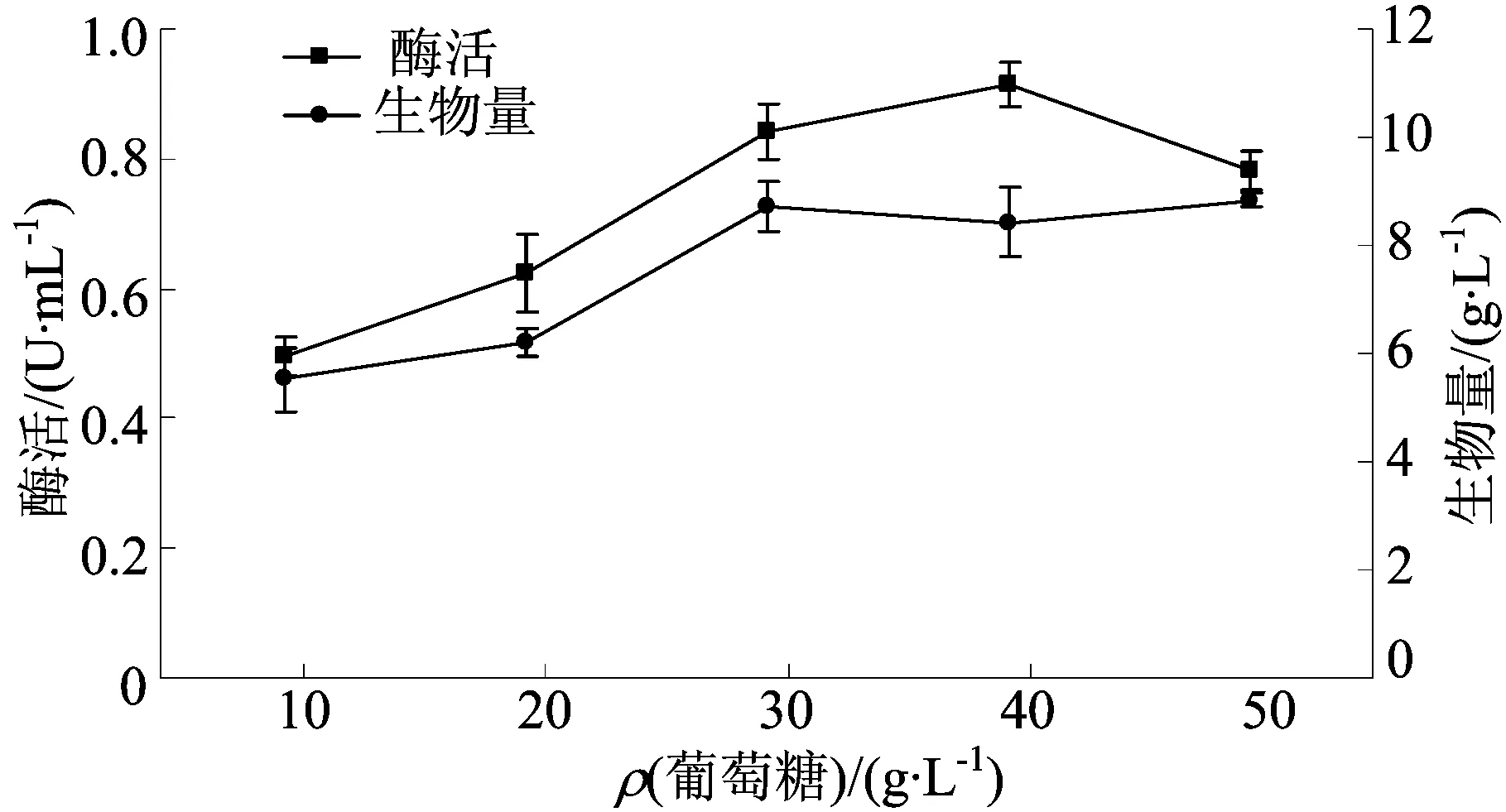
图2 不同葡萄糖质量浓度对发酵的影响
由图2可知,TG酶活和生物量随着葡萄糖质量浓度的增加呈现先增后减的趋势。当质量浓度为40 g/L时酶活达到最大,为(0.91±0.03)U/mL,此时生物量为(8.72±0.46)g/L。当质量浓度为50 g/L时,酶活急剧下降而生物量也几乎没有增加,说明过多的碳源并不利于菌株产酶和生长,也可能是TG酶的合成受碳源分解代谢物阻遏效应的影响[22]。因此,选择葡萄糖质量浓度为40 g/L。
2.3有机氮源种类对发酵的影响
不同有机氮源种类对发酵的影响如图3所示。
氮源是微生物生长和发酵的重要营养来源,微生物利用它在细胞内合成氨基酸和碱基,进而合成蛋白质、核酸等细胞成分以及含氮的代谢产物[23]。同时,氮源也是合成TG酶的主要底物。由图3可知,产酶最适有机氮源为蛋白胨,该条件下,酶活可达(0.96±0.04)U/mL,此时生物量为(10.25±0.20)g/L;其次是玉米浆,为(0.86±0.04)U/mL和(8.93±0.28)g/L。而酪蛋白几乎不能起到促进产酶的作用,酶活仅为(0.15±0.05)U/mL,生物量为(8.45±0.23)g/L。因此,选择蛋白胨为有机氮源。

图3 不同有机氮源种类对发酵的影响
2.4有机氮源添加量对发酵的影响
有机氮源添加量对发酵的影响如图4所示。
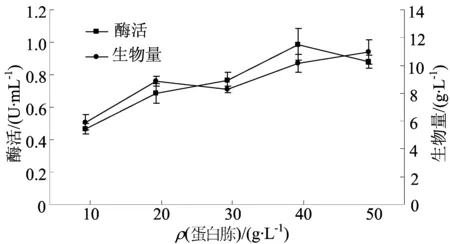
图4 不同蛋白胨质量浓度对发酵的影响
由图4可知,蛋白胨质量浓度从 10 g/L增加到40 g/L时,酶活约增大了1倍。当质量浓度为40 g/L时酶活达到最大值,为(0.99±0.10)U/mL,生物量为(10.12±0.65)g/L。质量浓度再增加到 50 g/L时,生长量与酶活均有明显的下降。这可能是因为一方面氮源偏多,会使微生物细胞早期生长过于旺盛,导致菌体提前衰老自溶[24];另一方面是培养基中过量存在的蛋白胨类或游离氨基酸、小肽等在该酶的作用下共价交联形成了聚合体,从而对菌体的物质吸收利用和代谢生长产生有害作用,影响了酶的生产[18]。因此,选择蛋白胨质量浓度为40 g/L。
2.5无机氮源种类对发酵的影响
无机氮源种类对发酵的影响如图5所示。
无机氮源是速效氮源,可以被细胞吸收后直接利用,有利于菌株前期的生长,而较高的酶活是建立在菌株生长良好的基础之上。由图5可知,添加硝酸铵的培养基,酶活有显著增加,效果优于硝酸钠和硫酸铵,说明硝酸铵能被菌株很好地利用。在该条件下,酶活可达(1.02±0.03)U/mL,此时生物量为(9.66±0.09)g/L。因此,选择硝酸铵为适宜的无机氮源。

图5 不同无机氮源种类对发酵的影响
2.6无机氮源添加量对发酵的影响
硝酸铵质量浓度对发酵的影响如图6所示。由图6可知,随着硝酸铵质量浓度的增大,酶活反而呈下降的趋势。当质量浓度为1 g/L时,酶活最大,可达(1.06±0.06)U/mL,此时生物量为(10.44±0.06)g/L。当质量浓度为5 g/L时,酶活仅为最大值的62%,生物量也有所下降。因此,选择硝酸铵质量浓度为1 g/L。

图6 不同硝酸铵质量浓度对发酵的影响
2.7培养基成分正交试验
根据以上不同碳源和氮源单因素试验结果和分析,选取葡萄糖、蛋白胨和硝酸铵进行三因素三水平的正交试验,并以酶活作为考察指标,获得有利于茂原链霉菌产TG酶的发酵培养基。选取的因素水平和试验结果见表2所列。方差分析结果见表3所列。
由表2和表3可知,各因素影响酶活的主次顺序为B>A>C,即蛋白胨>葡萄糖>硝酸铵。根据极差分析得最佳组合条件为:A2B2C1。其中B因素高度显著,A和C因素显著。
直接分析较好的条件是第5组,即A2B2C3,由于计算分析结果与直观分析结果不一致,因此将2种组合同时进行验证,每组重复3次。验证方案与结果见表4所列。
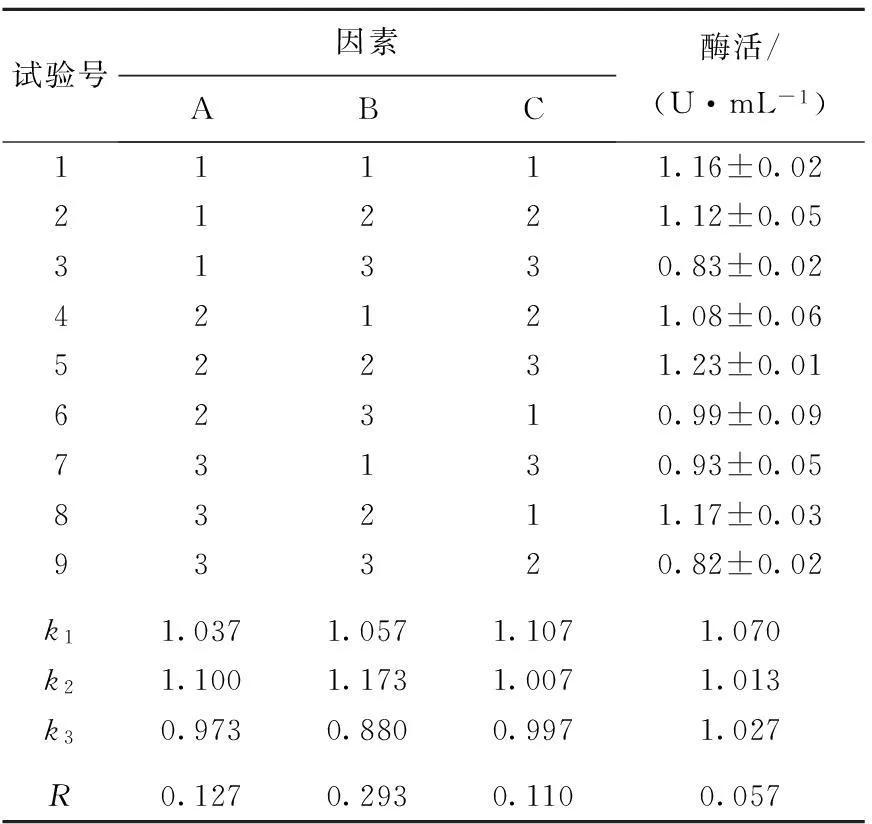
表2 正交试验设计与结果

表3 正交试验方差分析表
注:F0.05(2,20)=3.49,F0.01(2,20)=5.85。

表4 正交验证试验方案与结果
根据试验结果,组合A2B2C1优于A2B2C3,因此选择培养基的优化组合为A2B2C1,即蛋白胨40 g/L,葡萄糖40 g/L,硝酸铵1 g/L。
3结束语
单因素试验表明,葡萄糖是适宜的碳源,最佳质量浓度为40 g/L,蛋白胨和硝酸铵是适宜的氮源,最佳质量浓度分别为40 g/L和1 g/L。通过正交试验数据可知,对茂原链霉菌产TG酶的影响主次顺序为蛋白胨>葡萄糖>硝酸铵。优化后的发酵培养基组成为:葡萄糖40 g/L,蛋白胨40 g/L,硝酸铵1 g/L,酵母膏 2 g/L,硫酸镁2 g/L,磷酸氢二钾 2 g/L。最终酶活可达(1.30±0.07) U/mL,此时生物量为(9.69±0.23) g/L。
[参考文献]
[1]赵新淮,徐红华,姜毓君.食品蛋白质:结构、性质与功能[M].北京: 科学出版社,2009:473.
[2]李宝臻,李海宾,刘尔卓,等.谷氨酰胺转氨酶及其对肉制品凝胶特性的影响[J].农产品加工:学刊,2014 (1): 60-63.
[3]Yu X,Chen C G,Cai K Z,et al.Combined effect of blood plasma powder,agar,and microbial transglutaminase on physicochemical and textural properties of pork music gels[J].Food Science and Biotechnology,2012,21(4):941-950.
[4]张莉丽,韩雪,张兰威,等.茂原链霉菌谷氨酰胺转氨酶在酸奶中的应用研究[J].食品工业科技,2014,35(12):210-212.
[5]Sanli T,Sezgin E,Deveci O,et al.Effect of using transglutaminase on physical,chemical and sensory properties of set-type yoghurt [J].Food Hydrocolloids,2011,25(6):1477-1481.
[6]吴进菊,于博,豁银强,等.转谷氨酰胺酶改性可食用膜的研究进展[J].食品研究与开发,2013,34(4): 114-117.
[7]滑艳稳,陈志周.谷氨酰胺转氨酶对大豆蛋白/PVA复合薄膜性能的影响[J].包装与食品机械,2014(2):19-23.
[8]杨慧林,包莹玲,潘力.片段化全基因组体外诱变选育转谷氨酰胺酶高产菌株的研究[J].现代食品科技,2009,25(1):34-37.
[9]刘颖,田沛霖,陈佳,等.产谷氨酰胺转胺酶菌株的高通量筛选[J].西北农林科技大学学报:自然科学报,2013,41(6): 167-172.

[11]Guerra-Rodríguez E,Vázquez M.Evaluation of a novel low-cost culture medium containing exclusively milk,potato and glycerol for microbial transglutaminase production bySreptomycesmobataensis[J].Chemical Engineering Research and Design,2014,92:784-791.
[12]郝伟,王璋,蔡慧农.微生物谷氨酰胺转胺酶沉淀分离方法的研究[J].食品科学,2006,27(10):331-334.
[13]Macedo J A,Lara D S,Sato H H.Purification and characterization of a new transglutaminase fromStreptomycessp.isolated in Brazilian soil[J].Journal of Food Biochemistry,2011,35(4):1361-1372.
[14]仪朝印,张东杰,王颖.茂原链霉菌转谷氨酰胺酶基因工程菌的构建及表达[J].中国食品学报,2014,14(2):42-46.
[15]Du K,Liu Z M,Cui W J,et al.pH-dependent activation ofStreptomyceshygropicustransglutaminase mediated by intein[J].Applied and Environmental Microbiology,2014,80(2):723-729.
[16]Yan G L,Du G C,Li Y,et al.Enhancement of microbial transglutaminase production byStreptoverticilliummobaraense:application of a two-stage agitation speed control strategy[J].Process Biochemistry,2005,40(2):963-968.
[17]Zheng M Y,Du G C,Guo W F,et al.A temperature-shift strategy in batch microbial transglutaminase fermentation[J].Process Biochemistry,2001,36(6):525-530.
[18]杨雪霞,常忠义,曹丹玥,等.谷氨酰胺转胺酶发酵培养基的优化[J].东华大学学报:自然科学版,2008,34(1):77-80.
[19]曹丹玥,高红亮,常忠义,等.谷氨酰胺转胺酶发酵培养基的响应面分析优化[J].华东师范大学学报:自然科学版,2007(2): 93-97.
[20]Grossowicz N,Wainfan E,Borek E,et al.The enzymatic formation of hydroxamic acids from glutamine and asparagine[J].Journal of Biological Chemistry,1950,187(1):111—125.
[21]黄亚杰,王子辉,赵彦伟,等.重组大肠杆菌产谷氨酰胺转氨酶培养基及发酵条件优化[J].中国酿造,2012,31(4):21-24.
[22]常中义,江波,王璋.培养基组成对轮枝链霉菌合成谷氨酰胺转胺酶的影响[J].无锡轻工大学学报,2001,20(1):51-54.
[23]何国庆,贾英民,丁立孝.食品微生物学[M].第2版.北京:中国农业大学出版社,2009:78-79.
[24]周德庆.微生物学教程[M].北京: 高等教育出版社,1997:111.
(责任编辑闫杏丽)
Optimization of medium components for the production of transglutaminase byStreptomycesmobaraensis
WANG Yan1,2,LUO Shui-zhong1,2,CAI Jing1,2,ZHONG Xi-yang1,2,JIANG Shao-tong1,2,ZHENG Zhi1,2
(1.School of Biotechnology and Food Engineering, Hefei University of Technology, Hefei 230009, China; 2.Key Laboratory for Agricultural Products Processing of Anhui Province, Hefei 230009, China)
Abstract:The transglutaminase(TG) produced by Streptomyces mobaraensis was investigated with different culture media. TG enzyme activity and DCW were taken as indexes to screen for the optimal components and concentrations of medium by using single factors and orthogonal experiments. The optimized medium was as follows: the mass concentration of glucose was 40 g/L, peptone 40 g/L, ammonium nitrate 1 g/L, yeast extract 2 g/L, MgSO4 2 g/L and K2HPO4 2 g/L. Under this experimental condition, TG activity and the biomass were up to (1.30±0.07)U/mL and (9.69±0.23)g/L, respectively. This study provides a reference for amplification cultivation and fermentation of bacterial strain in the future.
Key words:Streptomyces mobaraensis; transglutaminase(TG); fermentation medium; orthogonal experiment
中图分类号:TS201.3
文献标识码:A
文章编号:1003-5060(2016)02-0270-05
Doi:10.3969/j.issn.1003-5060.2016.02.024
作者简介:汪燕(1990-),女,安徽黄山人,合肥工业大学硕士生;姜绍通(1954-),男,江苏盐城人,合肥工业大学教授,博士生导师;
基金项目:国家高技术研究发展计划(863计划)资助项目(2013AA102201);安徽省科技攻关计划重大资助项目(1301031031)
收稿日期:2015-01-04;修回日期:2015-04-02
郑志(1971-),男,安徽和县人,博士,合肥工业大学教授,硕士生导师.

