真菌多糖激发子对辛格粒毛盘菌抗氧化多酚积累的影响
纪 静, 杨 柳, 李贝贝, 徐 灿, 叶 明
(合肥工业大学 生物与食品工程学院,安徽 合肥 230009)
真菌多糖激发子对辛格粒毛盘菌抗氧化多酚积累的影响
纪静,杨柳,李贝贝,徐灿,叶明
(合肥工业大学 生物与食品工程学院,安徽 合肥230009)
摘要:文章研究了辛格粒毛盘菌胞外多酚的抗氧化活性,并以啤酒酵母多糖作为真菌激发子,研究其对辛格粒毛盘菌胞外多酚积累的影响。研究结果表明,多酚的抗氧化活性随啤酒酵母多糖质量浓度的增大而增强,当质量浓度为2.5 g/L时,多酚的还原能力较强,且对O2-·和DPPH·的清除作用分别达到54.50%、70.48%;在粒毛盘菌发酵液中添加啤酒酵母多糖激发子,可以增强菌丝体中苯丙氨酸解氨酶和一氧化氮合酶的活性,同时提高胞外多酚的产量,其中添加80 mg/L激发子组的胞外多酚产量最大,为83.30 mg/L,比空白对照组提高了28.0%。因此啤酒酵母多糖激发子可提高辛格粒毛盘菌抗氧化多酚的积累。
关键词:粒毛盘菌;胞外多酚;抗氧化活性;真菌多糖激发子
0引言
多酚是一类含有1个或多个酚羟基的小分子次生代谢产物,一般存在于植物和微生物中[1]。微生物多酚具有抑菌、抗氧化、抗肿瘤细胞增殖等多种生物学活性[2-4],可以作为一种重要的天然资源应用于医药领域。
1972年,Keen将激发子(elicitor)定义为能刺激植物细胞产生和积累生物活性成分的物质[5]。随着对激发子研究的深入,激发子定义的范围也在扩大,指任何能诱导产生防卫反应的分子[6]。激发子来源于植物、真菌及细菌等生物,其中真菌激发子主要是真菌的细胞表面结构或分泌物,化学成分包括几丁质、多糖、蛋白质及糖蛋白等,真菌多糖是研究较多的真菌激发子[6-9]。有研究发现,疫霉和曲霉多糖激发子可以提高蛹虫草的生物量和虫草菌素的产量[7]。以链孢霉多糖作为激发子能够提高苯丙氨酸解氨酶的活性和NO的含量,促进桦褐孔菌多酚的积累[9]。
粒毛盘菌(Lachnum)是一类腐生性真菌,在发酵培养条件下能够产生黑色素、多糖等物质[10-11]。近期研究发现,粒毛盘菌的一些菌株可以产生多酚类物质,且发现多酚具有抗氧化性和抑菌活性[1,12]。粒毛盘菌多酚作为一种天然活性物质,具有十分广阔的应用前景,研究粒毛盘菌多酚对充分利用粒毛盘菌资源具有十分重要的意义,但是由于多酚的产量较低,制约了对其的研究开发。本文研究了辛格粒毛盘菌胞外多酚的抗氧化活性,并以啤酒酵母多糖作为激发子,研究其对多酚积累的影响。
1材料与方法
1.1供试菌株
辛格粒毛盘菌YM296(Lachnumsingerianum)和啤酒酵母(S.cereviseae),均保藏于合肥工业大学微生物资源与应用研究室。
1.2试剂
Folin-Ciocalteu试剂,Sigma公司;没食子酸,Sigma公司;一氧化氮合酶试剂盒,南京建成生物工程研究所;1,1-二苯基-2-三硝基苯肼DPPH,上海源聚生物科技有限公司;其余试剂均为分析纯。
1.3培养基
PDA 培养基:马铃薯200.0 g/L,葡萄糖20.0 g/L,琼脂15.0 g/L,pH自然。
液体培养基:蔗糖20.0 g/L,蛋白胨5.0 g/L,氯化镁0.8 g/L,酪氨酸0.01 g/L, pH自然。
1.4粒毛盘菌胞外多酚的提取
将辛格粒毛盘菌种子液接种于500 mL锥形瓶中,在160 r/min、26 °C下发酵8 d。参考文献[1]的方法提取粒毛盘菌胞外多酚。将粒毛盘菌发酵液浓缩后,添加3倍体积的70%乙醇,4 ℃放置24 h,离心后取上清液真空旋转蒸发除去乙醇,再利用等体积乙酸乙酯萃取3次,合并萃取液,旋转蒸发除去有机相,冷冻干燥得粒毛盘菌胞外多酚。
1.5辛格粒毛盘菌胞外多酚抗氧化活性的测定
1.5.1胞外多酚还原力的测定
参考文献[13]的方法略做修改测定胞外多酚的还原力。取1.0 mL不同质量浓度(0、0.5、1.0、1.5、2.0、2.5 g/L)的待测液,加入2.5 mL 200 mmol/L的磷酸钠缓冲液(pH=6.6)和2.5 mL 1%的KCN溶液,混合均匀后,在50 ℃下水浴30 min后加入2.5 mL 10%的三氯乙酸终止反应,在1 000 r/min离心8 min,取上清液2.5 mL,加入2.5 mL的蒸馏水和0.5 mL 0.1%的FeCl3溶液,充分混合后在700 nm处测定吸光值。 [12]的方法测定胞外多酚对O2-·的清除能力。取4.5 mL 50 mmol/L(pH=8.2)的Tirs-HCl缓冲液,在25 ℃预热20 min后,加入1 mL不同质量浓度(0、0.5、1.0、1.5、2.0、2.5 g/L)的待测液和0.3 mL 7 mmol/L的邻苯三酚溶液,充分混合后于25 ℃水浴4 min,加入1 mL 10 mmol/L HCl终止反应,在325 nm处测吸光值Aspan。胞外多酚对O2-·的清除率的计算公式为: [14]的方法测定胞外多酚对DPPH·的清除能力。分别将0.3 mL不同质量浓度(0、0.5、1.0、1.5、2.0、2.5 g/L)的待测液与2.7 mL的DPPH·乙醇溶液充分混合后,置于暗处60 min至吸光值稳定,在517 nm处测定吸光值,空白对照组以相同体积的蒸馏水代替样品,多酚对DPPH·的清除率的计算公式为: [15]的方法提取啤酒酵母胞外多糖。将酵母菌发酵液于4 000 r/min离心15 min,取上清液,浓缩后加入3倍体积的95%乙醇,4 ℃放置24 h,于4 000 r/min下离心10 min后取沉淀,冷冻干燥后得粗多糖,4 ℃下保存备用。
1.5.2胞外多酚对O2-·清除能力的测定
O2-·清除率=[1-(AX-AX0)/A0]×100%。
其中,AX0为以蒸馏水代替邻苯三酚溶液的吸光值;A0为以蒸馏水代替胞外多酚溶液的吸光值。
1.5.3胞外多酚对DPPH·清除能力的测定
DPPH·清除率=[(A0-AX)/A0]×100%。
其中,A0为空白对照组的吸光值;AX为不同质量浓度样品的吸光值。
1.6真菌多糖激发子对胞外多酚积累的影响
1.6.1真菌多糖激发子的制备
1.6.2供试菌株的培养
用打孔器将直径大小相同的菌块接种于盛有190 mL液体培养基的500 mL锥形瓶中,26 ℃、160 r/min培养12 d,培养至第2天时加入真菌多糖激发子,使培养液中真菌激发子的最终质量浓度分别为0、40、80、120 mg/L,每组重复3次,每2 d取样测定相关指标。
1.6.3生物量的测定
将辛格粒毛盘菌发酵液抽滤获得菌丝体,用蒸馏水清洗2~3次后于60 ℃烘箱中烘至恒质量,计算菌丝体干质量的质量浓度,具体公式为:

1.6.4胞外多酚产量的测定
按照上述1.4的方法提取粒毛盘菌胞外多酚。参照文献[16]的方法,采用Folin-Ciocalteu法测定胞外多酚产量,并制作没食子酸标准曲线。取1 mL待测溶液于10 mL试管中,然后依次加入1 mL去离子水和0. 5 mL Folin-Ciocalteu试剂,混匀后避光放置8 min,再加入4 mL 7.5% Na2CO3溶液,蒸馏水定容至10 mL,混匀后室温避光放置2 h,在765 nm处测定吸光度。所有实验均重复3次。
1.6.5活性的测定
参照文献[1]的方法测定粒毛盘菌菌丝体内苯丙氨酸解氨酶(phenylalanine ammonia lyase,PAL)的活性。菌丝体内一氧化氮合酶(nitric oxide synthase, NOS)的活性采用ELISA试剂盒测定。
1.7统计学分析
2结果分析
2.1辛格粒毛盘菌胞外多酚的抗氧化活性
2.1.1胞外多酚的还原力
多酚是一类含有多个酚羟基的化合物,可通过氢原子的转移、电子转移、金属螯合等机制发挥抗氧化作用[17]。抗氧化剂的还原力与其抗氧化活性之间存在一定的关系,还原力越强,抗氧化性越强[18]。多酚的还原力如图1所示。由图1可知,辛格粒毛盘菌胞外多酚具有明显的还原能力,其还原力随着自身质量浓度的增加而增强,但在相同质量浓度下,胞外多酚的还原力低于葡萄多酚。

图1 多酚的还原力
2.1.2胞外多酚对O2-·的清除作用
超氧阴离子自由基是生物体内的一种氧自由基,过多的自由基会对机体的细胞膜、DNA、蛋白质等造成氧化损伤[19]。多酚对O2-·具有明显的清除作用,清除作用随着多酚质量浓度的增加而增强,呈现明显的剂量-效应关系,如图2所示,但相同质量浓度下胞外多酚清除作用略低于葡萄多酚,当质量浓度为2.5 g/L时,辛格粒毛盘菌胞外多酚与葡萄多酚的清除率分别为54.50%和74.91%。

图2 多酚对O2-·的清除作用
2.1.3胞外多酚对DPPH·的清除作用
DPPH·是一种稳定的自由基,清除DPPH·的能力主要与酚环结构上的羟基有关,羟基数越多,清除自由基的能力也就越强[12]。多酚对DPPH·的清除作用如图3所示。
由图3可看出,多酚对DPPH·的清除能力随其质量浓度的增加而增强,呈现出良好的剂量-效应关系。相同质量浓度时,辛格粒毛盘菌胞外多酚对DPPH·的清除作用略低于葡萄多酚。当质量浓度为2.5 g/L时,辛格粒毛盘菌胞外多酚与葡萄多酚对DPPH·的清除率分别为70.48%和83.60%。
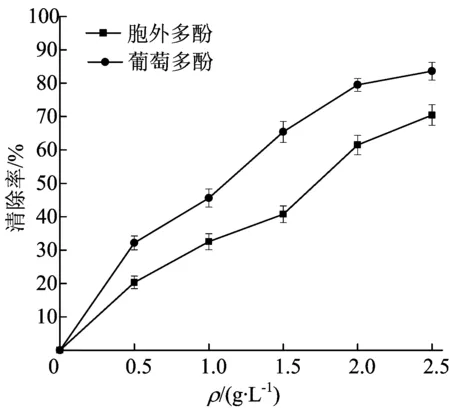
图3 多酚对DPPH·的清除作用
2.2真菌多糖激发子对胞外多酚积累的影响
2.2.1真菌多糖激发子对生物量积累的影响
真菌多糖激发子对生物量的影响如图4所示。由图4可知,辛格粒毛盘菌的生物量随着培养时间的延长而增加。在培养第8天时,每组的生物量均达到最大,其中空白对照组的生物量最低,为5.19 g/L;80 mg/L真菌多糖激发子组的生物量最高,为6.17 g/L,与空白对照组相比存在显著性差异(P<0.05)。结果表明,真菌多糖激发子对辛格粒毛盘菌生物量的积累有一定的促进作用。
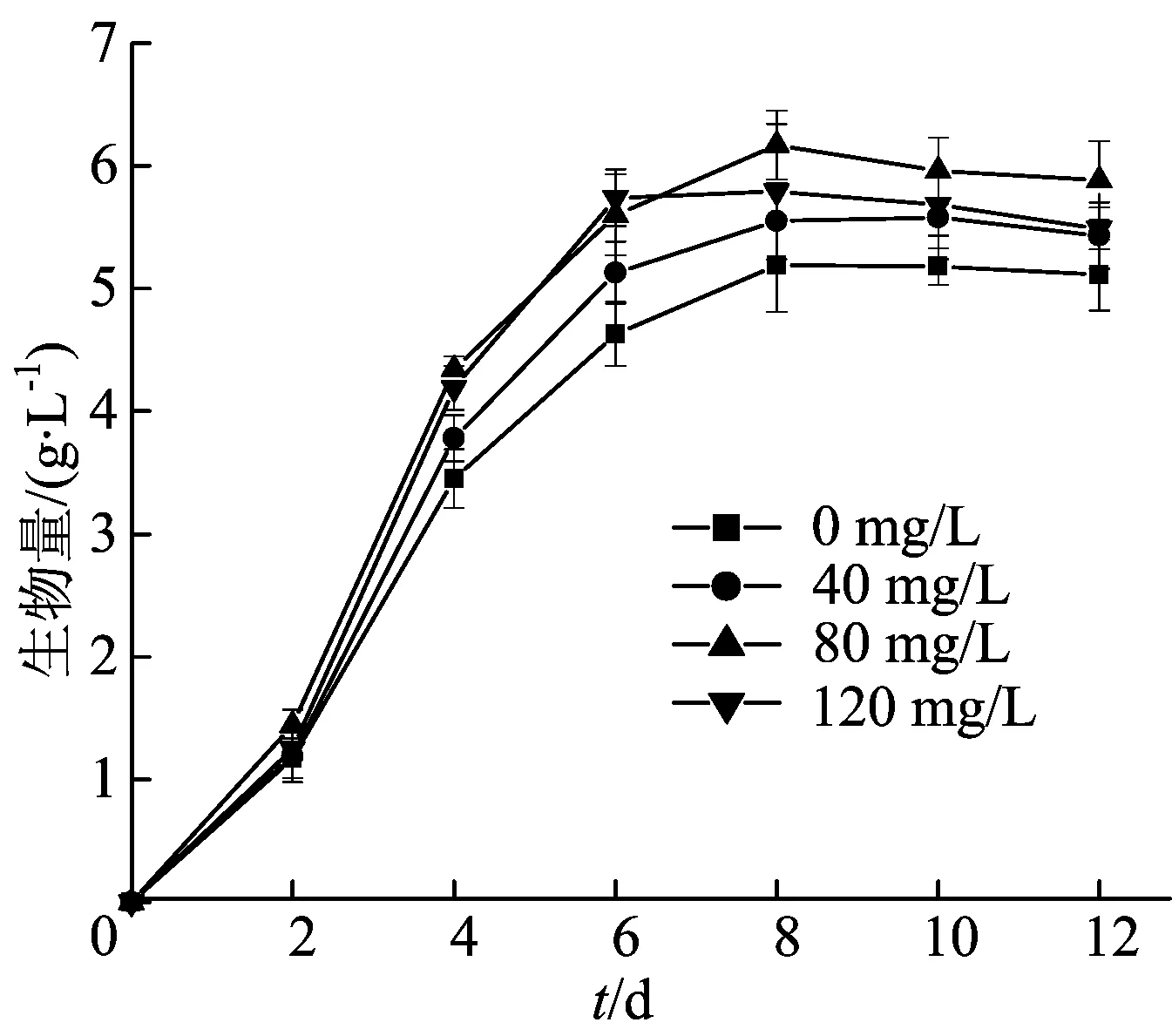
图4 真菌多糖激发子对生物量的影响
2.2.2真菌多糖激发子对胞外多酚产量的影响
真菌多糖激发子对胞外多酚产量的影响如图5所示,由图5可看出,真菌多糖激发子提高了辛格粒毛盘菌胞外多酚的产量。在培养第8天时,各组的胞外多酚产量均达到最大值,但激发子质量浓度与胞外多酚产量不呈现剂量-效应关系,80 mg/L真菌多糖激发子组为83.30 mg/L,明显高于其他3组,且与空白对照组(65.10 mg/L)相比提高了28.0%,存在显著性差异(P<0.05)。辛格粒毛盘菌胞外多酚产量的增加可能是由于啤酒酵母多糖对粒毛盘菌次级代谢产物的积累有一定的诱导作用[8-9],但是随着培养时间的延长,多酚的产量呈下降趋势,这可能是由发酵后期培养液中产生的自由基引起的[8]。

图5 真菌多糖激发子对胞外多酚产量的影响
2.2.3真菌多糖激发子对PAL活性的影响
有报道显示,PAL是多酚类化合物合成过程中的关键酶,它的活性与多酚的合成代谢密切相关[20]。真菌多糖激发子对PAL活性的影响如图6所示。

图6 真菌多糖激发子对PAL活性的影响
由图6可看出,加入真菌多糖激发子的各组中,PAL的活性均明显高于空白对照组。培养至第8天时,各组PAL的活性均达到最大,空白对照组的酶活为57.6 U/mg,40、80、120 mg/L真菌多糖激发子组的酶活分别为65.6、76.4、70.5 U/mg,120 mg/L组的PAL活性低于80 mg/L组。PAL活性与多酚产量的变化趋势一致,这与文献[9]报道的结果相似,原因可能是真菌激发子诱导PAL活性升高,促进了多酚的合成代谢,使多酚的积累量增加。
2.2.4真菌多糖激发子对NOS活性的影响
真菌多糖激发子对NOS活性的影响如图7所示,由图7可看出,加入真菌多糖激发子后,菌丝体中NOS的活性逐渐增大。培养至第8天时,各组的酶活均达到最大,空白对照组的酶活为73.5 U/mg,40、80、120 mg/L真菌多糖激发子组的酶活分别为113.3、150.3、130.5 U/mg,均显著高于空白对照组(P<0.05),培养至第8天后NOS活性缓慢下降,与文献[9]报道的结果具有相同的趋势。
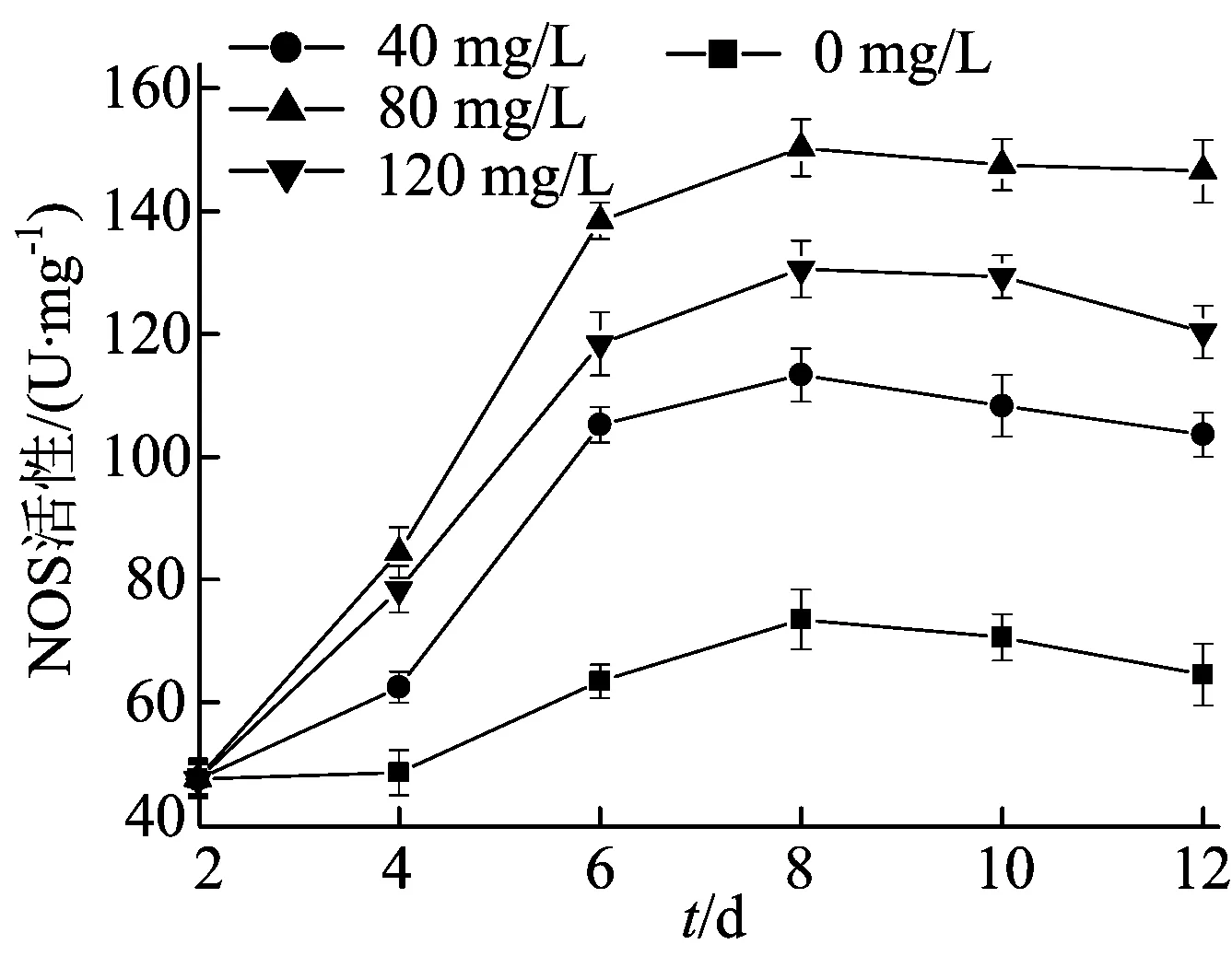
图7 真菌多糖激发子对NOS活性的影响
NOS酶活的增大,可以提高菌丝体内NO含量,NO是真菌次级代谢产物合成的信号分子[8]。有研究表明,适量的NO可激活真菌多酚的生物合成途径,促进多酚的积累,但当NO质量浓度过高时,对多酚合成的诱导作用减弱,甚至产生抑制作用[1,21-22]。辛格粒毛盘菌胞外多酚的增加可能是由于真菌多糖激发子诱导PAL、NOS酶活升高和NO含量增加,从而促进胞外多酚的合成。而120 mg/L真菌多糖激发子组的生物量和多酚产量低于80 mg/L组,原因可能是高质量浓度的激发子使菌丝体内产生了过量的NO,对胞外多酚合成的促进作用减弱。
3结束语
本文研究了辛格粒毛盘菌胞外多酚的抗氧化活性和真菌多糖激发子(啤酒酵母多糖)对辛格粒毛盘菌胞外多酚积累的影响。结果显示,辛格粒毛盘菌胞外多酚具有明显的还原能力,且对O2-·和DPPH·均有较好的清除作用,呈剂量-效应关系,表明辛格粒毛盘菌胞外多酚可以作为一种天然抗氧化剂应用于医药行业。研究还发现,在粒毛盘菌发酵液中加入啤酒酵母多糖激发子后,粒毛盘菌的生物量、多酚产量以及PAL和NOS的活性均有不同程度的升高,这可能是由于适量的真菌多糖激发子可提高多酚合成代谢途径中相关酶的活性,从而促进辛格粒毛盘菌胞外多酚的合成。该结果为进一步研究真菌激发子促进多酚合成的机理提供了依据。
[1]Qian M,Ji J,Ye M,et al.Effect of nitric oxide onLachnumYMU50 extracellular polyphenol accumulation and antioxidant defense system[J].Applied Biochemistry and Biotechnology,2014,174(5):1761-1770.
[2]Ju H K,Chung H W,Hong S S,et al.Effect of steam treatment on soluble phenolic content and antioxidant activity of the Chaga mushroom (Inonotusobliquus)[J].Food Chemistry,2010,119(2):619-625.
[3]Nowacka N,Nowak R,Drozd M,et al.Analysis of phenolic constituents,antiradical and antimicrobial activity of edible mushrooms growing wild in Poland[J].LWT-Food Science and Technology,2014,59(2):689-694.
[4]Hu H,Zhang Z,Lei Z,et al.Comparative study of antioxidant activity and antiproliferative effect of hot water and ethanol extracts from the mushroomInonotusobliquus[J].Journal of Bioscience and Bioengineering,2009,107(1):42-48.
[5]Keen N T,Partridge J E,Zaki A I.Pathogen produced elicitor of a chemical defense mecchanism in soybeans monogenically resistant to phytophthora megasperma var.Sojae[J].Phytopathology,1972,62(7):768.
[6]Ebel J,Cosio E G.Elicitors of plant defense responses[J].International Review of Cytology,1994,148:l-36.
[7]李柷,肖洋,梁宗琦.真菌多糖激发子对提高虫草菌素含量的影响[J].中国食用菌,2006,25(3):34-37.
[8]魏志文,孙勇,王菲.激发子对桦褐孔菌多酚合成的诱导及其生化机制初探[J].生物技术通报,2014(9):136-141.
[9]赵艳霞,缪康杰,魏志文,等.真菌多糖激发子对桦褐孔菌多酚积累影响的研究[J].中草药,2010,41(12):2079-2082.
[10]He Y,Ye M,Du Z,et al.Purification,characterization and promoting effect on wound healing of an exopolysaccharide fromLachnumYM405[J].Carbohydrate Polymers,2014,105(25):169-176.
[11]Lu Y,Ye M,Song S,et al.Isolation,purification,and anti-aging activity of melanin fromLachnumsingerianum[J].Applied Biochemistry and Biotechnology,2014,174(2):762-771.
[12]钱梅双,纪静,陈天乐,等.粒毛盘菌多酚理化特征及其生物活性研究[J].微生物前沿,2013,2(4):102-108.
[13]谢丽源,彭卫红,黄忠乾,等.层孔菌属真菌抗氧化活性物质测定及抗氧化能力分析[J].天然产物研究与开发,2014,26(2):167-173.
[14]姚玉飞,张海林,刘咏,等.黄山石耳多糖的提取及其抗氧化性研究[J].合肥工业大学学报:自然科学版,2014,37(9):1132-1137.
[15]陈吴西,蔡敬民,邱涛,等.LachnumYM328多糖发酵条件优化及抗氧化性[J].合肥工业大学学报:自然科学版,2011,34(2):300-303,312.
[16]Sun L,Guo Y,Fu C,et al.Simultaneous separation and purification of total polyphenols,chlorogenic acid and phlorizin from thinned young apples[J].Food Chemistry,2013,136(2):1022-1029.
[17]Leopoldini M,Russo N,Toscano M.The molecular basis of working mechanism of natural polyphenolic antioxidants[J].Food Chemistry,2011,125(2):288-306.
[18]徐艳,丁静,孙桂红,等.猴头菌丝多肽的制备及抗氧化活性研究[J].中国酿造,2014,33(6):91-95.
[19]李颖畅,马春颖,励建荣.蓝莓叶水溶性和醇溶性提取物的抗氧化作用[J].食品与发酵科技,2014,50(2):31-35.
[20]Khan W,Prithiviraj B,Smith D L.Chitosan and chitin oligomers increase phenylalanine ammonialyase and tyrosine ammonialyase activities in soybean leaves[J].Journal of Plant Physiology,2003,160(8):859-863.
[21]Dong J,Zhang M,Lu L,et al.Nitric oxide fumigation stimulates flavonoid and phenolic accumulation and enhances antioxidant activity of mushroom[J].Food Chemistry,2012,135(3):1220-1225.
[22]Zhao Y X,Miao K J,Zhang M M,et al.Effects of nitric oxide on production of antioxidant phenolic compounds inPhaeoporusobliquus[J].Mycosystema,2009,28(5):750-754.
(责任编辑闫杏丽)
Effect of fungal polysaccharide elicitor on the accumulation ofLachnumsingerianumantioxidant polyphenols
JI Jing,YANG Liu,LI Bei-bei,XU Can,YE Ming
(School of Biotechnology and Food Engineering, Hefei University of Technology, Hefei 230009, China)
Abstract:Antioxidant activity of extracellular polyphenols of Lachnum singerianum and the effect of the accumulation of polyphenols by adding S.cerevisiae polysaccharide as fungal elicitor were evaluated. With the increasing concentration of S.cerevisiae polysaccharide, the antioxidant activity of polyphenols increased. At a concentration of 2.5 g/L, polyphenols had a significant reducing power, and the scavenging effects of O2-·and DPPH· were 54.50% and 70.48% respectively. S. cerevisiae polysaccharide elicitor added in Lachnum improved the activities of nitric oxide synthase and phenylalanine ammonialyase, and also the accumulation of extracellular polyphenols. The accumulation of polyphenols was 83.30 mg/L in the group which had concentration of 80 mg/L of fungal elicitor, and it was the maximum in all groups and 28.0% higher than that of control group. The results showed that extracellular polyphenols of Lachnum singerianum had strong antioxidant activity and fungal elicitor could promote the accumulation of the polyphenols.
Key words:Lachnum; polyphenol; antioxidant activity; fungal polysaccharide elicitor
中图分类号:Q939.99
文献标识码:A
文章编号:1003-5060(2016)02-0265-06
Doi:10.3969/j.issn.1003-5060.2016.02.023
作者简介:纪静(1988-),女,安徽亳州人,合肥工业大学硕士生;
基金项目:国家自然科学基金资助项目(31270060)
收稿日期:2014-12-10;修回日期:2015-01-15
叶明(1959-),男,安徽怀宁人,博士,合肥工业大学教授,博士生导师.

