槲皮素在聚L-络氨酸修饰电极上的电化学行为及测定
杨 银 张 娜 汪 丽 张克营* 郝玲玲 刘 晨 杨柳青
(1 宿州学院 化学化工学院,安徽 宿州 234000;2 宿州学院 体育学院,安徽 宿州 234000)
槲皮素在聚L-络氨酸修饰电极上的电化学行为及测定
杨 银1张 娜1汪 丽1张克营1*郝玲玲1刘 晨2杨柳青2
(1 宿州学院 化学化工学院,安徽 宿州 234000;2 宿州学院 体育学院,安徽 宿州 234000)
采用电聚合方法制备了聚L-络氨酸修饰电极。利用循环伏安法(CV)探究了pH值、扫描速率对槲皮素电化学行为的影响。用差分脉冲伏安法(DPV)对槲皮素进行测定。结果表明:聚L-络氨酸修饰电极在pH值为6.0的磷酸盐缓冲溶液中对槲皮素表现出良好的电催化能力。在6.21×10-5~6.9×10-4mol/L范围内槲皮素的浓度与相应的检测信号呈现出良好的线性关系,线性方程为:I(10-6A)=-1.034 8-0.099 39c(10-4mol/L),线性相关系数R=-0.987 87,检出限为2.07×10-5mol/L(S/N=3)。电化学分析方法简易快捷、重现性和稳定性高。
L-络氨酸;修饰电极;槲皮素;电催化
0 引言
借以电化学的方法在电极表面聚合某种氨基酸,得到氨基酸薄膜并研究其生理活性,已是许多化学研究者关注的焦点。例如冯玉翔等[12]在玻碳电极上聚合上L-赖氨酸以制备聚L-赖氨酸修饰电极用于甲基对硫磷的伏安行为的研究及检测,实验结果令人满意。孙登明等[13]制备了聚L-络氨酸修饰电极并通过循环伏安法研究了多巴胺的电化学行为,建立了一种微量或痕量测定物质的新方法。目前,电聚合制备修饰电极的方法已是生产和科研中广泛应用的一种实验手段[14]。该方法实验仪器设备和操作步骤简单、分析速度快、较高的准确度和灵敏度、操作条件易于控制、尤其是检测过程的电信号,便于实现自动化或连续分析。
氨基酸化学修饰电极[15]因电极表面氨基酸薄膜不易脱落、较为稳定、制备方法简易、可产生明显的电化学信号,因此在电化学相关领域此技术得到广泛的认可,并有着快速的发展。其中L-络氨酸因其内部的官能团在电催化氧化作用下,可形成离子形式的自由基,该自由基经过扩散在玻碳电极表面以共价键合,最终可在玻碳电极表面形成更加均匀稳定,高效致密的氨基酸有机薄膜。所得修饰电极可利用其三维空间结构,为检测的环境提供多种可利用的势场,也非常利于电催化作用。这一性质在氨基酸修饰电极薄膜的制备方面开启了一种新思路,新方法。例如李容等探究了吡虫啉在聚L-络氨酸修饰电极上有极好的电催化性能,建立了一种直接,高效测定吡虫啉的新途径[16]。此外L-络氨酸制备来源很广泛,制取方法易于实现。在医学方面、药品制作、生化试验、农业、科学研究等多个领域均有着重要作用。
本文主要是在裸玻碳电极表面修饰上L-络氨酸得到聚L-络氨酸修饰电极并利用循环伏安法(CV)探究了影响槲皮素电化学行为的最优测定条件,并使用差分脉冲伏安法对槲皮素进行测定。故而此方法在槲皮素的检测领域拥有十分重要的应用价值。
1 实验部分
1.1 仪器与试剂
KQ5200DB数型控超声波清洗器(昆山市超声仪器有限公司),CHI660D电化学工作站(上海辰华仪器公司),pHS-3C型酸度计(上海雷磁仪器厂),电子天平(梅特勒-托利多仪器上海有限公司),可检测电化学信号的三电极体系: 以饱和甘汞电极(SCE)为参比电极,裸玻碳电极(GCE)或聚L-络氨酸修饰电极为工作电极,铂丝电极作为辅助电极。
槲皮素;L-络氨酸;磷酸盐缓冲溶液;实验所需的其它试剂均为使用前未进一步处理的分析纯。实验用水均为二次蒸馏水,实验整个过程均在室温下进行操作。
槲皮素溶液(1.0×10-2mol/L)的配制:称取0.077 g槲皮素于25 mL的容量瓶中,用蒸馏水稀释至刻度线,摇匀,待用。
设备在进入实际的施工现场过程中,需要技术部门对设备的性能方面进行分析与研究,并制定相应的实际操作规范指引,引导员工进行正确的手法使用相关的设备,同时也要求后勤部门对设备方面进行相关的监督管理做到设备的日常点检仪保养工作。同时采购部核对仓库的设备配件的实际库存情况,定期的有效及时的采购所需要的设备方面的配件,可以提高设备方面的使用效率以及延长设备的使用寿命,需要建立一个统一性的部门配合制度来推进施工现场的设备管理的系统化与科学法。
L-络氨酸溶液(5.0×10-3mol/L)的配制:称取0.036 5 g L-络氨酸于50 mL容量瓶中,加入蒸馏水使其缓慢溶解,直至稀释至刻度线,充分摇匀,待用。
磷酸盐缓冲溶液(0.2 mol/L)的配制:采用浓度均为0.2 mol/L的NaH2PO4和Na2HPO4混合溶液配制磷酸盐缓冲溶液(PBS),并用H3PO4和NaOH调节pH值。
1.2 修饰电极的制备
将裸玻碳电极先在湿润的金相砂纸上打磨,在三氧化二铝粉末的悬浮液中进行打磨抛光,将玻碳电极依次置于硝酸(1+1)、无水乙醇中,超声清洗各2 min,再用二次蒸馏水淋洗,并用滤纸吸干。将处理好的玻碳电极放入浓度为5.0×10-3mol/L的L-络氨酸的磷酸盐缓冲溶液(pH=9)的电解池中,以100 mV/s的扫描速率,电位区间在-0.7~2.2 V内,扫描圈数为5周,扫描结束后取出,备用。
1.3 实验方法
实验主要利用CHI660D电化学工作站记录电流响应信号,三电极系统。将修饰电极置于含有一定浓度的槲皮素的磷酸盐缓冲溶液中,循环伏安法扫描速率设置为100 mV/s,在电位范围为-0.7~2.2 V,运用循环伏安法(CV)探究了槲皮素在阴阳两电极上的伏安行为。利用电化学阻抗法对不同修饰电极薄膜的电化学性能进行表征。以及用差分脉冲伏安法(DPV)记录相应检测信号的大小,实现对槲皮素的测定。为保持修饰电极具有良好的重现性和稳定性,每次实验结束后将三电极放入空白溶液中,多次扫描至没有明显的峰出现。
2 结果与讨论
2.1 L-络氨酸的电聚合图
图1是浓度为5.0×10-3mol/L 的L-络氨酸在PBS(pH=9.0)中的连续循环伏安曲线图。电位扫描范围在-0.7~2.2 V。由图1可见,在扫描第一圈时,出现了一个明显的氧化峰,氧化峰电位位于0.63 V,并且随着扫描圈数的增加,槲皮素的氧化峰电流逐渐增大,峰电位基本不变,当扫描至第四圈时,氧化峰电流变化幅度有所减小,当扫描至第五圈时,氧化峰电流基本保持不变,说明电聚合基本结束。随着扫描圈数的增加,可观察到电极表面变暗,可推知L-络氨酸在玻碳电极表面发生了聚合,故所制的电极为聚L-络氨酸修饰电极。

图1 L-络氨酸(5.0×10-3 mol/L)聚合过程 的连续循环伏安曲线(扫描速率为100 mV/s)Figure 1 Cyclicvoltammograms for L-Tyrosine.
2.2 修饰电极的交流阻抗表征
不同电极表面的有机薄膜的化学性质的差异可采用电化学阻抗法进行表征。图2描述了不同电极在磷酸盐缓冲溶液(0.2 mol/L,pH=6.0)含5 mmol/L的K4Fe(CN)6∶K3Fe(CN)6(1∶1)中的交流阻抗图。实验的工作电位是0.22 V。从图2中可以看出当L-络氨酸聚合到玻碳电极表面时,可以看到阻抗半径非常微小,几乎消失,说明聚L-络氨酸修饰电极的电阻比较小,带电离子可容易传输到有机薄膜表面发生化学反应。证明了L-络氨酸已经成功地聚合到玻碳电极表面且能够提高电子转移速率。

图2 不同电极的交流阻抗图Figure 2 Nyquist plots of bare GCE poly (L-Tyrosine)/GCE in PBS.
2.3 槲皮素在修饰电极上的伏安特性
图3为1.0×10-2mol/L槲皮素在裸玻碳电极(曲线a)和聚L-络氨酸修饰玻碳电极(曲线b)上的循环伏安曲线。由图3可知,槲皮素在裸电极表面有微弱的电流响应信号,而在聚L-络氨酸修饰玻碳电极上产生一对明显的氧化还原峰,氧化峰电流值为1.232×10-5A,还原峰电流值为1.007×10-5A。结果表明聚L-络氨酸修饰电极对槲皮素的氧化还原反应有着较好的催化能力。故而,该聚L-络氨酸修饰电极制备成功。
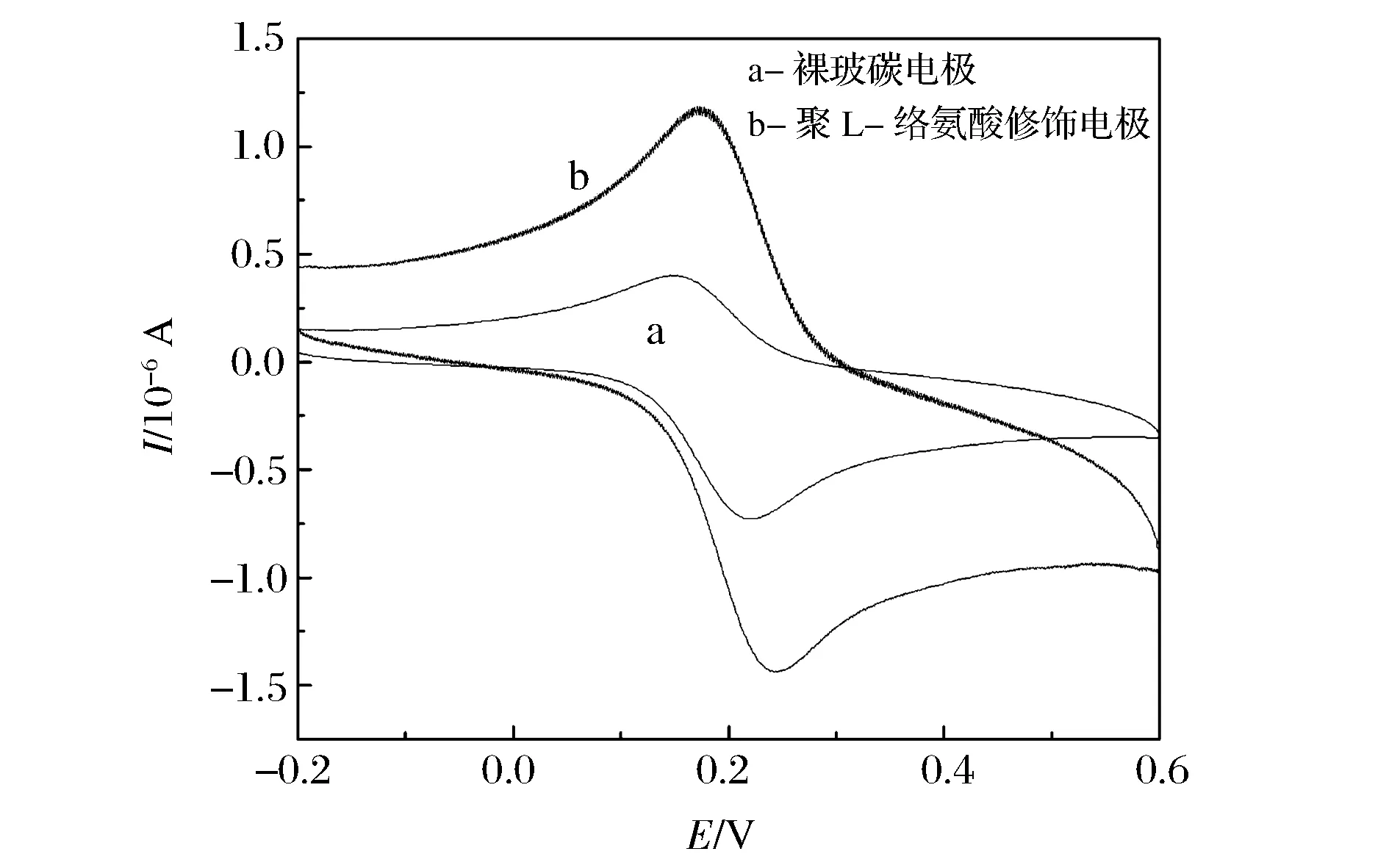
图3 槲皮素在不同电极上的循环伏安曲线图Figure 3 Cyclic voltammetry digrams for quercetin detected at bare GCE and L-Tyrosine/GCE.
2.4 最优条件的选择
2.4.1 pH的影响
酸度对槲皮素的测定有着十分重要的影响,在pH值为4.0~9.0的范围内,利用循环伏安方法考察了槲皮素在不同酸度缓冲液的伏安行为。图4A是槲皮素的氧化峰电流在不同酸度下的变化曲线图。由图4A可知,当pH值从4.0增加到6.0时,槲皮素氧化峰电流不断增大。当pH值达到6.0时,槲皮素的氧化峰电流值最大,当pH值从6.0增加到8.0时,随着pH值的升高,槲皮素氧化峰电流反而降低。因此在整个实验过程均是在pH值为6.0的磷酸盐缓冲溶液中进行。图4B是槲皮素的氧化峰电位在不同酸度下的变化曲线图。由图4B可见,随着pH值的增大,槲皮素的氧化峰电位明显负移且构成一定的变化规律,两者之间的线性回归方程为:E(V)=-0.058 0pH+0.588 6相关系数R为-0.9808。由dEp/dpH=0.058(V/pH),说明槲皮素在电极上反应的电子转移数和参与反应的质子数相等。

图4A pH值对槲皮素的氧化峰电流的影响Figure 4A Effects of PH on oxidation peak current of quercetion.

图4B pH值对槲皮素的氧化峰电位的影响Figure 4B Effects of PH on oxidation peak voltage of quercetin.
2.4.2 扫描速率的影响
图5A是1.0×10-2mol/L槲皮素在pH值为6的磷酸盐缓冲溶液中在聚L-络氨酸修饰电极上的循环伏安曲线。由图可知:随着扫描速率的增大,槲皮素的峰电流增加,氧化峰电位正移,还原峰电位负移。图5B、5C分别为槲皮素的峰电流与扫描速率之间的关系。在扫描速率为20~180 mV/s范围内,槲皮素的峰电流与其扫描速率成良好的一次线性关系,线性方程分别为i(10-6A)=-0.528 67-6.794 75v(V/s)(R1=-0.992 01);i(10-6A)=0.435 8+5.4v(V/s)(R=0.991 56)。结果表明,槲皮素在聚L-络氨酸修饰电极薄膜上发生的化学反应是吸附控制过程。从图5D可知:还原峰电位和扫描速率的对数成良好的一次线性关系,线性相关方程为E=0.180 65-0.067 5lgv,R=-0.995 91。根据文献[15]可知槲皮素的电极反应过程质子的参与数为2。

图5A 不同扫速条件下的聚L-络氨酸修饰电极的循环伏安图Figure 5A CV of L-Tyrosine/GCE under the condition of different scanning rate in the PBS (pH=6.0) containing 1.0×10 -2 mol/L quercetin.
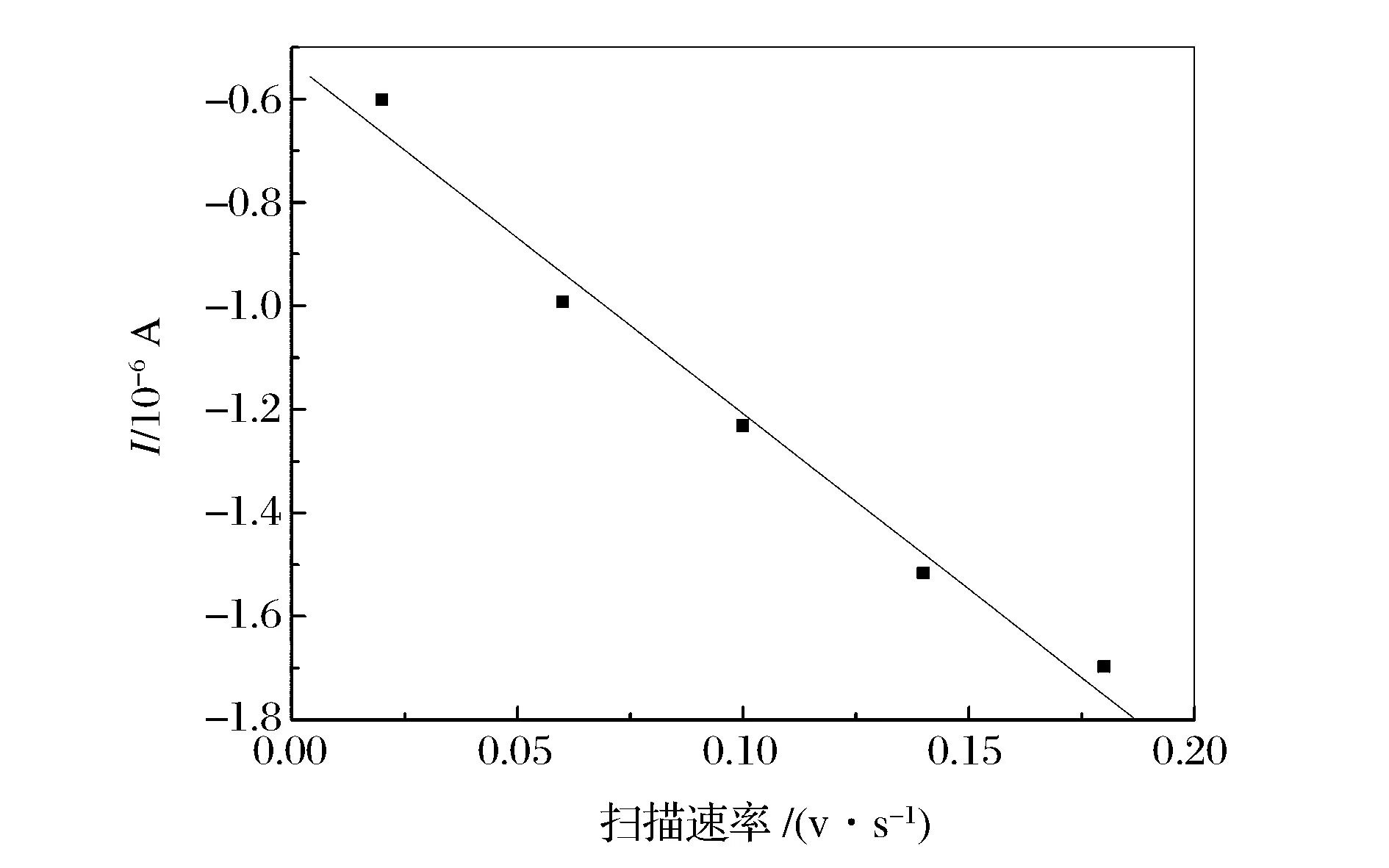
图5B 扫描速率和槲皮素的氧化峰电流之间的关系Figure 5B Relationship between oxidation peak current of quercetin and scan rate.

图5C 扫描速率和槲皮素的还原峰电流之间的关系Figure 5C Relationship between reduction peak current of quercetin and scan rate.
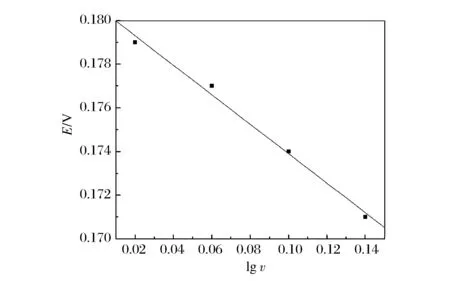
图5D 扫描速率与槲皮素还原峰电位之间的关系Figure 5D Relationship between reduction peak potential and scan rate.
2.5 工作曲线和检出限
在最优的实验条件下,采用示差脉冲伏安法(DPV)分别研究了槲皮素的氧化峰电流与其浓度的关系,由图6A可知,不同浓度的槲皮素在聚L-络氨酸修饰电极上可检测到稳定且明显的电流响应信号。随着槲皮素浓度的增加,峰电流逐渐增加。由图6B可知槲皮素浓度在6.21×10-5~6.9×10-4mol/L和其氧化峰电流之间有良好的线性关系,线性方程I(10-6A)=-1.034 8-0.099 39c(10-4mol/L)相关系数R1为-0.987 87,检出限为2.07×10-5mol/L。
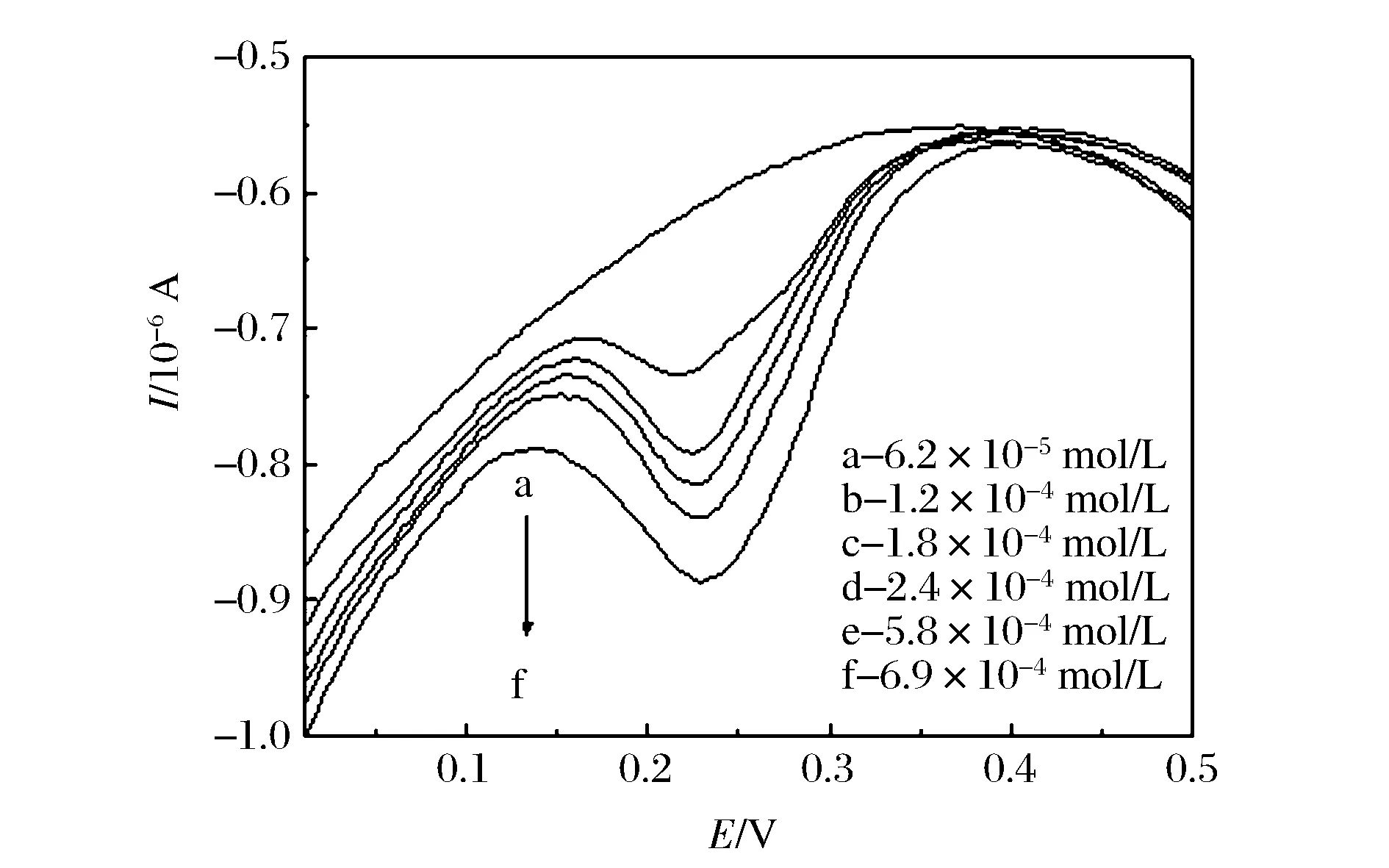
图6A 不同浓度的槲皮素在聚L-络氨酸修饰电极上的DPV曲线Figure 6A DPV diagram of different concentrations of quercetin on the modified electrode in 0.2 mol/L PBS.

图6B 槲皮素的浓度和其氧化峰电流的关系Figure 6B Linear relationship between concentration of quercetin and oxidation peak current.
2.6 稳定性、重现性实验
将制备好的聚L-络氨酸修饰电极连续扫描20圈,用于同浓度的槲皮素的检测,未发现有明显的峰电流变化,将聚L-络氨酸修饰电极同时置于PBS(0.2 mol/L,pH=6.0)中室温下两天,用于同浓度槲皮素的检测,没有发现明显的峰电流变化。说明在该修饰电极上对电流响应信号起着显著的稳定功能。分别制备三个聚L-络氨酸修饰电极检测同浓度的槲皮素,相对标准偏差在可接受的范围内,说明该修饰电极对槲皮素的测定具有很好的重现性。
3 结论
在最佳的实验条件下,利用循环伏安法将L-络氨酸电聚合修饰于玻碳电极上,制备出对槲皮素有良好电催化作用的聚L-络氨酸修饰电极,建立了一种直接测定槲皮素的简易快速,便于普及的电化学分析方法。在6.21×10-5~6.9×10-4mol/L范围内槲皮素的浓度与相应的检测信号呈现出良好的一次线性关系,线性方程为:I(10-6A)=-1.034 8-0.099 39c(10-4mol/L)(R=-0.987 87),检出限为2.07×10-5mol/L。结果表明聚L-络氨酸修饰电极对槲皮素的测定有较低的检测限,此外,聚L-络氨酸修饰电极还表现出较好的稳定性和重现性。
[1] 廖文利,李忠彬,李念兵.抗坏血酸在聚L-谷氨酸修饰玻碳电极上的电化学行为研究[J].重庆文理学院学报(JournalofChongqingUniversityofArtsandSciences),2010,29(5):57-61.
[2] Caomano M M, Garcia L V,Elorza B. Improved RPLC determination of acyclovir using hexylamine as silanol masking agent[J]. Pharm Biomed .nal., 1999,21(3):619-624.
[3] 陈明俊.槲皮素化学修饰碳糊电极循环伏安法测定抗坏血酸[J].理化检验:化学分册(PhysicalTestingandChemicalAnalysis:ChemicalAnalysis),2012,48(10):1174-1176.
[4] 赵美莲,倪丹丹,王建文,等.直接电沉积金纳米粒子修饰氧化铟锡电极测定亚硝酸根[J].分析化学(JournaloftheAmericanChemicalSociety),2008,12(4):1729-1731.
[5] 周学酬,郑新宇,吕日新,等.槲皮素在聚谷氨酸修饰玻碳电极上的伏安行为及检测[J].分析试验室(ChineseJournalofAnalysisLaboratory),2012,31(5):34-37.
[6] 朱玲艳,王宗花,陈小印,等.聚吡咯/碳纳米管分子印迹修饰电极对槲皮素的选择性测定[J].分析测试学报(JournalofInstrumentalAnalysis),2011,30(1):18-23.
[7] Jin WR, Wei HY, Zhao X. Determination of adenine and guanine by capilly zone electrophoresis with end-column amperometric detection at a carbon fiber microdisk array electrode[J]. Electroanalysis,1997,19(4):770-774.
[8] Pejic N, Kuntic V, Vujic Z, et al.Direct spectrophotometric determination of quercetin in the presense of ascorbic acid[J]. Il Farmaco,2004,59(1):21-24.
[9] 刘进邦,孟昭仁.双波长叠加法测定样品中槲皮素含量[J].分析科学学报(JournalofAnalyticalScience),2006,22(5):617-620.
[10] 许雪琴,游俊,陈国南.槲皮素的阳极伏安行为研究[J].福州大学学报:自然科学版(JournalofFuzhouUniversity:NaturalScienceEdition), 2003,31(4):485-487.
[11] 方浩,吴孝增,张娜,等.槲皮素在氧化锆修饰玻碳电极上的伏安行为及检测[J].中国无机分析化学(ChineseJournalofInorganicAnalyticalChemistry),2013,3(4):65-68.
[12] 冯玉翔,张升晖.电聚合L-赖氨酸膜修饰电极对甲基对硫磷的检测研究[J].湖北民族学院学报:自然科学版(JournalofHubeiInstitudeforNationalities:NaturalScienceEdition),2012,30(1):15-17.
[13] 孙登明,张振新,马伟,等.聚L-络氨酸修饰电极的制备及对多巴胺的测定[J].分析试验室(ChineseJournalofAnalysisLaboratory),2005,24(7):28-30.
[14] 赵志伟,申贵隽,谷灵燕.DL-赖氨酸-β-环糊精/碳纳米管修饰电极的制备与应用研究[J].中国无机分析化学(ChineseJournalofInorganicAnalyticalChemistry),2015,5(1):70-74.
[15] 王春燕,李云辉,田坚,等. 氨基酸化学修饰电极的制备及其应用[J].长春理工大学学报:自然科学版(JournalofChangchunUniversityofScienceandTechnology:NaturalScienceEdition), 2011,34(1):150-152.
[16] 李容,蒋晓丽,池永明,等. 吡虫啉在聚L络氨酸修饰电极上的电化学行为及其测定[J].分析测试学报(JournalofInstrumentalAnalysis),2010,29(5):502-506.
[17] 陈小印,王宗花,张菲菲,等.槲皮素在聚对氨基苯磺酸修饰电极上的电化学研究[J].青岛大学学报:工程技术版(JournalofQingaoUniversity:EngineedringTechologyEdition),2010,25(1):54-57.
Electrochemical Behaviors and Determination of Quercetin at Poly (L-Tyrosine) Modified Electrode
YANG Yin1, ZHANG Na1, WANG Li1, ZHANG Keying1*, HAO Lingling1, LIU Chen2, YANG Liuqing2
(1.DepartmentofChemistry-Biology,SuzhouUniversity,Suzhou,Anhui234000,China; 2.DepartmentofPhysicalEducation,SuzhouUniversity,Suzhou,Anhui234000,China)
A poly (L-Tyrosine) modified electrode was prepared by electro-polymerization technology. The electrochemical behavior on pH and scan rate was investigated by cyclic voltammetry (CV). The contents of quercetin were determined using differential pulse voltammetry (DPV). The results indicated that the modified electrode showed a good electric catalytic ability for quercetin in phosphate buffer solution with pH=6.0. Linear relationship between the oxidation peak current and the concentrations of quercetin was obtained in the range of 6.21×10-5~6.9 ×10-5mol/L. The linear equation wasI(10-6A) =1.034 8-0.099 39c(10-4mol/L) with correlation coefficient (R) of -0.98787. The detection limit (S/N=3) was 2.07×10-5mol/L. The method has fast analytical speed, good accuracy, high reproducibility and stability.
L-Tyrosine; modified electrodes; quercetin; electric catalytic
10.3969/j.issn.2095-1035.2016.01.020
2015-10-29
2015-12-09
国家创新创业项目(201510379037);省级创新创业项目(AH201510379051);宿州学院大学生科研立项(KYLXLKZD15-01;KYLXLKYB15-25)资助
杨银,女,学生,主要从事应用化学研究。
*通信作者:张克营,男,讲师,主要从事电分析化学研究。E-mail: zhangky1983@163.com
O657.1;TH832
A
2095-1035(2016)01-0077-06

