纳米二氧化硅粒子的制备及对BSA结构的影响
李伟瀚 田珍珍 周鹤林 王宜美 徐 畅 张怀斌
(滨州医学院 药学院,山东 烟台 264003)
纳米二氧化硅粒子的制备及对BSA结构的影响
李伟瀚 田珍珍 周鹤林 王宜美 徐 畅 张怀斌
(滨州医学院 药学院,山东 烟台 264003)
在碱性条件下水解正硅酸乙酯(TEOS)制备纳米二氧化硅(SiO2)粒子,并采用同步荧光光谱和紫外可见分光光度法探讨了SiO2对牛血清白蛋白(Bovine Serum Albumin,BSA)结构的影响。结果显示,SiO2纳米粒子对BSA的结构没有发生显著的影响,这说明在实验条件下,SiO2不会改变BSA分子的结构和微环境。
二氧化硅;牛血清白蛋白;同步荧光光谱;紫外可见分光光度法
0 引言
纳米二氧化硅具有良好的物理化学性能,在生物医药领域受到广大研究者的青睐,经常被用作靶向药物的载体[1-4]。二氧化硅在被广泛应用同时,其对人体及其环境的毒性效应也日益受到人们的高度关注。例如:赵峰等[5]研究发现纳米SiO2颗粒可降低血管内皮细胞活力,破坏细胞膜完整性,损伤线粒体,导致线粒体膜电位下降,最终发生细胞凋亡;纳米粒子可以随血液进入体内的各个组织器官[6],并可以引起大鼠肺、肝、心等器官不同程度的损伤[7]。这些研究主要集中在纳米二氧化硅对细胞和活体动物的毒性方面,而在分子水平上研究二氧化硅对蛋白质的毒性作用方面国内鲜见报道[8]。蛋白质是组成生物体的重要物质,牛血清白蛋白(Bovine Serum Albumin,BSA)因与人血清白蛋白具有相似的结构常作为体外模型蛋白[9]。鉴于上述原因,本文制备出了二氧化硅纳米粒子,探讨了二氧化硅纳米粒子对BSA结构的影响,为二氧化硅在生物医学领域的应用和安全性评价方面提供一些参考依据。
1 实验部分
1.1 试剂与仪器
正硅酸乙酯(TEOS)、氨水、异丙醇(IPA)、牛血清白蛋白(BSA)、pH=7.4的Tris-HCl缓冲溶液、无水乙醇等均为分析纯,购自国药集团;水为二次蒸馏水。用Tris-HCl缓冲溶液配制浓度为1.0×10-5mol/L的BSA溶液,4 ℃的冰箱中储存备用。
TG16-WS台式高速离心机(上海仪器厂),GL-2型恒温加热磁力搅拌器(巩义市予华仪器有限责任公司),JEM-1400透射电子显微镜(日本株式会社),55型Fourier红外光谱仪(德国Bruker公司),TU-1901紫外可见分光光度计(北京普析仪器公司),LS55荧光仪(美国, PerkinElemer公司)。
1.2 实验方法
1.2.1 纳米SiO2粒子的制备
参照文献[10],量取16.5 mL IPA,16 mL氨水,28 mL蒸馏水于圆底烧瓶中,磁力搅拌均匀,加入60 mL TEOS溶液(1%,v:v,TEOS/IPA),搅拌20 min,然后缓慢滴加6.0 mL TEOS,搅拌反应6 h,离心得到白色二氧化硅(SiO2),分别用乙醇、蒸馏水洗涤3次,烘箱中50 ℃烘干备用。
称取10.70 mg SiO2纳米粒子研细,超声分散到50 mL蒸馏水中。每次使用前都超声分散均匀。
1.2.2 纳米SiO2粒子与BSA相互作用的光谱测试
取3 mL BSA溶液于石英比色皿中,依次加入一定量的纳米SiO2分散液,混合均匀,静置5 min,设定激发和发射波长的差值分别为15 nm和60 nm,在220~320 nm范围内进行同步荧光测定。
将上述BSA与纳米SiO2的混合溶液在200~400 nm范围内测定其紫外可见吸收光谱强度。
2 结果与讨论
2.1 纳米SiO2粒子的表征
图1是SiO2纳米粒子的透射电镜图,制备的SiO2纳米粒子呈球形均匀分布,表面光滑,直径约为220 nm。
图2是SiO2纳米粒子的Fourier红外光谱图,图中1 636 cm-1处的峰是纳米二氧化硅表面羟基的特征峰,1 112、796和453 cm-1处的峰分别对应于Si-O-Si键的反对称伸缩振动、对称伸缩振动和弯曲振动的吸收峰,952 cm-1处的峰是Si-OH的伸缩振动峰[10-11]。

图1 SiO2纳米粒子的透射电镜照片Figure 1 TEM image of SiO2 nanoparticles.
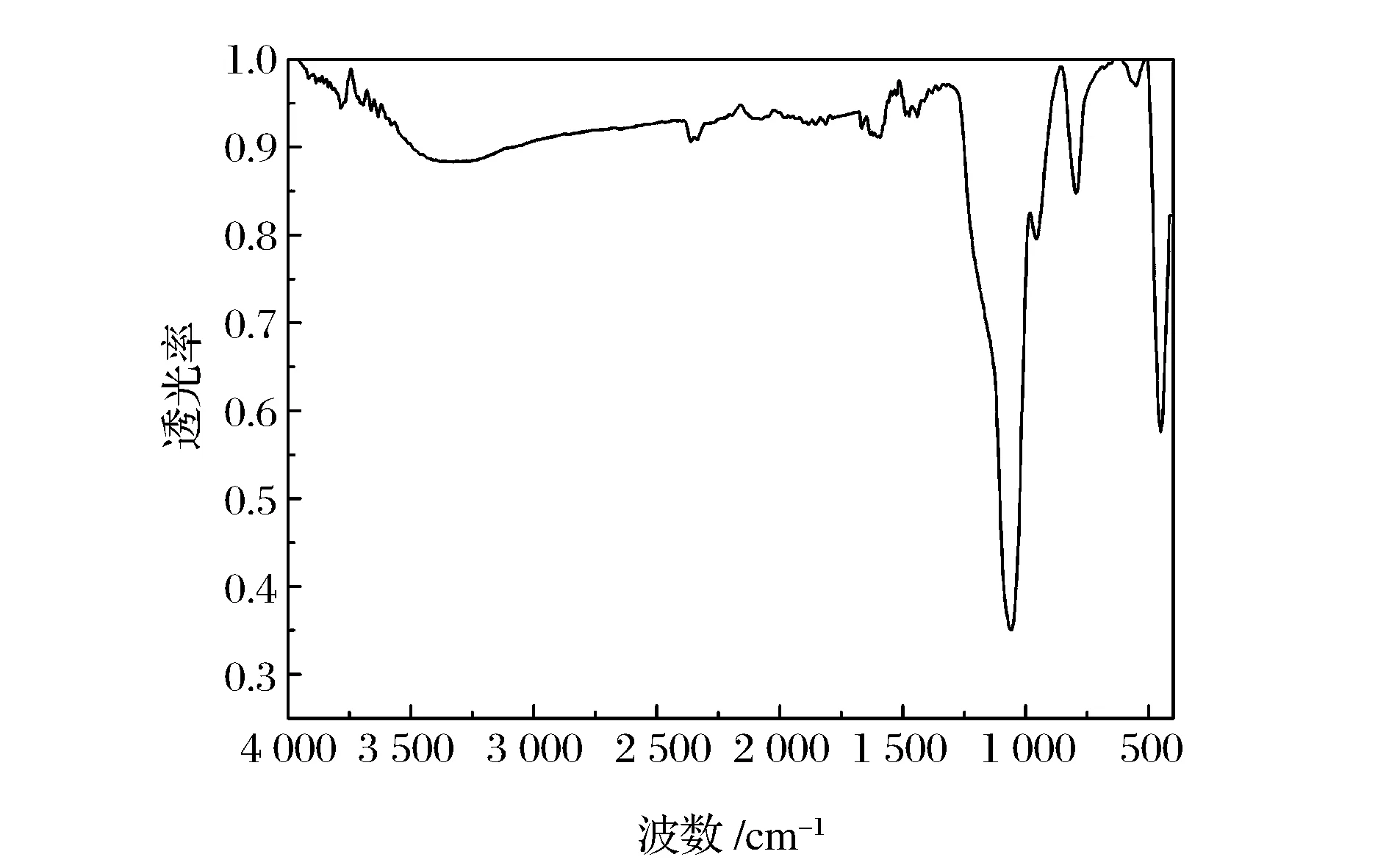
图2 SiO2纳米粒子的FTIR红外光谱图Figure 2 FTIR spectra of SiO2 nanoparticles.
2.2 纳米SiO2粒子对BSA结构的影响
BSA分子中因含有苯丙氨酸、酪氨酸和色氨酸发色团而具有荧光。同步荧光技术在分析BSA分子微环境的变化方面具有较高的灵敏性。同步荧光发射峰位置的改变可以反映发色团微环境极性的变化,进而判断物质对BSA结构的影响[12-13]。图3是BSA在不同浓度(SiO2浓度由上到下分别为:0、1.33、2.63、3.92、5.19、6.45×10-3mg/mL)纳米SiO2分散体系中的同步荧光光谱图,图3A是色氨酸的同步荧光光谱图,当SiO2与BSA相互作用时,色氨酸的同步荧光强度降低,发射峰位置略有移动,这说明在该实验条件下SiO2对色氨酸的微环境有影响,但影响较小;图3B酪氨酸的同步荧光光谱发射峰位置和强度均没有明显的变化,这说明SiO2纳米粒子对酪氨酸的微环境没有影响。通过分析得出,少量的SiO2纳米粒子对BSA结构中微环境的影响甚小。
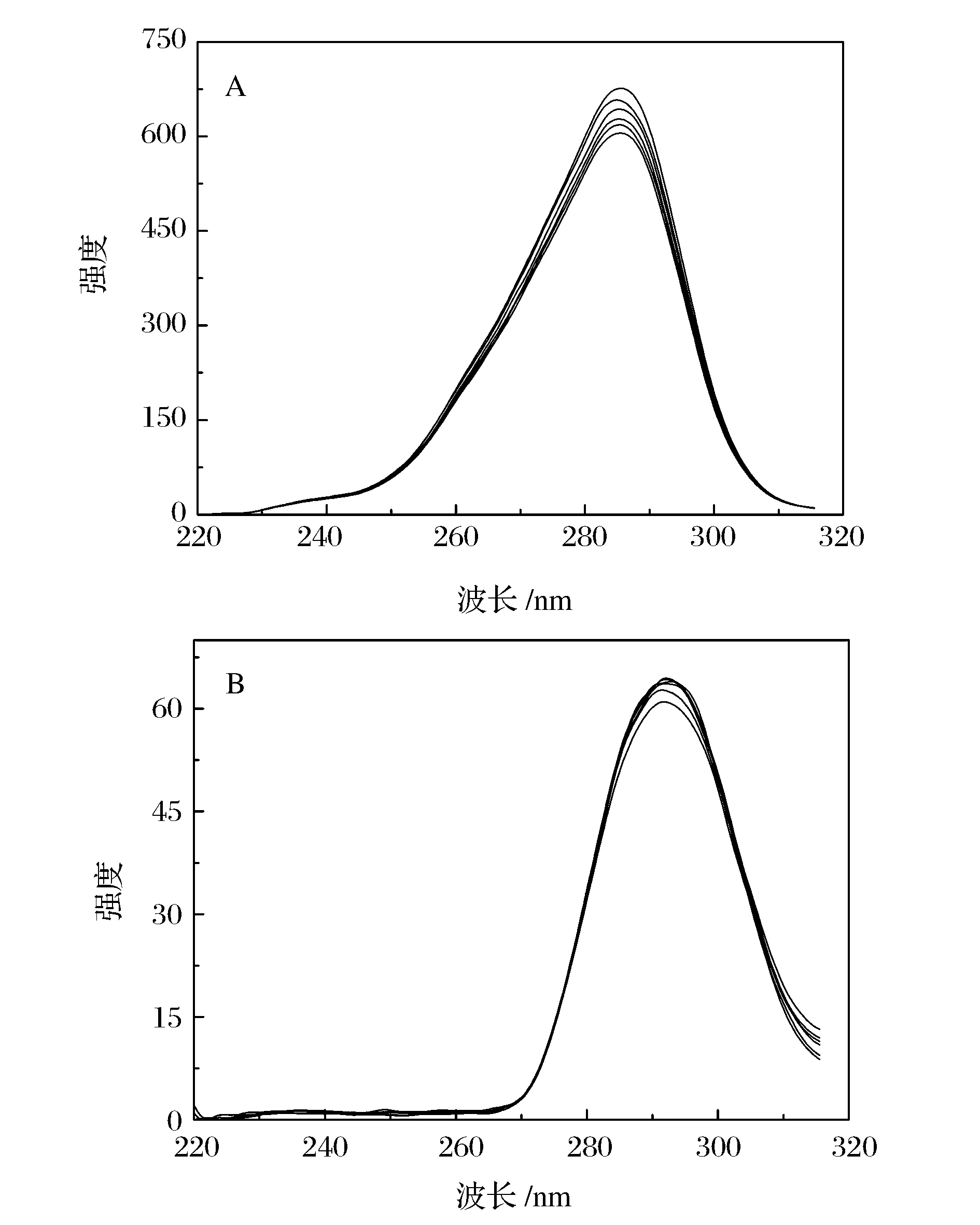
图3 BSA的同步荧光光谱图 A:色氨酸残基的同步荧光光谱;B:酪氨酸残基的发射光谱Figure 3 Synchronous fluorescence spectra of BSA with SiO2 nanoparticles at 296 K. A and B:Synchronous fluorescence spectra of tryptophan and tyrosine residues.
紫外可见分光光度法可以揭示BSA结构的变化。BSA有两个吸收峰,在210 nm处的强吸收峰主要是BSA分子二级结构的吸收峰,此处吸收峰的变化可以反映BSA二级结构变化的情况;280 nm处的弱吸收峰主要是氨基酸残基的吸收峰,此处吸收峰的变化主要反映发色团微环境的变化[14]。固定BSA的浓度,逐渐增加SiO2的浓度,获得BSA紫外可见吸收光谱如图4,通过图4,可以清晰地观察到,随着SiO2的加入,在210 nm和280 nm附近的吸收峰位置和强度均没有发生变化。说明SiO2粒子对BSA的二级结构没有产生影响。
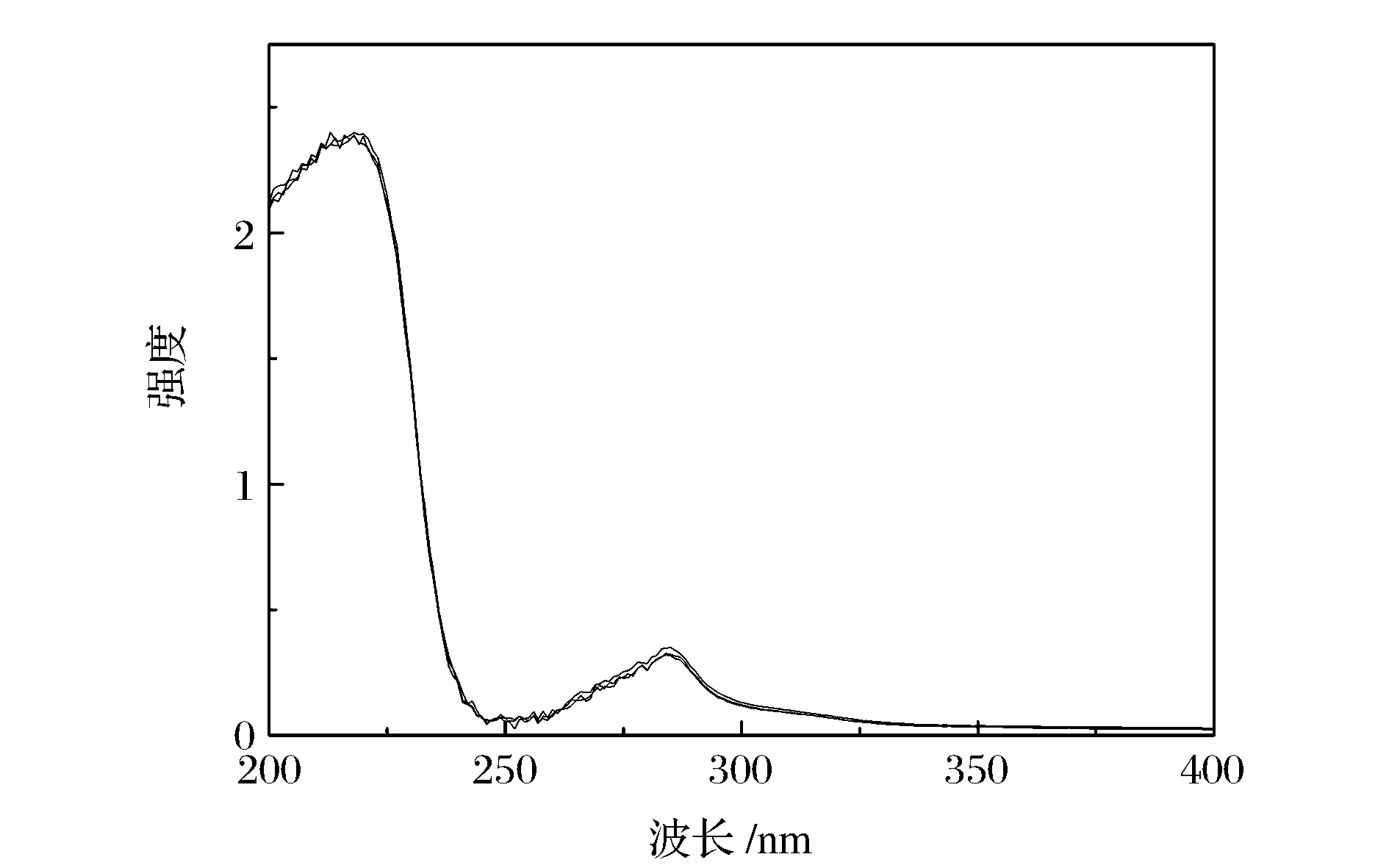
图4 SiO2纳米粒子存在下BSA的紫外-可见光谱图Figure 4 UV-Vis absorption spectra of BSA with SiO2 nanoparticles.
3 结论
在碱性条件下水解TEOS制备出了粒径为220 nm的SiO2粒子,采用光谱法研究了SiO2纳米粒子对BSA结构的影响。结果显示,实验条件下少量的SiO2纳米粒子对BSA结构没有产生影响,说明SiO2纳米粒子具有很好的生物相容性。这为SiO2纳米粒子的生物医学应用提供了一定的安全保障。
[1] Li Na,Yu Zhengze,Pan Wei,et al.A near-infrared light-triggered nanocarrier with reversible DNA valves for intracellular controlled release[J].Adv. Funct. Mater,2013(23),2255-2262.
[2] Liu Rui,Zhao Xiang,Wu Tao,et al. Tunable redox-responsive hybrid nanogated ensembles [J].Journal of the American Chemical Society,2008,130(44):14418-14419.
[3] Liu Rui,Zhang Ying,Zhao Xiang,et al.pH-Responsive nanogated ensemble based on gold-capped mesoporous silica through an acid-labile acetal linker[J].Journal of the American Chemical Society,2010,132(5):1500-1501.
[4] 张瑞锐,史建国,丁露,等.多孔二氧化硅纳米颗粒在药物释放领域中的应用进展[J].化学传感器(ChemicalSensors),2012,33(3):11-20.
[5] 夏银叶,李艳博,牛丕业,等.纳米二氧化硅颗粒对血管内皮细胞的毒性及其凋亡诱导作用[J].吉林大学学报(JournalofJilinUniversity),2015,41(3):454-459.
[6] Burch WM. Passage of inhaled particles into the blood circulation in humans[J].Circulation, 2002,106(20):e141-e142.
[7] 高艳荣,余艳琴,贾玉巧,等.不同粒径纳米和常规微米 SiO2对大鼠肺、肝、心、睾丸组织的氧化损伤作用[J].中国疗养医学(ChineseJournalofConvalescentMedicine),2014,23(2):97-99.
[8] 王君,丁娜,张朝红,等.光谱法研究纳米二氧化硅催化超声波照射对牛血清白蛋白的损伤[J]. 光谱学与光谱分析(SpectroscopyandSpectralAnalysis),2009,29(4):1069-1073.
[9] Cao Shuhong,Jiang Xinyu,Chen Jingwen.Effect of Zinc (II) on the interactions of bovine serum albumin withavonols bearing different number of hydroxyl substituent on B-ring[J].J Inorganic Biochem,2010,104(2):146-152.
[10] 崔媛,李艳辉,段潜.多孔纳米二氧化硅球的制备及其对胰岛素的担载和释放行为[J].硅酸盐学报(JournaloftheChineseCeramicSociety),2013,41(2):240-244.
[11] 王士婷,陈文娟,王德平,等.Fe3O4@m-SiO2磁性纳米颗粒的制备及其药物缓释行为[J].硅酸盐学报(JournaloftheChineseCeramicSociety),2013,41(3):280-287.
[12] Teng Yue,Liu Rutao,Li Chao, et al. The interaction between 4-aminoantipyrine and bovine serum albumin: Multiple spectroscopic and molecular docking investigations[J].Journal of Hazardous Materials,2011,190(1-3):574-581.
[13] Mi Ran,Hu Yanjun,Fan Xiaoyang,et al. Exploring the site-selective binding of jatrorrhizine to human serum albumin: Spectroscopic and molecular docking approaches[J].Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy,2014(117):163-169.
[14] Wang Jing,Liu Rutao,Qin Pengfei.Toxic interaction between acid yellow 23 and trysin: Spectroscopic methods coupled with molecular docking[J].J. Biochem. Mol. Toxicol.,2012, 26(9):360-367.
Preparation of Silica Nanoparticles and their Effects on the Structure of Bovine Serum Albumin
LI Weihan, TIAN Zhenzhen, ZHOU Helin, WANG Yimei, XU Chang, ZHANG Huaibin*
(PharmaceuticalCollege,BinzhouMedicalUniversity,Yantai,Shandong264003,China)
The silica (SiO2) nanoparticles were prepared via hydrolyzing ethyl orthosilicate (TEOS) in an alkaline medium. The impact of silica nanoparticles on the structure of bovine serum albumin (BSA) was studied using synchronous fluorescence spectroscopy and UV-vis absorption spectroscopy. The results showed that SiO2nanoparticles do not influence significantly the structure of BSA. This also showed that the conformation and microenvironment near the chromophores of BSA don't be changed under the experimental conditions.
silica; bovine serum albumin; synchronous fluorescence spectroscopy; UV-vis absorption spectroscopy
10.3969/j.issn.2095-1035.2016.01.019
2015-09-02
2015-12-03
山东省高等学校科技计划项目(J12LD55);滨州医学院大学生科技创新项目(BY2013DKCX107,BY2014DKCX092)资助
李伟瀚,男,学生。
通信作者:张怀斌,男,讲师,主要从事生物分析化学研究。E-mail: zhanghuaibinhua@163.com
O654.4;X131
A
2095-1035(2016)01-0073-03

