酸性红褪色分光光度法测定食盐中碘的含量
孙 洋 李占清 魏海英
(河北大学 化学与环境科学学院,河北 保定 071002)
酸性红褪色分光光度法测定食盐中碘的含量
孙 洋 李占清 魏海英*
(河北大学 化学与环境科学学院,河北 保定 071002)
研究了在H2SO4-KBr的介质中,碘酸钾能够氧化酸性红并使之褪色,且褪色的程度与碘酸根的含量在一定范围内有很好的线性关系,从而建立了一种新的测定碘的方法。实验结果表明,酸性红的最大吸收波长为510 nm,碘的含量在0~50 μg/50mL范围内,符合比耳定律,其回归方程为A=0.004 13C+0.032 14,相关系数R2=0.998 3,检出限为0.78 μg/50mL。方法操作简单,快速准确,用于食盐中碘含量的测定,结果令人满意。
酸性红;褪色分光光度法;碘
0 前言
有“智力元素”之称的碘是人体的必需微量元素之一。健康成人体内碘的总量为30 mg,其中70%~80%存在于甲状腺。甲状腺分泌的甲状腺素对人体的生长发育和新陈代谢有着至关重要的作用,是脑组织正常发育必不可少的营养物质。缺碘易患大脖子病,即地方性甲状腺肿,同时会影响大脑的发育,导致智力低下。但如果长期摄入过量的碘或一次性摄入大剂量的碘,也会对人体健康造成危害,比如碘致甲状腺亢进、甲状腺癌,碘过敏或碘中毒[1]。
对于碘的分析测定,现在已有很多测定方法,有滴定分析法[2]、离子选择电极法[3]、气相色谱法[4]、联用技术[5]、分光光度法[6-9]等。分光光度法仪器设备简单,操作方便、快速,灵敏度高,应用广泛[10]。在硫酸介质中碘酸根能定量氧化酸性红褪色,且褪色前后的吸光度差与碘的浓度成正比。由此建立了测定碘的新方法,用于测定食盐中的碘含量,结果满意。
1 实验部分
1.1 仪器与试剂
分析天平(奥豪斯仪器有限公司);TU-1810紫外可见分光光度计(北京普析通用有限公司);恒温器;容量瓶;吸量管;移液管。
碘标准储备溶液(1.0 mg/mL):称取优级纯碘酸钾0.168 6 g,用少量水溶解并转移至100 mL容量瓶中定容,每次用时稀释为10 μg/mL的碘标准溶液。
KBr溶液(0.4 mol/L);H2SO4溶液(9.0 mol/L);酸性红溶液(1.5 g/L)。
实验用水为二次去离子水。
1.2 实验方法
取两支50 mL的比色管,再分别依次加入1.0 mL H2SO4溶液、2.0 mL酸性红溶液、1.0 mL KBr溶液,再向其中的一支比色管中加入5 mL碘标准溶液(10 μg/mL),然后加蒸馏水至刻度摇匀,置于恒温器中,70 ℃水浴加热20 min,取出并用流水冷却至室温,在波长510 nm处测定试剂空白吸光度A0及样品吸光度A,最后计算吸光度差值A=A-A0。
2 结果与讨论
2.1 波长选择
按照实验方法制取溶液,在400~600 nm范围内分别测定不含及含碘的酸性红溶液的吸光度值,结果如图1所示。由图1可知,两条曲线的形状相似,说明发生褪色反应后,没有新的吸收峰干扰,且在510 nm处有最大吸收波,所以选择510 nm为测量波长。

图1 吸收光谱谱图Figure 1 Absorption spectra.
2.2 硫酸用量
碘酸根的氧化性一定酸度下才能更好地发挥,所以考察了硫酸的用量。分别准确移取0.00、0.20、0.50、1.00、2.00、3.00、4.00、5.00 mL硫酸(9.0 mol/L)于10 mL比色管中,再按实验方法测定它们的吸光度A,结果如图2所示,硫酸(9.0 mol/L)的用量在0.50~2.00 mL时,吸光度比较稳定,故实验选用硫酸(9.0 mol/L)的用量为1.00 mL。

图2 硫酸(9.0 mol/L)体积对吸光度的影响Figure 2 Effect of the volume of H2SO4on the absorption.
2.3 溴化钾的用量
溴化钾在反应中有一定的催化作用,加入适量溴化钾能加快褪色反应的速度。依次准确移取0.00、0.20、0.50、1.00、2.00、3.00、4.00、5.00 mL溴化钾溶液(0.4 mol/L)于10 mL比色管中,按实验方法测定溶液的吸光度A,结果如图3所示,溴化钾用量在0.50~2.00 mL范围内吸光度较稳定,故实验选用溴化钾用量为1.00 mL。

图3 溴化钾体积对吸光度的影响Figure 3 Effect of the volume of KBr on the absorption.
2.4 反应温度及反应时间的影响
按照实验方法,分别间隔10 ℃测定30~100℃下含碘(50 μg/50mL)的酸性红溶液与不加碘的酸性红溶液的吸光度之差A,结果表明,反应温度在70 ℃时,A最大,故选择70 ℃作为反应温度。
分别测定反应时间为5、10、15、20、25、30、35 min时的吸光度之差,结果表明反应20 min时A达到最大值,且A趋于稳定,说明反应已经完全,故选择反应时间为20 min。
2.5 共存离子的影响
取5.00 mL碘标准溶液若干份,一份直接按实验方法进行测定(不加干扰离子测得的碘为49.8 μg),其余的分别加入各种常见离子进行干扰实验。结果发现某些强氧化性物质如MnO4-、Cr2O72-、CrO4-等干扰测定特别严重,但一般样品中不存在这些物质。其它离子结果如表1所示,当相对误差不大于±5%时,基本不干扰测定。

表1 共存离子的影响
2.6 工作曲线的绘制及检出限的测定
向7支50 mL比色管中均加入1.0 mL H2SO4溶液(9.0 mol/L),2.0 mL酸性红溶液(1.5 g/L),1.0 mL KBr溶液(0.4 mol/L),再分别加入0.00、0.05、1.00、2.00、3.00、4.00、5.00 mL碘标准溶液(10 μg/mL),蒸馏水稀释定容。70 ℃水浴加热20 min,用流水冷却至室温,分别测吸光度A,再分别求出后6支与第1支不加碘标准溶液的吸光度之差A,作工作曲线,如图4所示,当浓度在0~50 μg/50mL范围内与A呈良好的线性关系。线性方程为A=0.004 13C+0.032 14,相关系数R2=0.998 3,以不加碘的酸性红溶液作试剂空白测定,计算其标准偏差为0.001 1,得到检出限为0.78 μg/50mL。

图4 工作曲线Figue 4 Working curves.
2.7 样品的测定
选用市售的食盐和经实验室提纯的粗盐,其中样品1为河北产加碘低钠盐,样品2为河北产多元素强化营养盐,样品3为粗盐经实验室提纯后的盐。由文献可知[11],日常食用盐所加的碘都是以碘酸根的形式存在,可以直接用本实验方法测定。对于实验室粗盐提纯后的盐,碘以碘离子形式存在,利用KMnO4溶液氧化为碘酸根,再经双氧水处理干扰测定的过量KMnO4后也可用本方法测定。准确称取样品1、2和3各10.0 g,适量蒸馏水溶解后定容至100 mL的容量瓶中,吸取10.00 mL样品溶液于50 mL的比色管中,再按照实验方法进行测定,结果见表2,结果显示市售碘盐的测定结果与标准值比较一致,但粗盐中的碘含量低于实验检出限。
2.8 加标回收实验
向每份样品中加入3.00 mL碘标准溶液(10 μg/mL)进行加标回收实验,加标回收率在99.0%~99.7%,结果如表3所示。
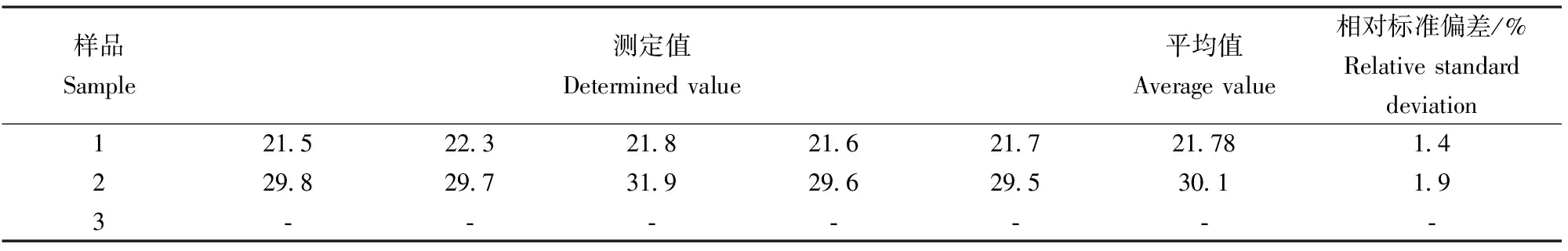
表2 食盐中的碘含量
表3 加标回收实验
Table 3 Recovery tests of the method (n=5) /g

表3 加标回收实验
样品Sample本底值Originalvalue加入量Addition测定值Determinedvalue12345平均值Averagevalue回收率/%Recoverypercent121 83051 651 851 051 651 751 599 0229 73060 159 759 958 461 259 599 3303029 830 230 030 129 629 999 7
2.9 稳定性实验
将测定样品的溶液,在不同的间隔时间进行吸光度测定。结果发现在24 h内,溶液的吸光度基本上不变,说明反应后的体系稳定性良好。
3 结语
H2SO4介质中,用KBr催化碘酸钾氧化酸性红溶液并使之褪色,且其褪色程度在一定浓度范围内与碘酸钾浓度有良好的线性关系,线性方程为:A=0.004 13C+0.032 14,相关系数R2=0.998 3。并对三种食盐进行了碘含量的测定,结果令人满意,该法简便易行,稳定性好,易于推广。
[1] 陈建宾,胡超,谢怡,等.碘与人体健康[J].科技信息(ScientificandTechnologicalInformation),2009,36(12):369-370.
[2] 余裕娟,黄华军,奚星林.滴定法测定食品中微量碘[J].广州食品工业科技(GuangzhouFoodIndustryScienceandTechnology),2003,19(2):93-95.
[3] 胡锡珉,关玉群,王充,等.多次标准加入法-离子选择电极法测定海产品中的碘含量[J].食品科学 (FoodScience),2003,24(9):114-116.
[4] 顾晓梅,王顺荣.以酮类为衍生剂气相色谱法测定碘的研究[J].中国科学院研究生院学报(JournaloftheGraduateSchooloftheChineseAcad),1995,12(2):171-177.
[5] 刘淑萍,梁新华.NaHSO3和NaCl联合增敏光度法测定碘盐中微量碘[J].微量元素与健康研究(StudiesofTraceElementsandHealth),2005,22( 6):42-43.
[6] 王晓玲,张萍,陈燕.盐酸氯丙嗪显色-分光光度法快速测定食盐中的碘含量[J].中国无机分析化学(ChineseJournalofInorganicAnalyticalChemistry),2015,5(3):74-76.
[7] 金文斌,黄娟.褪色光度法测定微量碘的研究[J].干旱环境监测(AridEnvironmentalMonitoring),2002,16(3):129-130.
[8] 张晓光,刘丽,冯晓强.食盐中碘的溴邻苯三酚红褪色光度法测定[J].世界元素医学(WorldElementMedicine),2006,13(4):38-39.
[9] 张慧芳,郭探,李权,等.双波长分光光度法同时测定溶液中的硝酸根和碘离子[J].中国无机分析化学(ChineseJournalofInorganicAnalyticalChemistry),2011,1(4):24-28.
[10] 李占清,魏海英.分光光度法测定新鲜蔬菜中维生素C的含量[J].中国无机分析化学(ChineseJournalofInorganicAnalyticalChemistry),2014,4(3):1-4.
[11] 王先华.降低碘耗的途径[J].中国井矿盐(China Well and Rock Salt),2001,32(5):174-176.
Determination of Iodine in Salts by Fading Spectrophotometic Method with Acid Red 97
SUN Yang,LI Zhanqing, WEI Haiying*
(CollegeofChemistryandEnvironmentalScience,HebeiUniversity,Baoding,Hebei071002,China)
Based on the oxidation color reaction of potassium iodate with acid red 97 in H2SO4and KBr medium, and the chromomeric extent was linear with the content of iodate, a new spectrophotometric method for the determination of iodine in salts was established. Under the optimized analytical conditions, the maximum absorption wavelength was at 510 nm. Beer’s law holds in the range of 0~50 μg/50mL, and the linear regression equation wasA=0.004 13C+0.032 14 with correlation coefficient ofR2=0.998 3. The detection limit was 0.78 μg/50mL. The method is simple quick and accurate for the determination of iodine in salts with satisfactory results.
acid red 97; fading spectrometry; iodine
10.3969/j.issn.2095-1035.2016.01.017
2015-08-31
2015-12-02
河北省科技厅科技支撑项目(112764351)资助
孙洋,男,硕士研究生。
*通信作者:魏海英,女,副教授,主要从事无机分析与配位化学研究。E-mail:weihy@hbu.edu.cn
O657.32;TH744.12
A
2095-1035(2016)01-0065-04

