脉红螺中痕量汞分析方法的研究
宋永刚 于彩芬张玉凤杜 静孙 明姜 冰宋 伦*
(1 辽宁省海洋水产科学研究院,辽宁 大连 116023; 2 辽宁省海洋环境监测总站,辽宁 大连 116023)
脉红螺中痕量汞分析方法的研究
宋永刚1,2于彩芬1,2张玉凤1,2杜 静1,2孙 明1,2姜 冰1,2宋 伦1,2*
(1 辽宁省海洋水产科学研究院,辽宁 大连 116023; 2 辽宁省海洋环境监测总站,辽宁 大连 116023)
为建立DMA-80直接测汞仪测定脉红螺中痕量汞的最优分析方法,通过正交实验优化了仪器分析程序,通过设置进样量梯度,确定了脉红螺样品的最佳进样量。结果表明:DMA-80最优分析程序为:干燥温度200 ℃,干燥时间150 s,分解温度650 ℃,分解时间150 s,齐化时间12 s,氧气流量200 mL/min,最佳进样量为0.1~0.2 g(精确至0.000 1 g),在0~20.0 ng和20.0~1 400.0 ng范围内均呈良好的二次拟合,相关系数为1.000,检出限为0.02 ng。采用国际标准物质贻贝组织(NIST SRM 2976)验证了方法的准确度和精密度,分析结果表明:加标回收率为95.1%~102%,相对标准偏差(RSD)为1.6%~2.2%,精密度和准确度优于海洋行业标准“HY/T147.3—2013”方法中的规定。方法简便快速,重现性好,准确度高,可用于脉红螺中痕量汞的实际检测工作。
汞;直接测汞仪;优化;正交实验;脉红螺
0 前言
汞是一种高毒性人体非必需元素,极易通过摄食进入人体[1],轻度中毒可以导致贫血、头痛、听觉和视觉受损等,慢性中毒可以导致各种神经性疾病甚至死亡,给人类的健康带来很大风险[2-3]。生物标志物是一种用来进行环境污染物毒性效应早期预警的重要工具[4],脉红螺(RapanaVenosa)由于体内的污染物浓度与环境中的平均浓度表现出一致的相关性,长期以来被认为是理想的生物标志物,是重金属指示生物的优势物种,同时,脉红螺也是汞污染的一种潜在指示生物[5]。因此,准确测定脉红螺体内的痕量汞对海洋环境监测至关重要。
生物体内痕量汞的测定方法主要有AFS、ICP-MS、AAS、CVAAS、直接测汞仪等[6-12]。直接测汞仪法以其操作简单快速、样品无需前处理等优点被广泛应用,而且被制定成海洋行业标准“HY/T147.3—2013”[13],但是HY/T147.3—2013分析条件的针对性差,目前没有针对特定物种的分析测定方法,为此,本工作通过正交实验建立了一套适用于测定脉红螺中痕量汞的方法。该方法操作简便、快速,重现性好,准确度高,可用于批量脉红螺样品中痕量汞的快速应急检测,该方法的建立为进一步建立海洋底栖生物中痕量汞的检测方法提供了参考。
1 实验部分
1.1 仪器与试剂
DMA-80直接测汞仪(意大利Milestone公司);瑞士METTLER AE240电子天平(精确至0.000 1 g);CHIRST ALPHA2-4冷冻干燥机(德国Christ公司);MM440球磨仪(德国Restch公司)。
汞标准溶液(1 mg/mL,国家海洋局第二海洋研究所);国际标准物质贻贝组织(NIST SRM 2976,汞含量(61±3.6) μg/kg);优级纯盐酸(美国Sigma公司);氧气(纯度99.99%)。
1.2 样品处理
2014年在辽东湾海域采集脉红螺样品。除去壳外附着物,将软组织分离成内脏和肌肉,冷冻干燥至恒重,用球磨仪磨粉,待测。
1.3 方法原理
DMA-80直接测汞仪无需化学方法进行前处理,样品放入石英舟(已空烧)中称量后直接测定。样品在热分解管中被充分干燥后经热分解释放其中的汞,产生的气体被氧气导入催化炉,完成氧化作用并脱去卤素、硫氧化物和氮氧化物后进入混汞器,发生汞齐化反应被固定。混汞器加热释放出汞蒸汽,并由氧气载入吸收池,在波长253.7 nm处测定[13]。
2 结果与讨论
2.1 正交实验条件优化
不同测试条件下,汞的检测信号强度(峰值)不同,干燥温度、干燥时间、分解温度、分解时间、齐化时间和氧气流量等因素都会影响DMA-80直接测汞仪汞的检测信号强度。而干燥温度、干燥时间、分解温度和分解时间对实验结果影响较大[14]。因此,本文选取此4项因素,结合相关文献报道[13-18],每个因素均取3个水平(见表1),按L9(34)正交表进行正交实验,对DMA-80直接测汞仪测量脉红螺中痕量汞的分析程序进行优化,测定结果见表2。由K1、K2和K3(Kj为第j列因素同一水平所对应的实验指标之和)的大小顺序可知干燥温度为200 ℃,干燥时间为150 s,分解温度为650 ℃,分解时间为150 s时汞的检测信号强度最大,峰值最高,为最优分析程序,从极差Rj(Rj为第j列因素的极差)的大小分析发现,干燥温度对脉红螺中痕量汞的测定影响最大,其次是分解时间,而干燥时间和分解温度的影响相对较小。齐化时间设定12 s,氧气流量选择200 mL/min,与“HY/T147.3—2013”[13]一致。因此,得到DMA-80直接测汞仪最优的分析程序是:干燥温度为200 ℃,干燥时间为150 s,分解温度为650 ℃,分解时间为150 s,齐化时间为12 s,氧气流量为200 mL/min。
2.2 进样量的选择
由于脉红螺是生物样品,有机质含量较高,进样量过大会缩短仪器使用寿命,进样量过小会影响测量结果的准确性,因此,依据“HY/T147.3—2013”[13]建议的最大进样量1.0 g,分别称取1.0、0.8、0.5、0.3、0.2、0.1、0.05、0.01 g(精确至0.000 1 g)的脉红螺肌肉干燥样品进行梯度实验,每个样品之后连续测定三个空白(已空烧的石英舟,吸光度<0.003 0)来检测汞在仪器上的残留污染,测定结果见表3。结果表明:进样量为1.0、0.8、0.5、0.3 g时,容易污染催化管,使仪器产生记忆效应,干扰后续样品的测定,进样量为0.05、0.01 g时,响应值较低,使测定结果偏低,所以确定脉红螺干燥样品的最佳进样量范围为0.1~0.2 g。

表1 实验因素水平表
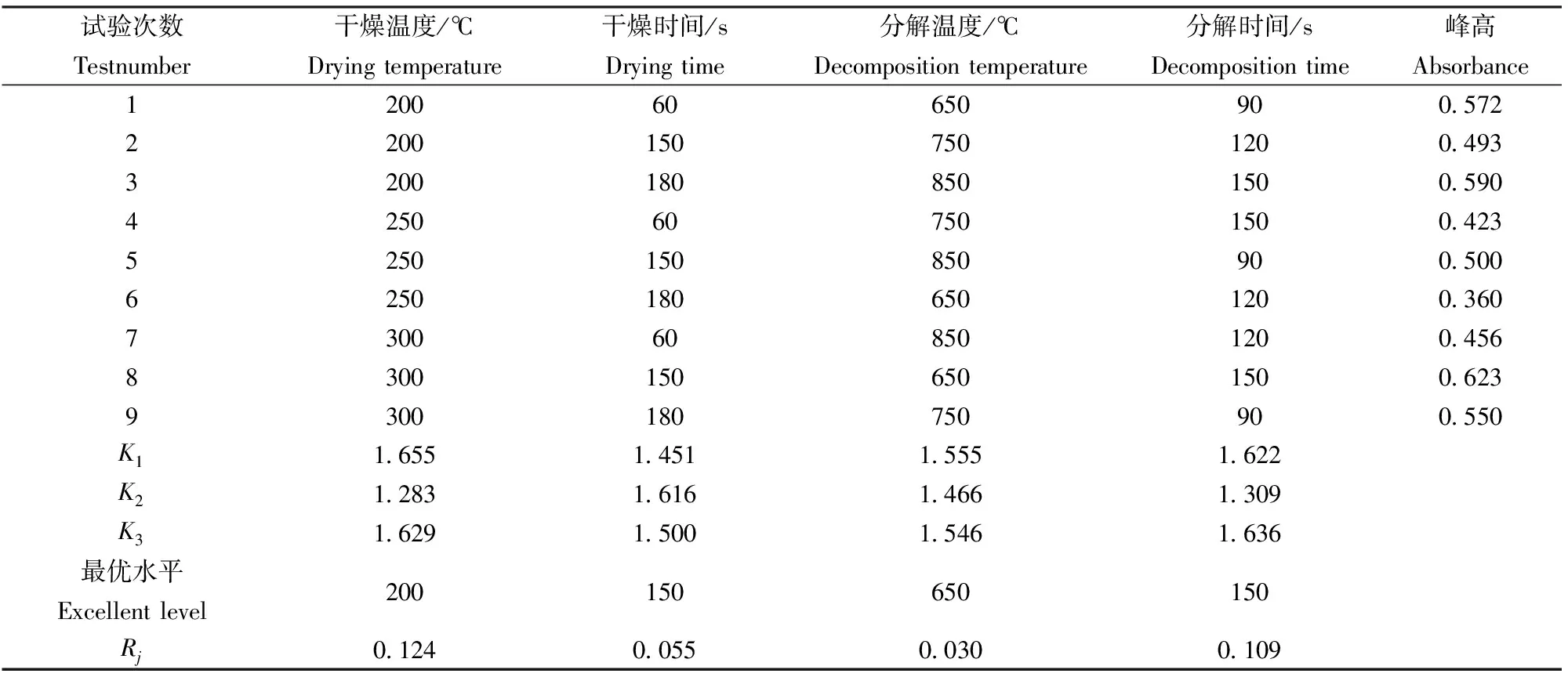
表2 正交实验测定结果
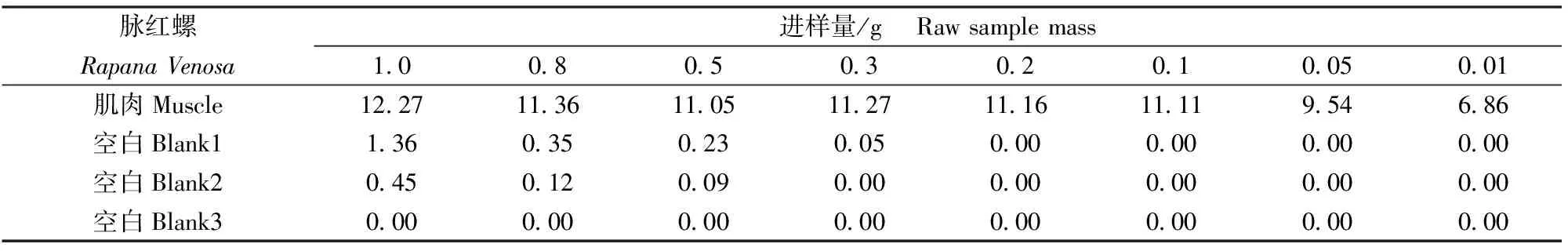
表3 最优进样量分析结果
2.3 标准工作曲线
准确移取1.0 mL汞标准溶液(1 mg/mL)于100 mL容量瓶中,用盐酸(5%)溶液定容至100 mL制备成汞的标准中间溶液(10 μg/mL)。准确移取10.0 mL汞的标准中间溶液于100 mL容量瓶中,用盐酸(5%)溶液定容至100 mL制备成汞的标准使用溶液(1.0 μg/mL)。分别吸取一定量汞标准(1.0 μg/mL)使用溶液,配制成0、1.0、2.5、5.0、10.0、20.0 ng低含量(c)系列和0、30.0、40.0、50.0、100.0、200.0、500.0、1 400.0 ng高含量(c)系列,在最优分析程序下分别测定两个标准系列,低含量系列标准曲线见图1,高含量系列标准曲线见图2,在0~20.0 ng和20.0~1 400.0 ng范围内均呈良好的二次拟合,R2=1.000。由11次空白测试结果得:S=0.000 24,3S=0.000 72,检出限(DL)=0.02 ng。
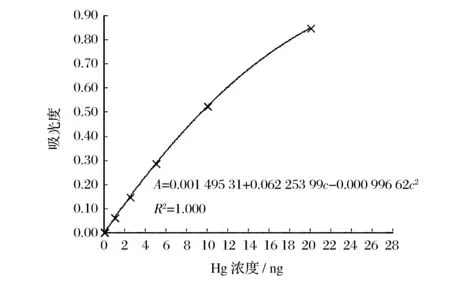
图1 低含量系列标准曲线Figure 1 Calibration curve of low-concent series of Hg.
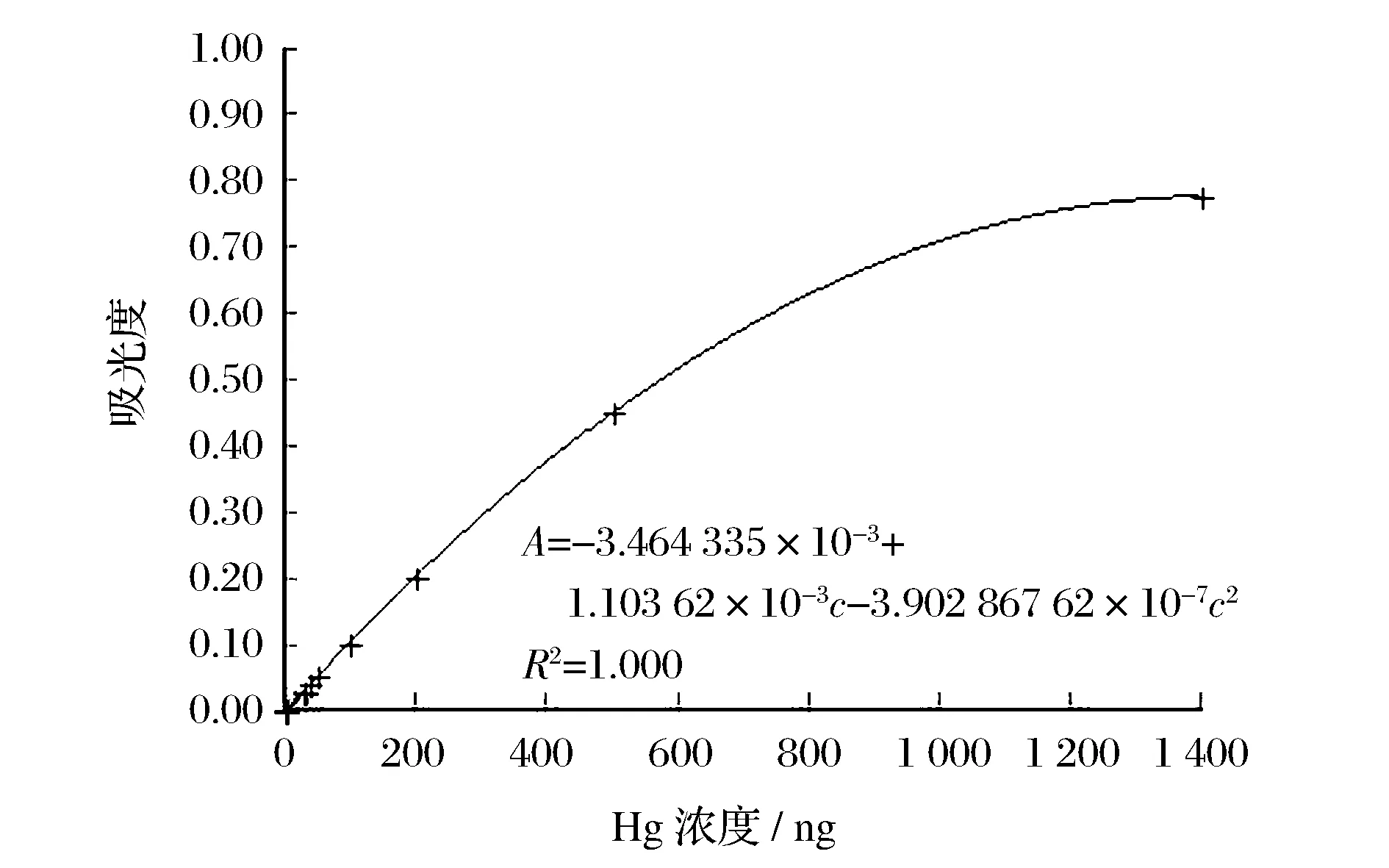
图2 高含量系列标准曲线Figure 2 Calibration curve of high-concent series of Hg.
2.4 方法的准确度和精密度
采用国际标准物质贻贝组织(NIST SRM 2976)重复测定7次来判定方法的准确度和精密度,按照优化后的分析程序进行测试,标准物质的标准值和测定值见表4。分析结果表明:加标回收率为95.1%~102%,相对标准偏差RSD为1.6%~2.2%,精密度和准确度优于“HY/T147.3—2013”[13],表明方法的准确度高,精密度好。
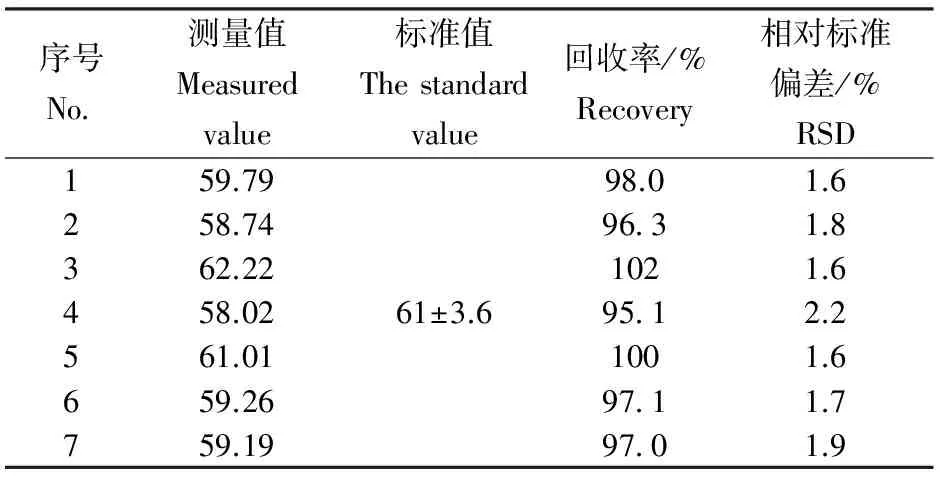
表4 方法的准确度和精密度
2.5 质量控制图

图3 质量控制图Figure 3 Quality control charts.
2.6 实际样品分析
为了验证所建方法的实用性,随机选取辽东湾海域7个脉红螺样品(样品A、B、C、D、E、F、G)的肌肉和内脏组织,采用所建方法,将每个样品的肌肉和内脏分别重复测定11次,7个样品的分析结果见表5。结果表明,Hg在脉红螺体内分布存在组织差异性,在内脏中积累程度高于肌肉。
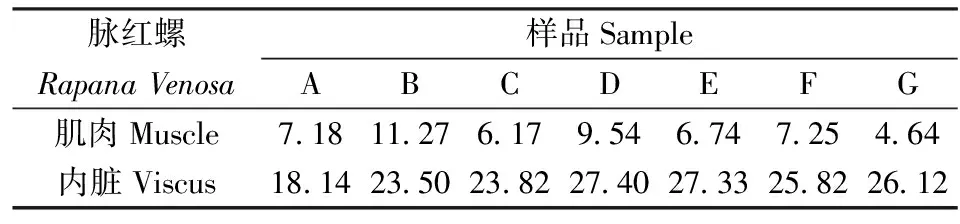
表5 样品分析结果
3 结语
通过正交实验确定了DMA-80直接测汞仪测量脉红螺中痕量汞的最优分析程序:干燥温度、干燥时间、分解温度、分解时间、齐化时间、氧气流量分别为200 ℃、150 s、650 ℃、150 s、12 s、200 mL/min;通过设置进样量梯度实验,确定了进样量最佳范围为0.1~0.2 g;RSD在1.6%~2.2%,精密度和准确度优于海洋行业标准“HY/T147.3—2013”;通过测定实际样品发现测试效果极佳。该方法有效改善了方法精密度和准确度,操作简单,检测速度快,易于批量检测,建立了脉红螺中痕量汞的最优分析方法。
[1] Ribeiro R F L, Germano A.Development and validation of a method for the determination of Hg in animal tissues (equine muscle, bovine kidney and swine kidney, and poultry muscle) by direct mercury analysis (DMA)[J]. Microchemical Journal, 2015(121):237-243.
[2] Counter S A, Buchanan L H. Mercury exposure in children: a review[J]. Toxicology and Applied Pharmacology, 2004, 198(2): 209-230.
[3] Rooney J P K. The role of thiols, dithiols, nutritional factors and interacting ligands in the toxicology of mercury[J]. Toxicology, 2007, 234 (3):145-156.
[4] 刘伟成, 单乐州, 谢起浪, 等. 生物监测在水环境污染监测中的应用[J]. 环境与健康杂志(JournalofEnvironmentandHealth), 2008, 25(5): 456-459.
[5] Wang Y W, Liang L N, Shi J B, et al. Chemometrics methods for the investigation of methylmercury and total mercury contamination in mollusks samples collected from coastal sites along the Chinese Bohai Sea[J]. Environmental Pollution, 2005(135): 457-467.
[6] 蔡慧华, 彭速标. 痕量汞的测定方法进展[J]. 理化检验:化学分册(PhysicalandChemicalTesting:ChemicalAnalysis), 2008, 44(4):385-389.
[7] 周宇, 贾宏新, 郑凤娥,等.测汞仪直接测定食品中总汞[J].中国无机分析化学(ChineseJournalofInorganicAnalyticalChemistry), 2015, 5(3):5-7.
[8] 乐淑葵, 段永梅.电感耦合等离子体质谱法(ICP-MS)测定土壤中的重金属元素[J].中国无机分析化学(ChineseJournalofInorganicAnalyticalChemistry), 2015, 5(3):16-19.
[9] 张世仙, 魏士倩, 余永华. 双道原子荧光光谱法测定蔬菜中的砷和汞[J].中国无机分析化学(ChineseJournalofInorganicAnalyticalChemistry), 2015, 5(1):4-6.
[10] Cizdziel J V, Tolbert Candice, Brown G. Direct analysis of environmental and biological samples for total mercury with comparison of sequential atomic absorption and fluorescence measurements from a single combustion event[J]. Spectrochimica:Acta Part B, 2010(65):176-180.
[11] Vieira H P, Nascentes C C, Windmoller C C. Development and comparison of two analytical methods to quantify the mercury content in honey[J]. Jourmal of Food Composition and Analysis, 2014(34):1-6.
[12] Ferreira S L C, Lemos V A, Silva L O B, et al. Analytical strategies of sample preparation for the determination of mercury in food matrices — A review[J]. Microchemical Journal, 2015(121): 227-236.
[13] 国家海洋局. HY/T147.3-2013 海洋监测技术规程第3部分:生物体[S]. 北京:中国标准出版社,2013.
[14] 张妮娜, 王小艳,刘丽萍, 等. 直接测汞仪法快速测定婴幼儿配方乳粉中汞[J]. 卫生研究(JournalofHygieneResearch), 2015, 44(1):129-131.
[15] 程妍,刘俊娓,倪霞. DMA80直接测汞仪法测定碘伏中的汞[J]. 疾病预防控制通报(BulletinofDiseaseControlandPrevention(China)), 2015, 30(3):77-78.
[16] 于趁, 剧京亚,姚春毅. DMA-80直接测汞仪测定四种中药中汞含量[J]. 食品安全质量检测学报(JournalofFoodSafetyandQuality), 2013, 4(5):1517-1520.
[17] 李建新, 李明华,袁金华, 等. 测汞仪直接测定并评价鲫鱼组织中汞含量[J]. 中国卫生检验杂志(ChineseJournalofHealthLadoratoryTechnology), 2013, 23(1):70-72.
[18] 张红英, 王丽,曹丽玲, 等. DMA-80型直接测汞仪测定食品中汞[J]. 理化检验:化学分册(PhysicalandChemicalTesting:ChemicalAnalysis), 2008, 44(1):84-85.
Method Improvement on the Determination of Hg inRapanaVenosa
SONG Yonggang1,2, YU Caifen1,2, ZHANG Yufeng1,2, DU Jing1,2SUN Ming1,2, JIANG Bing1,2, SONG Lun1,2*,
(1.LiaoningOceanandFisheryScienceResearchInstitute,Dalian,Liaoning116023,China; 2.LiaoningOceanEnvironmentMonitoringStation,Dalian,Liaoning116023,China)
In order to obtain the optimal instrument conditions for the determination of total mercury inRapanaVenosasamples by a DMA-80 direct mercury analyzer, the experimental conditions, such as the drying temperature, the drying time, the decomposition temperature and the decomposition time, were optimized through orthogonal test, and the appropriate sample dosage was also investigated. The results showed that the optimal experimental conditions were obtained as follows: the drying temperature was 200 ℃, the drying time was 150 s, the decomposition temperature was 650 ℃, the decomposition time was 150 s, the amalgam heating time was 12 s,the oxygenow was 200 mL/min, and the sample mass was 0.1~0.2 g. There were both good quadratic nonlinear relationships when the contents of samples were both in the ranges of 0~20.0 ng and 20.0~1 400.0 ng, and the correlation coefficient wasR=1.000.The detection limit was 0.02 ng. The method was validated by the analysis of the certified reference materials of Mussel Tissue (NIST SRM 2976, USA), and the results indicated that the recovery was in the range of 95.1%~102% with 1.6%~2.2% RSD. Accuracy and precision of the method was better than those obtained by marine industry standard (HY/T147.3—2013), which indicated that the proposed method has the advantages of good accuracy, simple operation and high sensitivity for the determination of total mercury inRapanaVenosasamples.
mercury;a direct mercury analyzer;optimization;orthogonal test;RapanaVenosa
10.3969/j.issn.2095-1035.2016.01.001
2015-11-09
2015-12-01
国家自然科学基金项目(31400406);海洋公益性行业科研专项(201505019);辽宁省自然科学基金项目(2014020182)资助
宋永刚,男,助理研究员,主要从事海洋环境研究。E-mail:hyzjs_lnshky@163.com
*通信作者:宋伦,男,副研究员,主要从事海洋生态环境研究。E-mail:songlun827421@sohu.com
O657.3;TH744
A
2095-1035(2016)01-0001-05

