西黄丸对乳腺荷瘤小鼠外周血和肿瘤组织VEGF、MMP9表达的影响
任征远, 马 杰, 王一尧, 焦 战, 曾常茜, 高文斌, 梁文波*
(1.大连大学医学院,辽宁大连116622;2湖北医药学院,湖北十堰442000;3大连大学附属中山医院,辽宁大连116000)
西黄丸对乳腺荷瘤小鼠外周血和肿瘤组织VEGF、MMP9表达的影响
任征远1, 马 杰2, 王一尧1, 焦 战1, 曾常茜1, 高文斌3, 梁文波1*
(1.大连大学医学院,辽宁大连116622;2湖北医药学院,湖北十堰442000;3大连大学附属中山医院,辽宁大连116000)
摘要:目的 通过检测西黄丸对乳腺荷瘤小鼠外周血和肿瘤组织中血管内皮生长因子(VEGF)、基质金属蛋白酶9 (MMP9)表达的影响,探讨西黄丸对形成肿瘤微环境炎性相关因子调控作用。方法小鼠随机分为6组建立荷瘤小鼠模型。药物治疗14 d后,取外周血,取瘤称重,计算抑瘤率;用蛋白质免疫印迹和酶联免疫法分别检测乳腺荷瘤小鼠肿瘤组织和外周血中血管内皮生长因子、基质金属蛋白酶9表达水平。结果 西黄丸高剂量组抑瘤率31.49%;西黄丸各组在外周血、肿瘤组织中血管内皮生长因子、金属基质蛋白酶9表达量均低于模型对照组,其中西黄丸高剂量组与模型对照组相比较作用明显(P<0.05)。结论 西黄丸能够抑制乳腺荷瘤小鼠炎性相关因子的表达,改变肿瘤微环境,具有逆转免疫逃逸的趋势。
关键词:西黄丸;炎性相关因子;血管内皮生长因子;金属基质蛋白酶9
dol:10.3969/j.issn.1001-1528.2016.02.047
西黄丸作为抗肿瘤的中成药已流传几百年,临床主要用于各种癌症的治疗及辅助治疗,改善中晚期癌症患者的临床症状,提高生活质量。本课题组前期研究表明西黄丸可通过调节荷瘤鼠机体免疫及炎性相关因子TGF-β(转化生长因子-β)、IFN-γ(干扰素-γ)、IL-2(白介素-2)、IL-6(白介素-6)、IL-8(白介素-8)等的表达提高机体免疫功能,发挥抗肿瘤的作用[1-2],但对其调节肿瘤微环境相关炎症因子VEGF、MMP9以及对肿瘤炎性微环境的作用尚未系统研究。本研究采用体内动物实验方法,结合肿瘤免疫编辑理论,探讨西黄丸对形成肿瘤微环境中炎性相关因子调控作用,以及改善肿瘤微环境和逆转免疫逃逸作用的机制。
1 材料与方法
1.1 细胞与动物 小鼠乳腺癌细胞株(4T1)源自中国科学院细胞库。清洁级雌性BALB/C小鼠,体质量18~22 g,60只,均购自大连医科大学动物实验中心,合格证号: SCKK(辽)2008-0002。
1.2 主要仪器 酶标仪ELX800产自于美国BioTek公司;美国Bio-Rid生产的基础电泳仪、电泳槽、转膜槽;美国Biorad chemidoc xRS +核酸蛋白分子凝胶成像系统。
1.3 主要试剂 上海朗顿生物技术有限公司生产的ELISA (VEGF、MMP9)试剂盒;ANTI-VEGF antibody ab9570、ANTI-MMP9 antibody ab38898购于上海艾博抗贸易有限公司,辣根酶标记山羊抗兔1gG购自北京中杉金桥生物技术有限公司。
1.4 试验药物 北京同仁堂制药厂所制的西黄丸,每瓶含有量3 g,每20粒质量为1 g,批准文号:国药准字Z1040991。由浙江普洛康裕天然药物有限公司生产的每片含有量0.1 g香菇多糖片,批准文号:国药准字Z120501。依据人鼠剂量换算公式(参考徐叔云教授主编的《药理实验方法学》: db=da×(rb/ra)×(wa-3/w-3b),其中a为人,b为鼠,d为人的给药剂量,r为鼠的表面积参数,w为体质量;运用剂量公式要求给药剂量分别为正常剂量的2倍、5倍)求得西黄丸正常剂量、2倍剂量、5倍剂量分别为0.39、0.78、1.95 g/kg;香菇多糖为0.045 g/kg;依次称取西黄丸0.98、1.95、4.88 g;香菇多糖片0.23 g,碾碎,分别加入蒸馏水,使其充分溶解,定容至28 mL,4℃保存备用。
1.5 模型建立与分组给药 小鼠乳腺癌细胞株(4T1)经培养和胰蛋白酶消化处理后,收集细胞。将细胞用PBS调整为2×106/mL待用。随机分成6组的60只BALB/c小鼠,抽取1组作为正常组,不作处理;其余小鼠右腋下碘伏消毒,抽取上述细胞0.1 mL(2×105个)分别接种于其他小鼠右腋内侧皮下,完成荷瘤小鼠模型的建立。自建模后的第2日开始,按照每天2次,每10 g体质量0.2 m L,连续灌胃给药14 d。模型对照组和正常组给予等体积的蒸馏水。
1.6 小鼠抑瘤率的测定 末次给药后小鼠禁食12 h,小鼠眼球取血后断颈处死,钝性剥离瘤组织,取瘤称质量,计算肿瘤抑瘤率。肿瘤抑瘤率(%)=(模型对照组平均瘤质量-治疗后平均瘤质量)/模型对照组平均瘤质量×100%。
1.7 酶联免疫(ELISA)法检测乳腺癌荷瘤小鼠外周血中VEGF、MMMP9表达水平 取小鼠血液0.5 mL置放于37℃水浴箱中水浴充分收缩后,分离血清,采用ELISA法检测各组小鼠血清中VEGF、MMP9的水平,依照试剂盒说明书的实验步骤进行操作。用酶标仪在波长450 nm处测定D(光密度)值,随后绘制标准曲线,依据VEGF和MMP9的量计算结果进行数据分析。
1.8 蛋白质免疫印迹(Western b1ot)法检测乳腺荷瘤小鼠肿瘤组织中VEGF、MMP9表达水平 取20 mg肿瘤组织在液氮中粉碎,RIPA裂解液裂解蛋白提取上清液;各样本取20 μL上清液做蛋白定量分析比较;80 μg样品蛋白聚丙烯酰胺凝胶电泳(5%浓缩胶80 V,10%分离胶150 V);300 mA分别转膜45 min(VEGF)、95 min(MMP9);TBST漂洗3次,每次10 min,转膜后的聚偏氟乙烯(PVDF)膜用TBST溶解的10%牛血清蛋白封闭过夜;PVDF膜用TBST漂洗3次,每次10 min,TBST溶解的5%牛血清蛋白分别与一抗(1 000: 1 MMP9、2 500: 1 VEGF)孵育2 h或过夜;PVDF膜用TBST漂洗3次,每次10 min,TBST与羊抗兔二抗5 000: 1孵育二抗2 h,漂洗3次,每次10 min,PVDF膜ECL染色,Biorad chemidoc xRS +核酸蛋白分子凝胶成像系统显像曝光,用ImageJ软件对Western b1ot的结果图像进行处理,计算各样本的灰度值。
2 结果
2.1 西黄丸对乳腺荷瘤小鼠肿瘤生长的作用 西黄丸对乳腺荷瘤小鼠的肿瘤具有明显抑制作用,其中高剂量组抑瘤率31.49%,模型对照组与高剂量组平均瘤重的组间差异具有统计学意义(P<0.05)。见表1。
表1 西黄丸对不同剂量乳腺荷瘤小鼠肿瘤生长的作用(±s,n=10)
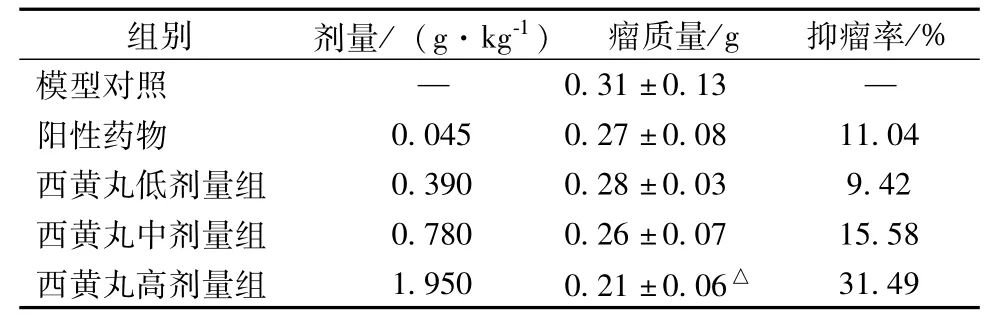
表1 西黄丸对不同剂量乳腺荷瘤小鼠肿瘤生长的作用(±s,n=10)
注:与模型对照组比较,△P<0.05
组别 剂量/(g·kg-1) 瘤质量/g 抑瘤率/%模型对照 — 0.31±0.13 —阳性药物 0.045 0.27±0.08 11.04西黄丸低剂量组 0.390 0.28±0.03 9.42西黄丸中剂量组 0.780 0.26±0.07 15.58西黄丸高剂量组 1.950 0.21±0.06△31.49
2.2 西黄丸对乳腺荷瘤小鼠外周血VEGF、MMP9表达量的作用 在乳腺荷瘤小鼠外周血中VEGF、MMP9表达上,西黄丸各剂量组含有量均低于模型对照组。在外周血中VEGF表达量上西黄丸各剂量组与模型对照组比较,差异均有统计学意义(P<0.05);其中正常对照组与西黄丸高剂量组比较,差异无统计学意义(P>0.05),阳性药物
(香菇多糖)组与西黄丸高剂量组比较,差异有统计学意义(P<0.05)。西黄丸高剂量组与模型对照组比较,外周血中MMP9表达量的差异有统计学意义(P<0.05)。见表2。
表2 西黄丸对乳腺荷瘤小鼠外周血中V EGF、MMP 9表达量的作用(±s,n=10)

表2 西黄丸对乳腺荷瘤小鼠外周血中V EGF、MMP 9表达量的作用(±s,n=10)
注:与模型对照组比较,△P<0.05;与阳性药物组比较,*P<0.05
组别 剂量/ (g·kg-1)VEGF/ (ng·L-1)MMP9/ (ng·L-1)正常对照 — 269±50.1△ 301±63.3模型对照 — 405±32.8 394±69.9阳性药物 0.045 345±55.3△ 319±89.7西黄丸低剂量组 0.390 339±29.4△ 353±33.9西黄丸中剂量组 0.780 334±20.1△ 321±28.5西黄丸高剂量组 1.950 290±64.1△* 311±32.6△
2.3 西黄丸对荷瘤小鼠肿瘤组织中VEGF、MMP9表达影响 从实验结果看,西黄丸高、中、低剂量组在小鼠肿瘤组织中的MMP9和VEGF表达量上,明显低于模型对照组。模型对照组与西黄丸各剂量组比较,差异均有统计学意义(P<0.01,P<0.05),阳性药物组明显高于西黄丸中、高剂量组,差异有统计学意义(P<0.05),而西黄丸低剂量组和阳性药物组之间及西黄丸高剂量组与中剂量组之间,差异无统计学意义。见图1和表3。

注: 1.模型对照组;2.阳性药物;3.西黄丸低剂量组;4.西黄丸中剂量组;5.西量黄丸高剂量组图1 We r s t e r nb l o t检测
表3 西黄丸对荷瘤小鼠肿瘤组织VEGF、MMP 9灰度值的影响(±s,n=10)

表3 西黄丸对荷瘤小鼠肿瘤组织VEGF、MMP 9灰度值的影响(±s,n=10)
注:与模型对照组比较,△P<0.05,△△P<0.01;与阳性药物组比较,*P<0.05
组别 VEGF MMP9模型对照 36 176±5 813 28 198±5 316阳性药物 23 764±5 719△ 19 753±5 458△西黄丸低剂量组 22 673±5 345△ 20 742±5 743△西黄丸中剂量组 15 993±4 700△△* 11 471±5 083△△*西黄丸高剂量组 10 282±5 108△△* 8 975±5 216△△*
3 讨论
西黄丸是由麝香、牛黄、没药(醋制)、乳香(醋制)4味名贵中药组成,有着清热解毒、合营消肿的药性,现今临床上对于癌症的治疗和辅助治疗应用广泛,其具有抗肿瘤,减少放化疗的毒副作用,改善微循环,提高免疫力,镇痛消炎等功效。研究表明牛黄能促进巨噬细胞功能,提高机体免疫力,有助于控制肿瘤发展[3]。麝香具有较强的抗炎,镇痛作用,能够抑制荷瘤小鼠肿瘤生长延长生存期,具有一定的免疫调节作用[4];麝香酮有抗肿瘤新生血管形成的作用[5]。体外实验表明乳香挥发油对多种肿瘤细胞的生长有抑制作用。没药的各种剂型都有良好的化瘀消肿作用[6]。
免疫编辑理论认为肿瘤的发生发展一方面取决于肿瘤细胞本身,还取决于肿瘤细胞所处的微环境,生存的土壤[7]。肿瘤微环境是正常组织和相邻肿瘤细胞之间的部位,其组成包括肿瘤基质细胞,可溶性分子和细胞外基质[8]。肿瘤起始细胞赖以生长的支架和屏障由肿瘤微环境构建[9]。在肿瘤微环境中,由于缺氧和炎症,间质细胞会被肿瘤细胞转化,产生大量的炎性相关因子、生长因子、基质降解酶、及细胞趋化因子,包括IL-6、TGF-β、IL-10、MMP9、COX-2(环氧化酶-2)、VEGF等,通过孕育肿瘤干细胞、诱生新生血管和抑制免疫反应等方式促进肿瘤发展。IL-6、IL-10、TGF-β等抑制性炎性因子,可诱导产生抑制性T细胞等一系列抑制性细胞,在肿瘤周围形成一免疫抑制的又是炎症的微环境[10]。免疫抑制的炎性微环境的形成,会造成机体内肿瘤识别细胞及杀伤细胞的功能降低或无能,炎症的微环境促进炎症抑制性因子产生,进而加重免疫抑制。研究证明在炎症和免疫抑制因子作用下,MMP9它以酶原的形式分泌,被激活后,形成Ⅳ胶原酶,破坏、降解靠近肿瘤表面的细胞外基质中的V型、Ⅳ型胶原和明胶。然后肿瘤细胞在缺失的基底膜的基础上向周围组织浸润,最终导致肿瘤的侵袭和转移[11]。同样在炎症和缺氧的微环境下,VEGF通过促进内皮细胞和基质细胞的转移,抑制内皮细胞的凋亡,在肿瘤血管新生中起重要作用,同时能够诱导促进淋巴管的形成。肿瘤血管生成主要需要内皮移行增殖和内皮移行通道形成,内皮移行增殖主要是由VEGF因子参与执行。内皮移行通道形成主要由基质金属蛋白酶(MMPs)介导,MMP9参与水解血管与肿瘤之间基质,为内皮细胞移行打下基础。有研究表明,由原发肿瘤细胞分泌的血管内皮生长因子VEGF在内皮细胞和巨噬细胞诱导特殊MMP9表达,后者通过VEGF受体酪氨酸激酶导致肿瘤新干细胞形成[12]。肿瘤的转移和免疫抑制都与肿瘤周围的炎症和缺氧微环境密切相关,对这些炎性相关因子的调节,不是单纯由宿主的相关细胞或者肿瘤细胞进行简单的调节,而是由机体的TAM(肿瘤相关巨噬细胞)、DC(树突细胞)、Treg(调节性T细胞)、MDSC(髓源抑制性细胞)等和肿瘤细胞、肿瘤干细胞和被肿瘤细胞转化的机体细胞等共同参与的非常复杂的调节过程,同时炎性因子与这些细胞之间通过复杂的正反馈和负反馈的关系相互影响。肿瘤微环境中缺氧和过激的炎症反应引起TAM、DC功能转变和MDSC、Treg高表达和趋化,以及肿瘤细胞和肿瘤干细胞活性增强,使抑制性因子大量产生,最终导致肿瘤免疫抑制和逃逸。
杨伟[1]等研究西黄丸对乳腺癌荷瘤大鼠IL-6、TGF-β、IL-10的调节作用,证明西黄丸明显降低乳腺癌荷瘤大鼠机体内抑制性因子IL-6、IL-10、TGF-β的表达水平,同时提高IL-2和IFN-γ表达。本试验结果显示,西黄丸可以明显降低VEGF、MMP9在乳腺癌荷瘤小鼠的外周血及肿瘤组织内的表达水平,表明西黄丸能够减少肿瘤微环境中相关的炎性因子,进而能够弱化或逆转肿瘤微环境的免疫抑制,提高乳腺癌荷瘤小鼠机体的抗肿瘤的免疫功能,起到抑瘤,降低肿瘤免疫逃逸的作用。其作用机制可能是西黄丸通过抗血小板聚集和抗凝血酶活性及降低纤维蛋白原水平,改善微循环的高凝状态促进血液流动,同时微循环血管开放数量增加提高了携氧能力,并增加了对组织的氧气释放量和加快酸性物质例如乳酸的排放,降低炎性组织内前列腺素E2(PGE2)水平,影响花生四烯酸代谢,降低白三烯等炎性物质生成,抑制中性粒细胞的炎性物质释放;抑制NO产生和过氧化,抑制溶酶体的释放酶;抑制炎性组织过氧化作用[13-18],从而阻断肿瘤组织微环境的缺氧反应机制,逆转肿瘤组织的缺氧和抑制肿瘤微环境的过激炎症反应。肿瘤组织微环境的缺氧及过激炎症反应的改变和西黄丸通过其他未明的调节方式,使TAM、DC等免疫细胞的功能恢复或向抑瘤方向转变;降低MDSC、Treg表达和趋化;以及西黄丸自身对肿瘤细胞的杀伤作用,同时提高细胞毒细胞、活性T细胞等肿瘤杀伤细胞活性,进而使IL-6、IL-10、TGF-β、MMP9、VEGF等因子表达明显降低,提高IL-2、IFN-γ因子表达水平,最终形成逆转肿瘤免疫逃逸的趋势。
参考文献:
[1] 杨 伟,关 硕,胡俊霞,等.西黄丸对荷瘤大鼠的抗肿瘤及炎性因子的调节作用[J].现代药物与临床,2013,28(6): 847-850.
[2] 马 杰,关 硕,杨 伟,等.西黄丸对荷瘤大鼠免疫功能的影响[J].中药药理与临床,2013,29(4): 24-26.
[3] 李羚青,赵映前.牛黄在肝癌治疗中的作用机理及研究进展[J].湖北中医杂志,2009,31(11): 77-78.
[4] 孙 蓉,杨 倩,尹建伟,等.麝香及替代品药理作用和含量测定方法研究进展[J].时珍国医国药,2011,22 (3): 709-712.
[5] 郭少贤,刘永惠,常 婧,等.麝香酮干预血瘀证乳腺癌组织血管生成相关因子表达研究[J].河北中医药学报,2011,26(2): 40-41.
[6] 赵金凤,周春兰,韩 陆,等.没药研究进展[J].中国药房,2011,22(7): 661-665.
[7] 薛 娜,林洪生.免疫编辑理论与中医药抗肿瘤免疫[J].中医杂志,2012,53(21): 1801-1803.
[8] 黄 波.肿瘤微环境中免疫与炎症的调节[J].中国肿瘤生物治疗杂志,2012,19(2): 111-115.
[9] Potter J D.MorPhogens,morPhostats,micmarchitecture and ma1ignancy[J].Nat Rev Cancer,2007,7(6): 464-474.
[10] Yaguchi T,Sumimoto H,Kudo-saito C,et al.The mechanisms of cancer immunoescaPe and deve1oPment of overcoming strategies[J].Int JHematol,2011,93(3): 294-300.
[11] Rahko E,Jukko1a A,Me1kko J,etal.Matrixmeta11oProteinase-9(MMP9)Protein has modest Prognostic va1ue in 1oca11y advanced breast carcinoma Patients treated with an adjuvant antiestrogen theraPy[J]. Anticancer Res,2004,24(6): 42-47.
[12] 谢晓民.肿瘤干细胞和低氧微环境与肿瘤转移的关系[J].解放军医药杂志,2011,23(4): 88-90.
[13] 李 累,贾彦焘.西黄丸对晚期大肠癌患者纤维蛋白原水平的影响[J].湖北中医杂志,2011,33(3): 15-16.
[14] 白山岭,赵映前.牛黄的药理作用及其用于抗肝损伤作用的研究进展[J].湖北中医杂志,2011,33(5): 65-66.
[15] 郝吉福,程 怡.麝香的药理学研究概况[J].时珍国医国药,2004,15(4): 248-249.
[16] 崔 锐,周金云.乳香化学和药理的研究进展[J].中国药学杂志,2003,38(6): 407-410.
[17] 沈 涛,娄红祥.没药的化学成分及其生物活性[J].天然产物研究与开发,2008,20(2): 360-366.
[18] 曹喜红,周远大.麝香抗炎作用的研究进展[J].中国药房,2007,18(21): 1662-1664.
*通信作者:梁文波(1962—),教授,博士,从事天然药物活性成分的分离鉴定和成分分析研究。Te1:(0411)87403409,E-mai1: d11-wb@126.com
作者简介:任征远(1974—),男,硕士生,从事临床肿瘤及肿瘤的中药治疗及机制研究。E-mai1: rzy4622@sohu.com
基金项目:大连金州新区科技计划(2012-A1-046)
收稿日期:2014-12-21
中图分类号:R285.5
文献标志码:B
文章编号:1001-1528(2016)02-0440-04

