2-乙酰基吡啶缩噻吩-2-甲酰腙的铜和镍配合物:水热合成、晶体结构及量化计算
解庆范 卢秀男 陈飞鹏 李颖 陈延民
(泉州师范学院化工与材料学院,泉州362000)
2-乙酰基吡啶缩噻吩-2-甲酰腙的铜和镍配合物:水热合成、晶体结构及量化计算
解庆范 卢秀男 陈飞鹏 李颖 陈延民*
(泉州师范学院化工与材料学院,泉州362000)
采用水热法制备了两种结构类似的金属配合物M(Ls)2(M=Cu(1),Ni(2)),其中HLs是2-乙酰基吡啶缩噻吩-2-甲酰腙Schiff碱。通过元素分析、红外光谱、紫外光谱和X射线单晶衍射对它们进行了表征,结构分析表明,Ls以烯醇式与金属配位形成畸变的八面体单核配合物,化合物的分子结构被分子间弱的相互作用所稳定。配合物1通过C-H…π作用形成二维层状结构,而配合物2则通过C-H…π作用和C-H…O与C-H…N类型氢键形成三维超分子网络。
Schiff碱;配合物;晶体结构;水热合成;量化计算
超分子化合物是基于分子间的非经典共价键相互作用(如次级键、配位键、分子识别、亲水/疏水作用以及π-π相互作用等)而形成的分子聚集体。在与生命科学、材料科学、信息科学等学科的交叉融合中,超分子化学逐步发展成了超分子科学,成为21世纪新概念和新技术的重要源头之一[1]。超分子配合物则已成为超分子化学的重要研究内容[2-3]。长期以来,酰腙类Schiff碱由于具有很强的配位能力、多样的配位方式和良好的杀菌、抗病毒、抗肿瘤等生物活性[4-7]以及光学性质[8-9]而备受关注。酰腙化合物主要分为2类,一类是酰肼与醛或酮的缩合物产物(包括羧酸酰腙和磺酸酰腙);另一类是氨基脲与醛或酮的缩合产物。其特点是次氨基与酰基和亚胺基存在p-π共轭作用,所以酰腙类化合物有很好的稳定性;如果对芳香醛或酮的结构进行适当修饰,则可得到[ONO]和[ONN]等多类型的多齿配体,从而进一步增强酰腙与金属螯合配位的能力[10-15]。本文采用的2-乙酰基吡啶缩噻吩-2-甲酰腙是一种酰腙类[ONN]三齿含硫Schiff碱(HLs,Scheme 1),尽管含硫类Schiff碱配合物的溶解度一般较小,单晶培养难度较大,但我们根据酰腙化合物稳定性好不易水解的特点,采用水热法成功地合成了2-乙酰基吡啶缩噻吩-2-甲酰腙的两种金属配合物M(Ls)2(M= Cu2+和Ni2+)。晶体结构分析表明,2个配合物通过CH…π作用、C-H…O和C-H…N氢键形成2种不同类型的超分子体系。本文同时采用密度泛涵理论(DFT)对铜配合物分子的自然电荷布居和键级进行了分析。
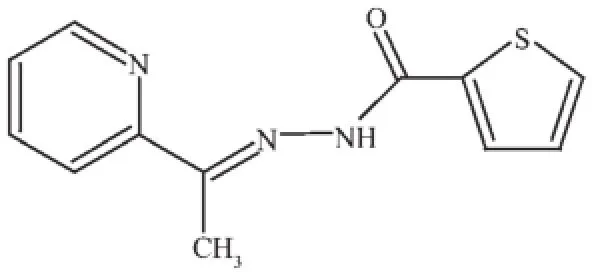
Scheme 1
1 实验部分
1.1 仪器与试剂
德国Elmentar Vario EL元素分析仪;美国Nicolet is10型FT-IR红外光谱仪;上海美普达UV-1800PC型紫外-可见分光光度计;德国塞驰STA 409 PC型综合热分析仪;美国Varian CARY/Eclipse型荧光分光光度计;德国Bruker Smart Apex CCD单晶衍射仪和日本理学Rigaku Saturn724 CCD单晶衍射仪。
2-乙酰基吡啶、噻吩-2-甲酰肼、乙酸铜、乙酸镍等均为市售分析纯试剂。
1.1 HLs的合成
将5 mmol噻吩-2-甲酰肼和5 mmol 2-乙酰基吡啶溶解于30 mL无水乙醇中,加入1 mL冰醋酸,于75℃下加热回流2 h,然后冷却至室温,抽滤,得到HLs的黄色粉末,产率约83%。化合物HLs微溶于甲醇,溶于DMF和DMSO。C12H11N3OS元素分析的实测值(理论值),%:C 58.69(58.76);H 4.46(4.52);N 17.16(17.12)。1H NMR(CDCl3):δ 12.03(s,1H,NH),8.85,8.03,7.97,7.64(m,4H,Py),7.27,6.69,6.48(m,3H,噻吩环),2.57(s,3H,CH3)。IR(KBr压片,cm-1):3 170m(NH);1 647(vs);1 621(vs);1 577(m),1 559(w),1 512(m),1 457(w),1 418(s);1 388(s),1 337(m);1 299 (s),1 224(m);994(w);857(m),785(m),740(s);717(s)。
1.2 配合物Cu(Ls)2(1)和Ni(Ls)2(2)的合成
将0.1 mmol乙酸铜或乙酸镍、0.2 mmol配体HLs、6 mL甲醇、2 mL水和0.4 mmol乙酸钠置于18 mL内衬聚四氟乙烯不锈钢自动升压反应釜,140℃反应2 d后得到1的绿色单晶和2的橙色单晶。
1的表征:对C24H20CuN6O2S2元素分析的实测值(理论值),%:C 52.18(52.21);H 3.59(3.65);N 15.25 (15.21)。IR(KBr压片,cm-1):1 597(m),1 560(w),1 526 (m),1 497(s),1 460(m),1 425(s),1 373(s),1 336(m),1 298(vs),1 257(w),1 159(s),1 118(s),1 031(m),879 (w),850(m),776(m),747(s),702(m)。
2的表征:对C24H20NiN6O2S2元素分析的实测值(理论值),%:C 52.63(52.57);H 3.75(3.68);N 15.30 (15.32)。IR(KBr压片,cm-1):1 597(m),1 563(w),1 527 (m),1 489(s),1 456(s),1 423(vs),1 371(s),1 337(m),1 299(s),1 257(w),1 221(w),1 150(s),1 118(s),1 031 (s),882(w),850m),776(m),747(s),703(m)。
1.3 晶体结构的测试
选取合适大小的单晶置于单晶衍射仪上,用经石墨单色器单色化的Mo Kα射线(λ=0.071 073 nm)以φ-ω扫描方式收集单晶衍射数据。衍射数据和晶胞参数用SAINT程序还原和精修,全部强度数据均经Lp因子校正,并进行了经验吸收校正。晶体结构由直接法解出,对全部非氢原子坐标及其各向异性热参数进行全矩阵最小二乘法修正,氢原子由理论加氢法得到,结构精修采用Olex2[16]程序包完成。晶体学数据详见表1。
CCDC:1404500,1;1062985,2。
2 结果与讨论
2.1 晶体结构
配合物1和2的主要键长和键角分别列于表2和3。晶体结构分析表明,1属正交晶系,Aba2空间群;2属单斜晶系,P21/c空间群。两种配合物分子具有相似的结构(图1),中心金属离子均为六配位,处于畸变的八面体配位环境。1中Cu-N和Cu-O键长为0.196 7(2)~0.218 4(3)nm,键角为75.87(10)°~172.41(19)°;而2中Ni-N和Ni-O键长为0.197 8(4)~0.210 4(4)nm,键角为77.13(13)°~177.98(14)°。与文献[17]的键长相似,酰腙配体同样以烯醇式配位,用吡啶基N、亚胺基N和羰基O与金属配位形成2个稳定的五元环。但是配合物2与文献[17]报导的铜配合物结构不同,后者因为异烟酰基片段吡啶N和乙酸根参与配位,形成四方锥配位多面体构型;而前者尽管金属盐选用的也是乙酸铜,但2-乙酰基吡啶缩噻吩-2-甲酰腙与铜形成的却是八面体配位多面体构型。
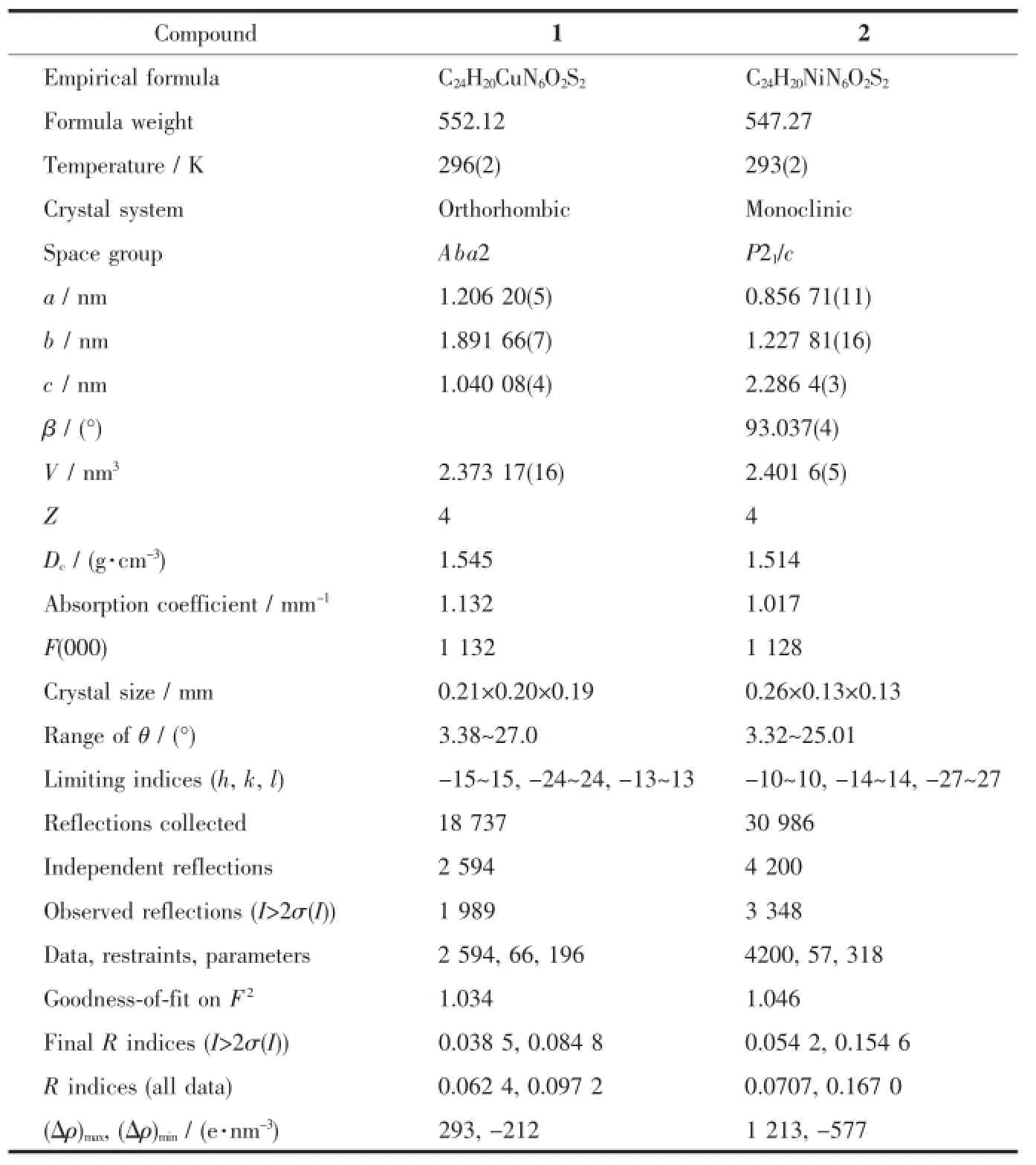
表1 化合物的晶体学数据Table 1Crystallographic data for the compounds
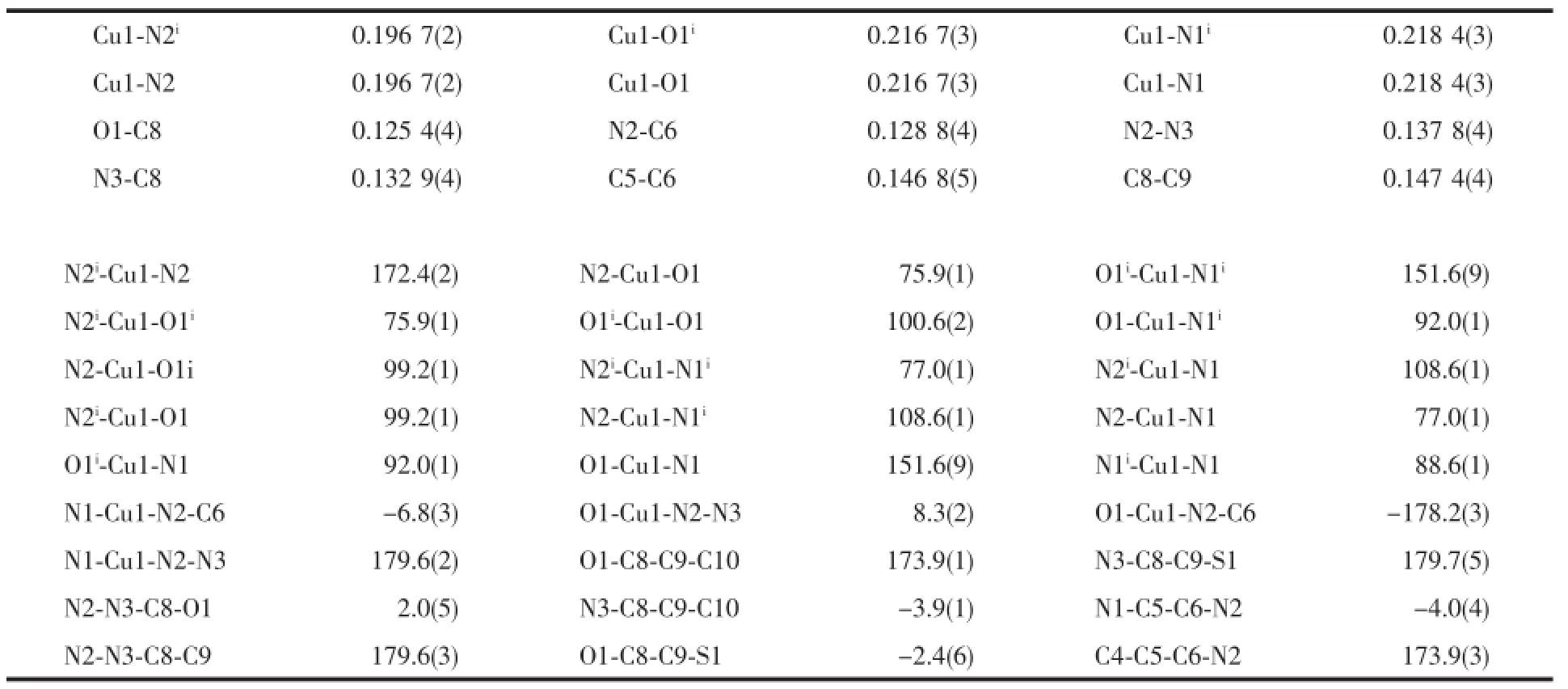
表2 配合物1的主要键长及键角Table 2Selected bond lengths(nm)and bond angles(°)for the complex 1
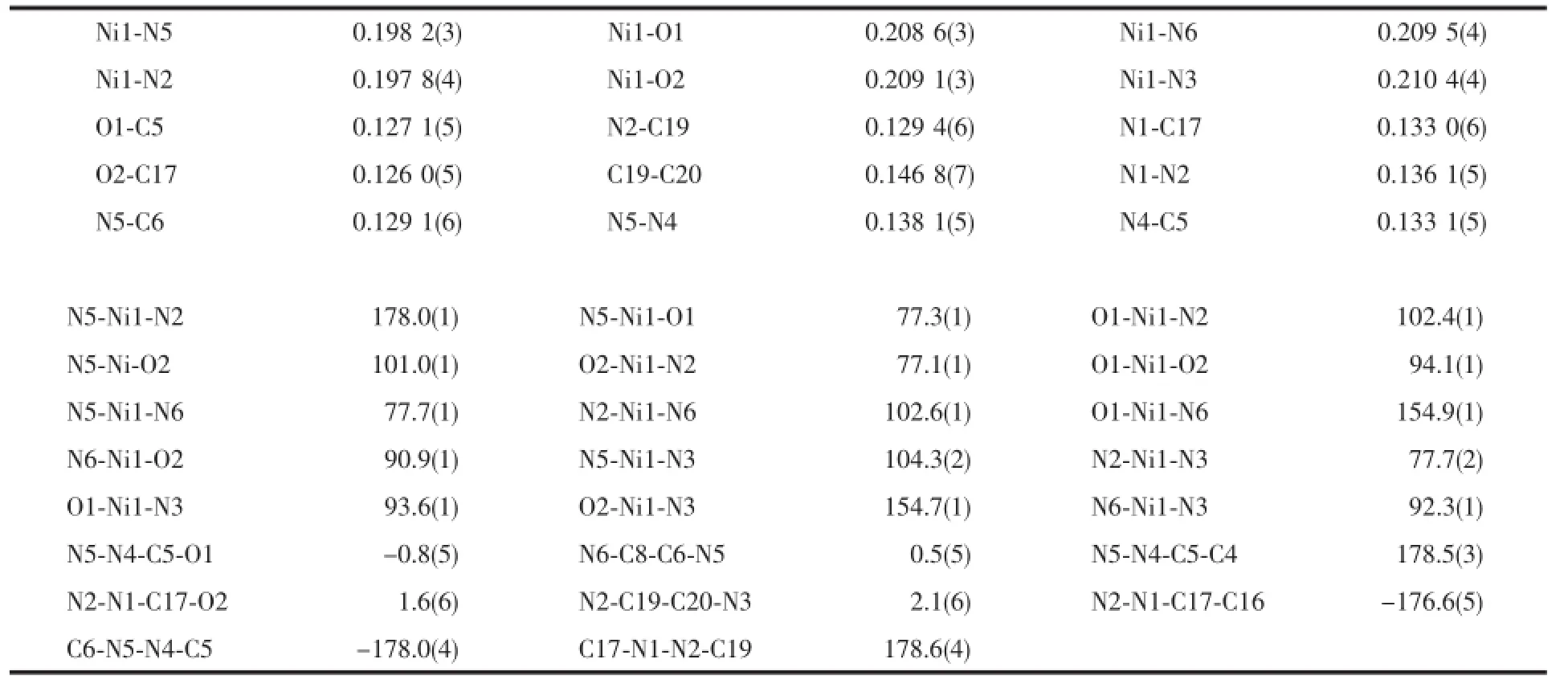
表3 配合物2的主要键长及键角Table 3Selected bond lengths(nm)and bond angles(°)for the complex 3
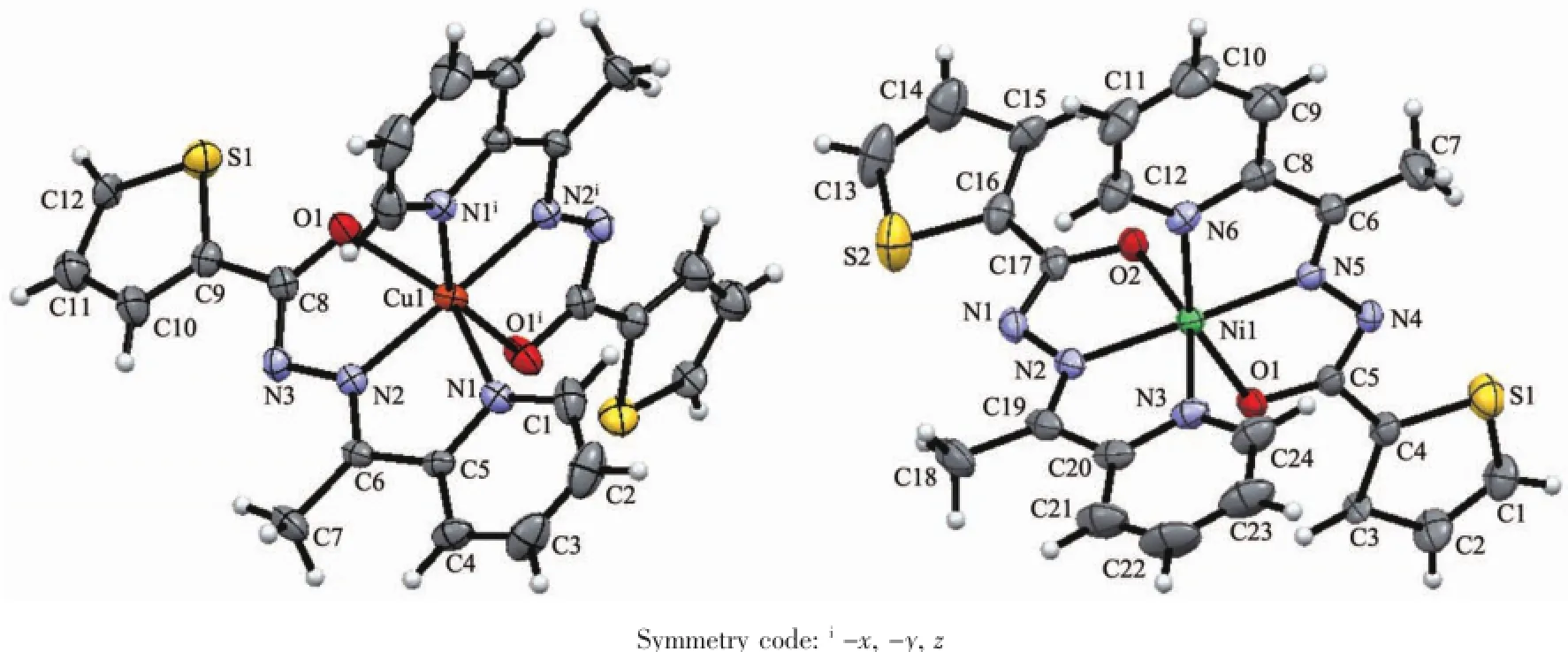
图1 化合物1和2的分子结构图(椭球率30%)Fig.1Molecular structure of 1 and 2 with 30%probability ellipsoids
在1中酰腙配体的所有非氢原子几乎共平面,噻吩环与吡啶环的二面角为7.0°;2个酰腙配体接近垂直,二面角为85.5°。在2中2个酰腙的噻吩环与吡啶环的二面角分别为5.4和13.8°,2个酰腙配体分子二面角为86.5°。
分子间弱的相互作用对晶体的稳定化和超分子的构建挥发着重要作用。在1中甲基与相邻分子的吡啶环之间的C-H…π作用将配合物连接为一种平行于ac面的二维超分子化合物(图2)。而在2中则存在着更丰富的分子间作用。首先,可以观察到配合物结构基元借助噻吩环与吡啶环间双重C-H…π作用(C14-H14…Cg1ii0.327 9 nm;Cg1:C8C9C10C11C12N6)形成二聚体;而“二聚体”进一步通过吡啶环(C11-H11)与酰胺基N1之间双重CH…N氢键(C11-H11…N1i:0.271 5(4)nm)连接成二维网络结构(图3)。同时,“二聚体”之间还可观察到甲基(C18-H18B)与羰基O1构成的双重C-H…O氢键(C18-H18B…O1iii0.252 4 nm),呈现一种C-H…π和C-H…O交替作用的一维链(图4a)。另外,羰基O2与噻吩环(C1-H1A)之间也存在着C-H…O类型氢键(C1-H1A…O2iv0.251 4 nm),在这种氢键作用下配合物结构基元呈现一种一维螺旋链结构(图4b)。正是这些C-H…O作用进一步将前述二维网络扩展为三维超分子网络。
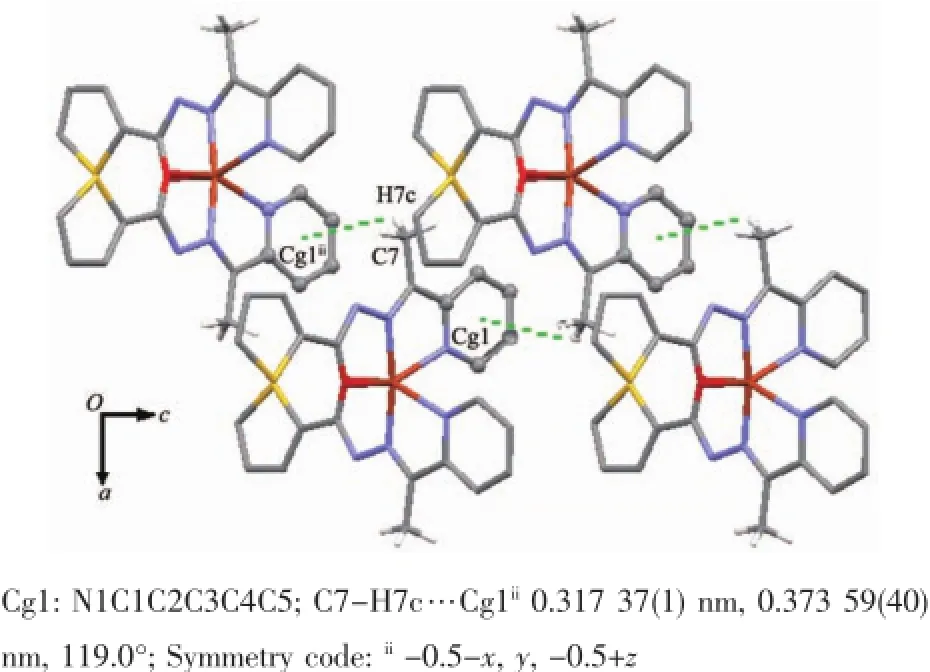
图2 晶体1中的C-H…π作用Fig.2C-H…π interaction in crystal of 1
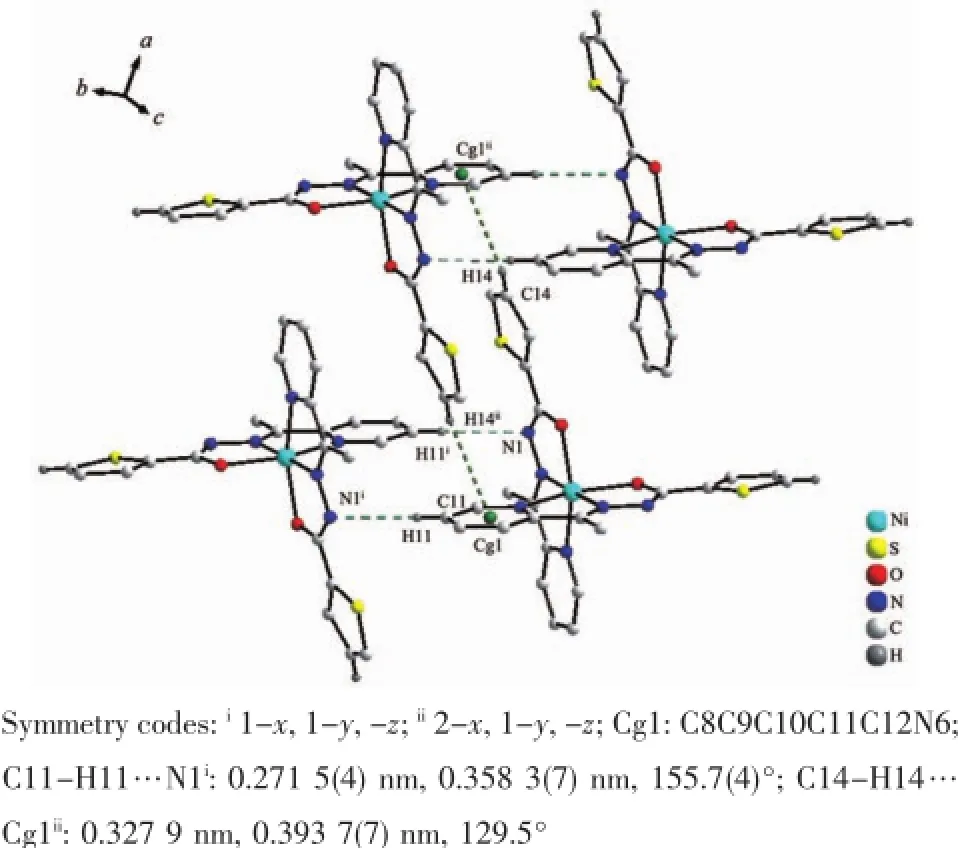
图3 C-H…N和C-H…π作用构筑的2的二维层结构Fig.32D layered structure of 2 formed through C-H…N and C-H…π interactions
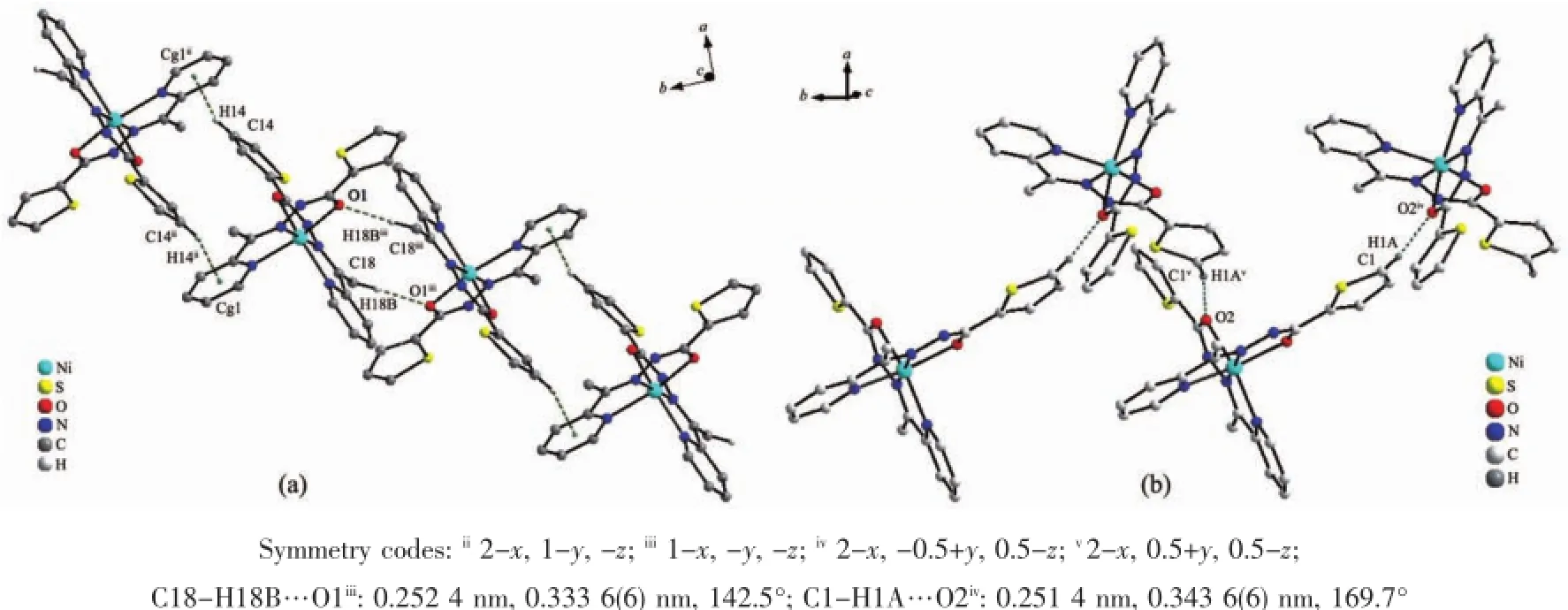
图4 晶体2中的C-H…O氢键Fig.4C-H…O hydrogen bonding in crystal of 2
2.2 红外光谱和电子光谱
配体HLs中1 647和1 621 cm-1处的强吸收归属于羰基和亚胺基的伸缩振动,3 170 cm-1归属于酰胺的N-H伸缩振动,配合物1和2中νC=O和νNH消失,说明配合物中HLs配体以烯醇式配位,金属配位导致亚胺基νC=N红移至1 597 cm-1,因此所有化合物在1 577~1 418 cm-1范围的一组吸收峰归属于芳环骨架的伸缩振动,857~740 cm-1归属于芳环C-H面外弯曲振动,717~702 cm-1范围的一个吸收峰是噻吩C-S的特征。
化合物DMSO溶液的紫外可见光谱见图7,化合物HLs在274和309 nm附近的吸收带分别属于配体的π-π*电子跃迁(即所谓的K带)和分子内的荷移跃迁(ILCT)。在配合物中配体以烯醇式与金属配位,共轭程度增大,电子的流动性增强,ILCT跃迁红移,而且吸收峰的相对强度发生显著变化。1和2的结构相似,电子吸收光谱也很相似,266和264 nm吸收带属π-π*电子跃迁,而349 nm附近的强吸收带归属ILCT,394 nm处出现的新的吸收带来自配体与金属之间的荷移跃迁(LMCT)。
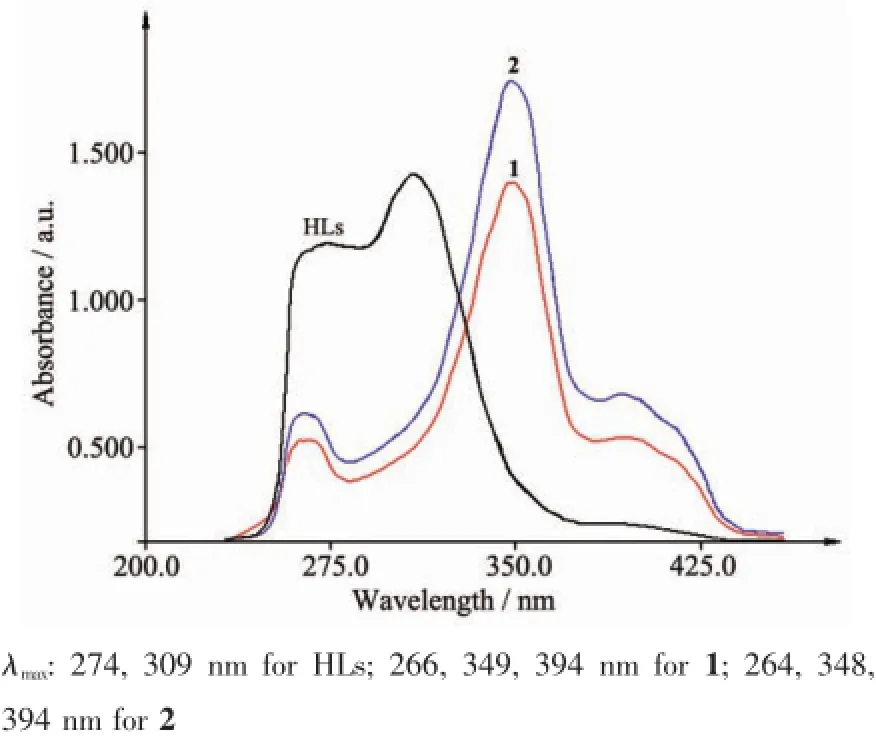
图5 配体和配合物的紫外可见吸收光谱Fig.5UV-Vis spectra of the ligands and complex
2.3 量化计算
用Gaussian 09程序包[18],采用密度泛函理论(DFT)[19],在B3LYP水平对C,H,O,N,S原子用6-31G(d)基组,Cu和Br原子用lanl2dz基组,计算了配合物1的自然电荷布居和Wiberg键级以及分子的碎片对前线分子轨道的贡献(表4~6)。计算采用的原子坐标来自晶体结构数据。计算中收敛精度采用程序的默认值。
配合物1的LUMO和HOMO都较低,而且ΔE =ELUMO-EHOMO=3.397 eV,差值较大,说明该化合物具有较好的热稳定性。将分子分为3部分,分别为铜原子Cu、吡啶酰腙C8N3O、噻吩基C4S。最高占据轨道(SOMO)电子云主要集中在C8N3O(78.8%)和噻吩基(21.2%),根据分子轨道理论,最高及其附近的占有分子轨道具有优先提供电子的作用,说明C8N3O部分优先提供电子与金属离子形成配位键。而最低空轨道138α的电子云主要集中在Cu(68.4%)和C8N3O(31.6%)上,说明该片段的空轨道可作为电子的受体,成为化合物反应的活性中心;电子由137α向138α跃迁时,主要发生的是电子由C8N3O和C4S向Cu的荷移跃迁(LMCT)。而电子由137α向139α跃迁时,主要发生的是电子由C4S向C8N3O的电荷转移跃迁(ILCT)和C8N3O向C8N3O的电子跃迁(即π→π*电子跃迁)。
铜在配合物1中的化合价为+2,由表5可见,Cu1、O1、N1和N2的净电荷分别为0.857e、-0.652e、-0.469e和-0.270e,铜原子所带电荷远小于2e,说明配位原子部分负电荷转向了中心离子,从而从理论上证明配位键的存在。电荷转移的结果也使得与配位原子相连的C1、C5、C6、C8成为正电荷较为集中的原子。从表6可知,C1-C2、C2-C3、C3-C4、C4-C5、C5-N1和N1-C1的Wiberg键级平均值为1.387,C9-C10、C10-C11和C11-C12的键级平均值为1.460,小于1.500,这是共轭π键作用的结果。C6-N2的键级为1.594,属典型的双键;C8-O1的键级为1.413,小于1.500,是羰基烯醇化配位导致电子转移的结果。Cu1-O1、Cu1-N2和Cu1-N1的键级分别为0.246、0.206和0.307,说明在配位能力上吡啶基N1>羰基O1>亚胺基N2;同时说明Cu1-N2在热分解时可能优先断裂,成为热解引发键[20]。
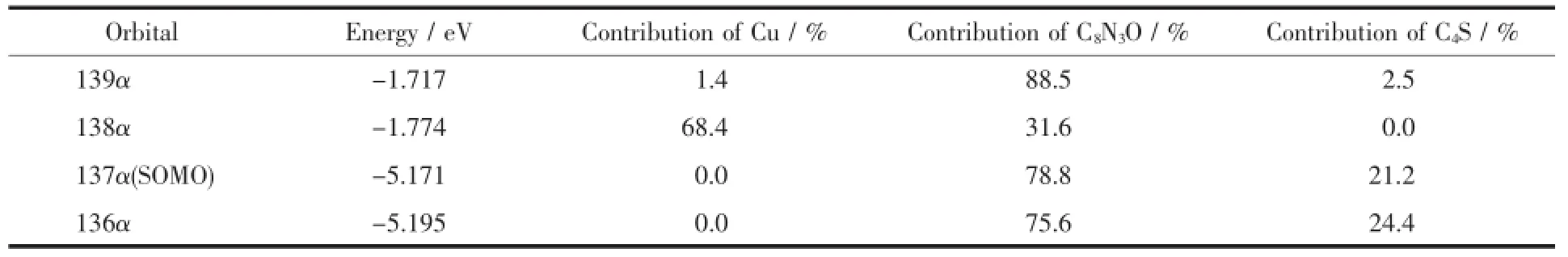
表4 配合物1的前线分子轨道能量和分子碎片对该分子轨道贡献Table 4Frontier molecular orbital energy and molecular fragment contribution to the molecular orbitals of complex 1
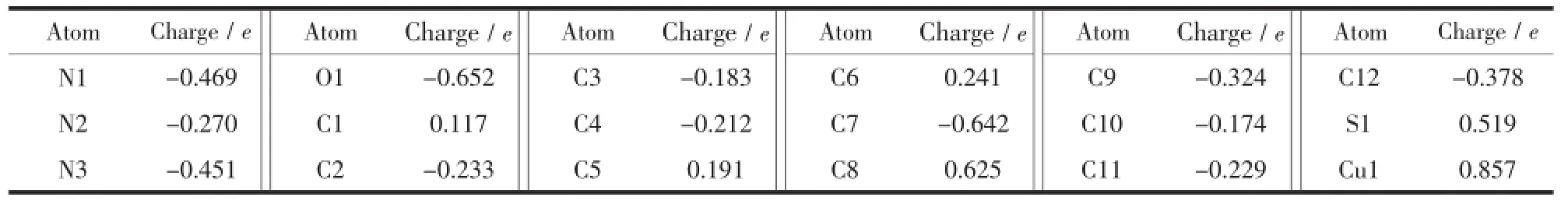
表5 化合物1的NBO电荷布居Table 5NBO charges populations of the complex 1

表6 化合物1的Wiberg键级Table 6Wiberg bond order of the complex 1
[1]Wróbel D,Graja A.Coord.Chem.Rev.,2011,255(21/22): 2555-2577
[2]Ye B H,Tong M L,Chen X M.Coord.Chem.Rev.,2005, 249:545-565
[3]Choubey S,Chattoopadhayay S,Bhar K,et al.J.Chem.Sci., 2014,126(6):1685-1694
[4]WEI Tai-Bao(魏太保),LENG Yan-Li(冷艳丽),WANG Yong-Cheng(王永成),et al.Chinese J.Org.Chem.(有机化学),2009,29(2):216-221
[5]YE Xing-Pei(叶行培),WANG Guan-Jie(王冠杰),PAN Peng (潘鹏),et al.Chinese J.Inorg.Chem.(无机化学学报),2014, 30(12):2789-2795
[6]CHEN Yan-Min(陈延民),JIANG Xia(江霞),CHEN Guang-Hui(陈广慧),et al.Chinese J.Inorg.Chem.(无机化学学报),2015,31(11):2159-2166
[7]CHEN Yan-Min(陈延民),XIE Qing-Fan(解庆范),WEI Zan-Bin(魏赞斌),et al.Chinese J.Inorg.Chem.(无机化学学报), 2014,30(6):1243-1249
[8]Ying S M.Inorg.Chem.Commun.,2012,22:82-84
[9]Zheng C Z,Wang L,Liu J.J.Mol.Struct.,2012,1018(27): 78-83
[10]Ebrahimipour S Y,Khabazadeh H,Castro J,et al.Inorg. Chim.Acta,2015,427:52-61
[11]You Z L,Shi D H,Zhang J C,et al.Inorg.Chim.Acta, 2012,384:54-61
[12]Mondal S,Naskar S,Dey A K,et al.Inorg.Chim.Acta, 2013,398:98-105
[13]Khandar A A,Afkhami F A,Hosseini-Yazdi S A,et al. Inorg.Chim.Acta,2015,427:87-96
[14]Li Y,Zhao J,He C C,et al.J.Inorg.Biochem.,2015,150: 28-37
[15]Richardson D R,Becker E,Bernhardt P V.Acta Crystallogr., Sect.C:Cryst.Struct.Commun.,1999,55:2102-2105
[16]Bourhis L J,Dolomanov O V,Gildea R J,et al.Acta Crystallogr.,Sect.A:Found.,2015,A71:59-75
[17]CHEN Yan-Min(陈延民),XIE Qing-Fan(解庆范),LIU Jin-Hua(刘金花),et al.Chinese J.Inorg.Chem.(无机化学学报),2015,31:74-80
[18]Frisch M J,Trucks G W,Schlegel H B,et al.Gaussian 09, Revision A.02,Gaussian,Inc.,Wallingford CT,2009.
[19]Dreizler R M,Gross E U K.Density Functional Theory. Heidelberg,Germany:Springer-Verlag,1990.
[20]YANG Ying-Qun(杨颖群),LI Chang-Hong(李昶红),LI Wei (李薇).Comput.Appl.Chem.(计算机与应用化学),2010,27 (12):1669-1672
Hydrothermal Syntheses,Crystal Structures and Quantum Chemical Calculation of Copper(Ⅱ)and Nickel(Ⅱ)Complexes with 2-Acetylpyridine Thiophene-2-formyl Hydrazone Ligand
XIE Qing-FanLU Xiu-NanCHEN Fei-PengLI YingCHEN Yan-Min*
(College of Chemical Engineering and Material,Quanzhou Normal University,Quanzhou,Fujian 362000,China)
The N′-(methyl-pyridin-2-yl-methylene)-thiophene-2-carboxylic acid hydrazide Schiff base ligand(HLs) hydrothermally reacted with Cu(Ⅱ)or Ni(Ⅱ)acetates,and yielded a pair of structurally similar complexes with general formula M(Ls)2(M=Cu(Ⅱ),1;Ni(Ⅱ),2).These compounds were characterized by elemental analyses,IR and UV spectra.Their molecular structures are finally determined by X-ray crystallography.The results reveal that Ls coordinates with metal ions as an anionic tridentate[ONN]ligand forming mononuclear distorted octahedral complexes.The complex 1 is linked by C-H…π interactions to generate a 2D layers,whereas 2 is linked by C-H…π interactions and C-H…O and C-H…N H-bonding to form a 3D framework.CCDC:1404500, 1;1062985,2.
Schiff base;complexes;crystal structure;hydrothermal synthesis;quantum chemical calculation
O614.121;O614.81+3
A
1001-4861(2016)06-1019-07
10.11862/CJIC.2016.135
2015-12-08。收修改稿日期:2016-04-21。
泉州师范学院学科建设资金、国家级大学生创新创业实践项目(No.201410399017)和福建省大学生创新创业实践项目(No.201510399030)资助。
*通信联系人。E-mail:qzucym@163.com;会员登记号:S06N5449M1311(解庆范);S06N2113M1304(陈延民)。

