介孔硅酸镁改性硫酸钙骨水泥的降解及成骨性
陈洁 董谢平 刘争卉 胡兴龙 魏杰*,
(1华东理工大学超细材料制备与应用教育部重点实验室,上海200237)
(2江西省人民医院骨科,南昌330006)
介孔硅酸镁改性硫酸钙骨水泥的降解及成骨性
陈洁1董谢平*,2刘争卉1胡兴龙1魏杰*,1
(1华东理工大学超细材料制备与应用教育部重点实验室,上海200237)
(2江西省人民医院骨科,南昌330006)
将介孔硅酸镁(m-MS)掺杂到硫酸钙(CS)中,制备了一种新型复合骨水泥(m-MSC)。结果显示:掺入m-MS,延长了m-MSC的固化时间;提高了其降解速率;掺入m-MS可中和CS降解产生的酸性物质,缓解pH值下降。体外细胞实验显示:m-MSC能促进MC3T3-E1细胞增殖和分化;动物体内植入实验显示:m-MSC的成骨量和Ⅰ型胶原阳性表达率都显著高于CS。
介孔硅酸镁;硫酸钙;复合骨水泥;降解性;成骨性
0 引言
硫酸钙(CS)人工骨具有良好的生物相容性、降解性和成骨性,作为骨移植替代物的研究已有100多年历史,在临床应用上得到了广泛的认同,是一种比较理想的骨移植替代材料之一[1-3]。CS人工骨能够在体内完全吸收,在体内降解时,局部形成了高钙环境,不仅为新生骨组织提供了钙源,而且还能促进成骨细胞增殖与分化,形成新骨组织[4]。然而,研究表明:CS降解时产生酸性物质,引起植入区微环境pH值下降,导致局部产生无菌炎症反应;而且CS人工骨的生物活性较低,成骨性能较差[5-6]。
为了扩展了CS人工骨的应用范围,提高了其临床应用的效果,有人将CS同其它生物材料复合,增强其成骨性能,如CS复合富血小板血浆、自体骨、壳聚糖、明胶等[7-10]。通过对CS改性,使其性能得到不断提高。介孔硅酸镁(m-MS)是一种新型的骨修复材料,具有优良的生物相容性和降解性[11];m-MS降解呈弱碱性,有利于细胞生长[12];另外,与常规生物材料相比,m-MS具有大的比表面积和高的孔容,因此生物活性更高[13]。另外,一些研究发现:镁、硅元素能够促进成骨细胞的增殖、分化及骨相关基因表达[14]。因此,本研究将m-MS掺杂到CS中,制备了一种新型复合骨水泥(m-MSC);通过体外理化性能表征、细胞实验,以及兔股骨缺损植入实验,评价了m-MSC的生物相容性、降解性及成骨性能。
1 实验部分
1.1 m-MSC的制备及表征
3 g聚(丙二醇)-嵌-聚(乙二醇)-嵌-聚(丙二醇) (P123)溶于217 g去离子水中,再加入6 g乙醇,搅拌至溶液澄清;再依次加入17 mL浓盐酸和12.9 g正硅酸乙酯(TEOS)。搅拌30 min,再加入14.8 g硝酸镁(Mg(NO3)2·6H2O),搅拌4 h后,于通风橱中陈化1~2天。样品水洗3次后,放入100℃的干燥箱中干燥12 h;干燥后的样品在600℃下煅烧5 h(升温速率2℃·min-1),得m-MS粉体。将二水硫酸钙于马弗炉中(160℃)煅烧8 h,得β-半水硫酸钙,用球磨机粉碎样品。将m-MS粉末按0%(CS)、20%(20m-CSC)和40%(40m-MSC)的质量百分比与β-半水硫酸钙粉末均匀混合,制得骨水泥粉末;将去离子水与骨水泥粉末调成水泥浆体(1∶1,g·mL-1),将浆体填入四氟模具中(Ф 6×6 mm和Ф 12×3 mm),置于100%相对湿度、37℃环境中固化24 h,制得水泥固化样品,用于后期各种测试。
将m-MS研磨至粉末,在乙醇中超声分散10 min,用吸管吸取一滴溶液滴加至铜网上,待乙醇完全挥发,用高分辨透射电子显微镜(TEM,JEM1400F型,日本JEOL公司)观察其微观形貌及结构(工作电压为200 kV)。用转靶X射线多晶衍射仪(XRD,D/ max-2550-VB/PC型日本Rigaku公司)测试m-MS的物相。辐射源Cu Kα(λ=0.154 nm),电压40 kV,电流450 mA,扫描范围10°~80°。将骨水泥充分干燥,用导电胶粘结于样品台上,喷金处理样品表面,用扫描电子显微镜(SEM,S-3400型,日本Hitachi公司)观察样品的表面形貌。用XRD测试β-半水硫酸钙及骨水泥的物相。
1.2 m-MSC的固化时间和抗压强度
采用Gilmore双针法测定骨水泥的凝结时间[15]。将骨水泥粉末与水调和,搅拌均匀后,将水泥注入至模具后开始计时,1 min后,将Gilmore针N1垂直落在水泥表面,保持5 s,每隔30 s重复1次,直至在表面不能留下压痕为止,记录该段时间t,即为固化时间。将骨水泥制成10×10×15 mm的块状固体,用万能力学试验机(REGER30-50型)测试其抗压强度。测试条件为1 mm·min-1,压缩比达到50%或碎裂时,停止试验。
1.3 体外降解和矿化实验
将样品(CS、20m-MSC和40m-MSC,Ф 12×3 mm)用无水乙醇超声清洗2~3次,用烘箱于100℃干燥24 h,电子天平称其质量并记录为M0,将样品放入聚乙烯管中,加入Tris-HCl溶液(pH=7.4),样品质量与浸泡液体积比为1/20(g·mL-1),将聚乙烯管置于恒温振荡仪中(温度为37℃,震荡频率72 r·min-1)。每周更换一次浸泡溶液,每次换液前,用等离子体发射光谱仪(ICP)测定Tris-HCl浸泡液中的Ca、Mg、Si离子浓度,并用pH计测量溶液的pH值。每周取出样品,用烘箱于100℃干燥后,称其质量,记为Mt,则样品的失重率ML为:
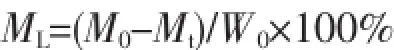
将样品(CS、20m-MSC和40m-MSC,Ф 12×3 mm)浸泡在模拟体液(SBF,pH=7.4)中[16],固液比为1/200 (g·mL-1),整个体系置于37℃的恒温摇床中。在第7天,分别取出样品,用去离子水反复冲洗,在37℃烘箱中烘干,利用SEM观察样品表面是否有磷灰石生成。
1.4 细胞培养实验
1.4.1 细胞形貌和增殖
将样品(CS、20m-MSC和40m-MSC,Ф 12×3 mm)用高温蒸汽消毒灭菌后,放入24孔细胞培养板中;将MC3T3-E1细胞接种于样品表面(2.5×104mL-1),每2天更换一次细胞培养液。培养基为DMEM,含有10%(V/V)胎牛血清,1%(V/V)的抗生素;细胞生长环境为37.5℃,100%饱和湿度,5%CO2气氛中。第3天,吸出孔板内的培养液,用磷酸缓冲溶液(PBS)清洗样品,再用2.5%的戊二醛固定2 h;吸出固定液,用5 μg·mL-1鬼笔环肽(FITC-Phalloidin)染色60 min,PBS清洗样品,再用DAPI染色5 min,用激光共聚焦显微镜(CLSM)观察。
将实验样品(同前)放入24孔细胞培养板中;将MC3T3-E1细胞接种于样品表面(1×104mL-1)。每2天更换一次细胞培养液。分别在1、3和7天,将样品取出,放入新的24孔板中,加入CCK8试剂500 μL,放回孵箱,4 h后吸取10 μL至96孔板中,用酶标仪于490 nm处,测定相应时间和样品的光密度值(OD)。
1.4.2 ALP活性
实验样品(同前)放入24孔细胞培养板中;将MC3T3-E1细胞(2.5×104mL-1)接种于样品表面。每2天更换一次细胞培养液。在7,10和14天,吸去孔内的培养基,用PBS缓冲液清洗孔3次。在放有样品的孔中加入500 μL乙基苯基聚乙二醇溶液(浓度为1%),以获得细胞裂解液。裂解完成后,每孔加入50 μL的P-硝基苯磷酸盐溶液(浓度为1 mg·mL-1),室温放置15 min,最后加入100 μL的0.1 mol·L-1的NaOH终止反应。用酶标仪在405 nm波长处测OD值,并根据OD值计算出样品上细胞的ALP活性。
1.5 动物体内骨植入实验
CS、20m-MSC和40m-MSC三组样品(Ф 6×6 mm)辐照灭菌。选取健康成年雄性新西兰大白兔27只(体重2.8~3.1 kg),分为3组(每组分别植入CS、20m-MSC和40m-MSC),每组9只兔。用骨科钻在兔右侧股骨末端制作骨缺损(Ф 6×6 mm),将样品植入缺损处,术后连续3天,对兔注射青霉素防止术后感染。于术后4,8和12周,处死兔(每个时间点,3只兔作为平行样),取出植入样品,用2.5%的戊二醛固定1周。
1.5.1 组织学评价
取甲酸和甲醛各10 mL,混合后加蒸馏水至100 mL,即为甲酸一福尔马林液脱钙液。将已固定的样品放入脱钙液中,置入恒温箱中,37℃过夜,更换液体2次。脱钙后的样品经流水冲洗后,再进行常规石蜡包埋切片。脱钙切片用二甲苯脱蜡处理,用苏木素染色10 min。用1%的盐酸-乙醇溶液(70%乙醇配制)进行分色,通过显微镜观察控制,分色到细胞核及染色质清晰为止。用流水冲洗30 min,再用丽春红酸性品红溶液染色5 min,后用1%磷酸钼溶液染色3 min,浸入苯胺蓝冰醋酸中染色5 min,用水迅速冲洗;将切片置于60℃干燥箱中烘干,用二甲苯透明2次,滴加适量中性树脂后,加盖玻片封片,在倒置显微镜下观察。
1.5.2 免疫组化分析
石蜡切片经过脱蜡处理,在3%H2O2中浸泡10 min(以消除内源性过氧化物酶的活性);再用PBS缓冲液冲洗3次;室温下复合消化酶消化10 min后,PBS缓冲液冲洗3次;滴加BAS(牛血清白蛋白)封闭液,室温20 min,倒去多余液体;滴加一抗兔抗人Ⅰ型胶原抗体(1∶50稀释),4℃过夜,用PBS缓冲液冲洗2次后,加入二抗生物素化兔抗人Ⅰ型胶原抗体工作液,37℃孵箱孵育0.5 h;再用PBS缓冲液冲洗2次,后滴加适量的SABC(链霉亲和素-生物素复合物)液在37℃孵箱孵育0.5 h。用PBS缓冲液冲洗2次后,加入DAB(二氨基联苯胺)显色剂显色15 min。显色结束后,用自来水反复冲洗,并对其进行复染、脱水、透明和封片。阴性对照用PBS代替一抗,其余步骤同上。
1.6 统计方法
采用SPSS15.0(SPSS,美国)统计分析软件。计量数据用平均值±标准差的形式表示,采用t检验进行统计学分析,P>0.05表示实验所获得的数据无显著性差异,不具有统计学意义;P<0.05表示实验所获得的数据具有显著性差异,具有统计学意义。
2 结果与讨论
2.1 m-MS的TEM观察和XRD分析
图1a显示的是m-MS的透射电子显微镜照片;可以看出m-MS的介孔孔道结构具有高度的有序性,且介孔孔径的平均尺寸约为5 nm。m-MS的这种规整有序的介孔结构,使其具有高比表面积和孔容。图1b是m-MS的广角XRD图,图中在2θ=22°左右存在一个较宽的衍射峰,这是典型的无定形硅酸盐的X射线衍射图[17]。这说明介孔硅酸镁是无定形相,是一种非晶材料。
2.2 m-MSC的SEM观察和XRD分析
图2为CS,20m-MSC和40m-MSC的SEM照片。可以看出:CS(a)是由硫酸钙晶体组成,形成致密结构。随着m-MS含量的升高,20m-MSC(b)和40m-MSC(c)的表面变得粗糙多微孔;m-MS分布于硫酸钙中,使得原本致密的硫酸钙晶体结构变得松散多孔。
图2d为β-半水硫酸钙及m-MSC(固化24 h)的XRD图,可以看出:β-CaSO4·1/2H2O的特征峰出现在14.72°,25.68°,29.76°和31.91°处;而CaSO4·2H2O (CS)的特征峰出现在11.68°,20.78°,23.38°,29.18°,31.18°和33.38°处,且没有发现β-半水硫酸钙的特征峰;表明β-半水硫酸钙已转化为二水硫酸钙[18]。在20m-MSC和40m-MSC中,硫酸钙的特征峰出现的位置与CS一致,但峰的强度随着m-MS含量的增加而减弱,说明m-MS的掺入,复合体系中没有新的晶型出现,但影响了CS的结晶。
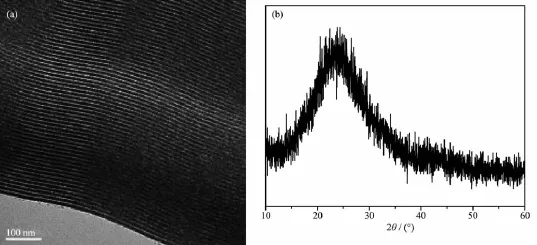
图1 m-MS的TEM(a)照片和XRD(b)图Fig.1TEM(a)image and XRD(b)of m-MS
2.3 m-MS含量对m-MSC的固化时间和抗压强度的影响
由表1可见:CS的固化时间为5 min,而20m-MSC和40m-MSC的固化时间分别为6.5和7.8 min;说明随着m-MS掺入量的增加,m-MSC的固化时间延长,骨水泥更加容易操作,方便了临床使用。结果表明:在CS中添加一定量的m-MS,解决了CS骨水泥在临床使用时,其固化时间过快(4~5 min)、医生不易操作的缺点[19]。另外,由表1可见:CS的抗压强度为15 MPa,而20m-MSC和40m-MSC的抗压强度分别为12 MPa和10 MPa;结果显示:随着m-MS掺入量的增加,m-MSC的抗压强度逐渐降低,这说明m-MS的掺入量对m-MSC的抗压强度有一定的影响。一般情况,临床使用的骨水泥的抗压强度要求在3 MPa以上[20]。因此,本研究制备的复合骨水泥(40m-MSC 10 MPa)的抗压强度,可满足临床应用的要求。

表1 骨水泥的凝结时间和抗压强度Table 1Setting time and compressive strength of bone cements
2.4 m-MS含量对m-MSC体外降解性能的影响
由图3a可见,3组骨水泥在Tris-HCl溶液中的失重率都随时间而增加,40m-MSC失重率最高,而CS最低;浸泡12周后,40m-MSC失重率为91.8%;而20m-MSC和CS的失重率分别为83.4%和78.7%;这说明随着m-MS掺入量的增加,m-MSC的降解速度加快,这是因为掺入m-MS,破坏了CS固化后的密实结构,从而提高了骨水泥的降解性,这有利于促进新骨再生[21]。结果表明:在CS中添加m-MS,可以调节m-MSC的降解速率,从而调控骨组织再生。由图3b可见,前2周,浸泡CS的Tris-HCl溶液的pH值下降明显(从7.4下降至6.95),之后,溶液pH值下降缓慢;浸泡12周后,溶液的pH为6.86,呈酸性。而浸泡20m-MSC和40m-MSC的溶液pH值,在前2周下降幅度不大(分别从7.4下降到7.1和7.23),之后,溶液pH值呈缓慢上升,浸泡12周后,溶液的pH分别为7.28和7.31,呈弱碱性。
研究表明:硫酸钙降解产生酸性物质,其植入体内初期,材料周围的微环境pH值明显下降,从而引起周围组织产生无菌炎症反应[22]。硅酸镁降解时,溶液的pH值呈弱碱性,有利于细胞生长[23]。本实验结果表明:添加m-MS于CS中,能够中和CS降解产生的酸性物质,从而减缓pH值下降;随着m-MS掺入量的增加,浸泡m-MSC的溶液pH值下降越少,而且还会小幅度上升。因此,添加m-MS的m-MSC植入体内,可避免因其降解导致的pH值下降,从而避免无菌炎症反应的发生。
图4是CS、20m-MSC和40m-MSC在Tris-HCl溶液中浸泡7天,溶液的钙、镁和硅离子浓度的变化情况。结果表明:Ca、Mg、Si离子浓度随时间而增加,这是由于骨水泥溶解后释放出这些离子。
2.5 m-MS含量对m-MSC体外生物活性的影响
图5是CS(a),20m-MSC(b)和40m-MSC(c)在SBF溶液中矿化7天后的SEM照片。CS表面出现少量磷灰石,而20m-MSC和40m-MSC表面的磷灰石量明显高于CS表面。在40m-MSC表面出现了大量磷灰石,这说明:随着m-MS含量的增加,复合骨水泥的生物活性明显提高,这是因为SBF中含有过饱和的钙离子,以及m-MS表面含有丰富的Si-OH,可以诱导钙-磷成核,从而生长出磷灰石[24-25]。
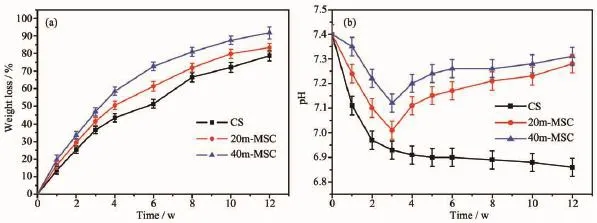
图3 CS、20m-MSC和40m-MSC在Tris-HCl溶液中的失重率(a)及浸泡液的pH值变化(b)Fig.3Weight loss(a)of CS,20m-MSC and 40m-MSC and pH change(b)of the solution after soaking in the Tris-Hcl solution for different time
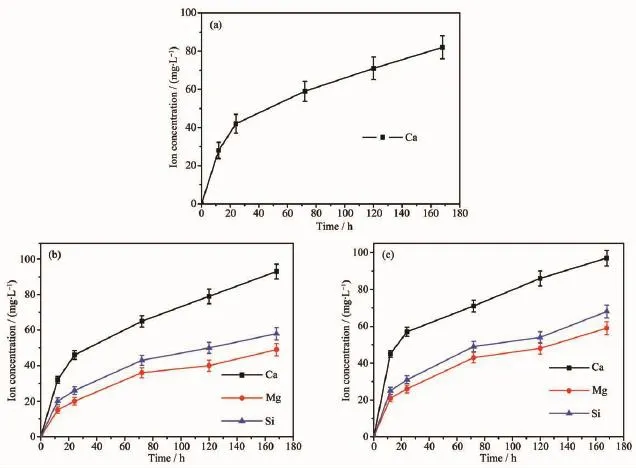
图4 CS(a)、20m-MSC(b)和40m-MSC(c)在Tris-HCl溶液中浸泡7天溶液的钙、镁和硅离子浓度变化Fig.4Change of Ca,Mg,P ionic concentrations in Tris-HCl solution after immersion CS(a),20m-MSC(b) and 40m-MSC(c)for 7 days
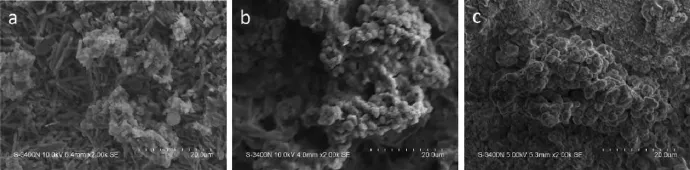
图5 CS(a),20m-MSC(b),40m-MSC(c)在SBF溶液中矿化7天后的SEM照片Fig.5SEM images of CS(a),20m-MSC(b),40m-MSC(c)after immersed in the SBF solution for 7 days
2.6 m-MSC对细胞形态的影响
图6是MC3T3-E1细胞在骨水泥表面种植不同时间后的激光共聚焦照片。由图可见,细胞在样品表面种植6 h后,CS表面粘附有一定量的细胞,而40m-MSC表面的细胞粘附量明显多于CS;随着时间的延长,细胞数量在3种水泥表面增加(1天);3天时,40m-MSC表面的细胞铺展形态明显优于CS,且细胞骨架轮廓清晰。结果表明:掺入m-MS后,m-MSC表面的微环境呈弱碱性,有利于细胞在材料表面粘附与生长。
2.7 m-MSC对细胞增殖和碱性磷酸酶(ALP)活性的影响
图7a是MC3T3-E1细胞培养不同时间后,细胞在3种骨水泥表面上的增殖情况。由图可见:随着培养时间的延长,细胞的光密度(OD)值增加,说明细胞在3种骨水泥上不断地增殖。在第7天时,细胞在40m-MSC表面的OD值明显高于20m-MSC和CS,说明细胞在40m-MSC表面增殖较快。结果表明:添加m-MS的m-MSC能促进成骨细胞生长和增殖。m-MSC表面的微环境呈弱碱性,有利于细胞生长;另外,m-MS降解产生的镁、硅离子有利于成骨细胞的增殖[14]。
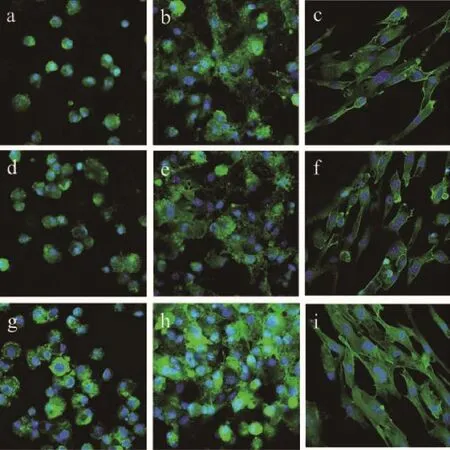
图6 MC3T3-E1细胞在CS(a,b,c),20m-MSC(d,e,f)和40m-MSC(g,h,i)表面种植6 h(a,d,g),1天(b,e,h)和3天(c,f,i)后的激光共聚焦照片Fig.6CLSM photos of cytoskeletal morphology and spreading of MC3T3-E1 cells on CS(a,b,c),20m-MSC(d,e,f)and 40m-MSC(g,h,i)for 6 h(a,d,g),1 d(b,e,h)and 3 d(c,f,i)

图7 MC3T3-E1细胞在骨水泥表面增殖情况(a),以及培养3和7天后的ALP活性(b)Fig.7Proliferation of MC3T3-E1 cells on the cements surfaces(a)and ALP activity of the cells after cultivating for 3 and 7 days(b)
ALP是成骨细胞分化的一种标志酶,其活性的高低代表细胞成骨分化的程度[26]。由图7b可见,随着细胞在样品表面培养时间的增加,MC3T3-E1细胞的ALP活性不断增加;且细胞在40m-MSC和20m-MSC上的ALP活性高于CS;在第7天时,在40m-MSC上的细胞ALP活性明显高于CS;结果说明:添加m-MS的m-MSC能促进细胞成骨分化,这与文献报道的m-MS能促进成骨细胞分化结果一致[12]。
2.8 组织切片评价m-MSC体内降解和成骨性
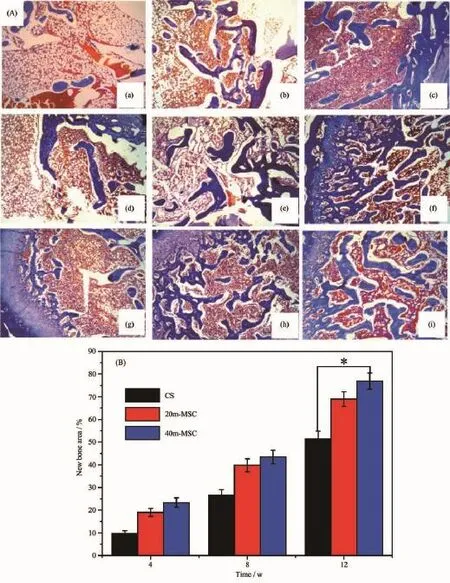
图8 CS(a,b,c)、20m-MSC(d,e,f)和40m-MSC(g,h,i)植入兔股骨缺损4(a,d,g),8(b,e,h)和12(c,f,i)周后的三色染色组织切片照片(A);骨水泥植入兔股骨缺损4,8和12周后的新生骨组织量的变化(B)Fig.8Masson trichrome staining photos(A)of CS(a,b,c),20m-MSC(d,e,f)and 40m-MSC(g,h,i)implanted in vivo for 4(a,d,g),8(b,e,h)and 12(c,f,i)weeks,and New bone area change(B)after bone cements implanted in vivo for 4,8 and 12 weeks
图8A是CS、20m-MSC和40m-MSC植入兔子股骨末端骨缺损区4、8和12周后的三色染色组织切片照片(蓝色代表新生骨组织,深红色代表成熟骨组织)。结果显示:随着植入时间的延长,骨水泥不断减少,新生骨组织不断增多,同时伴有成熟骨的形成。图8B是利用Image-pro Plus软件对组织切片进行统计学分析,得到样品植入骨缺损后,不同时间的新生骨组织量。由图可见:骨水泥在体内随时间而不断降解,新生骨组织不断增多。植入体内12周后,40m-MSC和20m-MSC的新生骨面积分别为79.3%和65.2%,明显高于CS(新生骨面积仅占49.1%)。结果表明:添加m-MS的m-MSC能促进新骨再生,该骨水泥具有优良的降解性和成骨性能。
2.9 免疫组化-Ⅰ型胶原评价m-MSC体内成骨
在骨基质矿化的过程中,成骨细胞合成并分泌Ⅰ型胶原,胶原纤维形成框架,为骨矿化提供结构基础。因此,Ⅰ型胶原的合成是衡量成骨细胞成骨能力的一个非常重要指标[27]。图9A是CS、20m-MSC和40m-MSC植入兔子股骨末端缺损4、8和12周,组织切片的Ⅰ型胶原免疫组化染色照片。图中黄色区域为Ⅰ型胶原的阳性表达,黄色区域面积越大,表明Ⅰ型胶原蛋白分泌越多,新生骨组织形成越多。
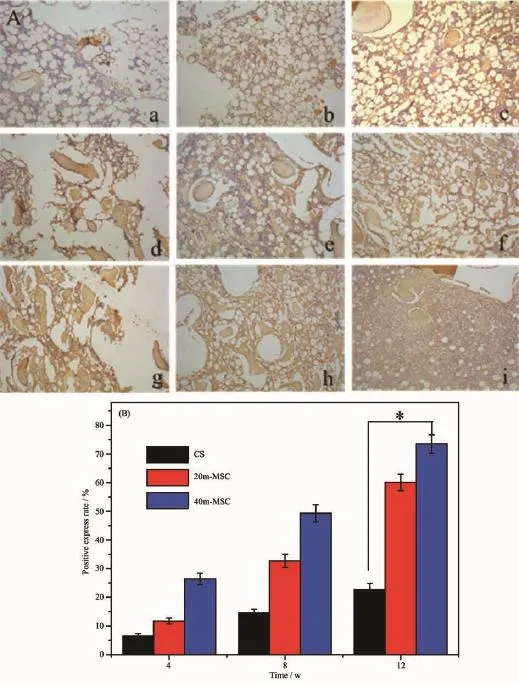
图9 骨水泥CS(a,b,c)、20m-MSC(d,e,f)和40m-MSC植入体内4(a,d,g)、8(b,e,h)和12(c,f,i)周,组织切片的免疫组化染色照片(A,Ⅰ型胶原染色)和相应时间的阳性表达率(B,Ⅰ型胶原表达)Fig.9Immunohistological staining photos(A,COL-Ⅰstaining)and positive express rate(B,COL-Ⅰexpression)after CS(a,b,c),20m-MSC(d,e,f)and 40m-MSC(g,h,i)implanted in vivo for 4,8 and 12 weeks
图9B是样品植入骨缺损不同时间,植入区组织的Ⅰ型胶原阳性表达率。由图可知:3种材料植入区的Ⅰ型胶原阳性表达率随时间而不断增加,说明3种材料都具有成骨性能。在整个时间段,40m-MSC组的Ⅰ型胶原阳性表达率明显高于CS组。第12周时,40m-MSC和20m-MSC的Ⅰ型胶原表达率分别为73.5%和60.1%,而CS的Ⅰ型胶原表达率为22.7%;说明40m-MSC组的成骨性能明显优于CS组。文献报道:m-MS降解产生的镁、硅离子有利于成骨细胞的增殖和分化,进而促进新骨组织再生[28-29]。而且m-MS降解时呈弱碱性,可以中和硫酸钙降解产生的酸性物质,避免周围组织产生炎症反应,也有利于新组织再生。总之,添加m-MS的m-MSC能促进新骨组织再生,有利于骨缺损的修复。
3 结论
将m-MS掺入CS中,制备了一种新型的复合骨水泥(m-MSC),该骨水泥具有合适的凝结时间,克服了CS固化过快,临床不易操作的缺点。掺入m-MS不仅提高了m-MSC的降解速率;而且其降解产物可以中和CS降解产生的酸性物质,缓解植入区的pH下降,从而克服了CS易引起周围组织产生炎症反应的缺点。40m-MSC的表面能沉积大量磷灰石,有利于新骨形成。m-MSC具有优良的细胞相容性,有利于MC3T3-E1细胞粘附、增殖与分化;m-MSC成骨性能优良,能促进新骨再生,有利于骨缺损的修复。因此,m-MSC是一种具有临床应用前景的骨修复材料。
[1]Liu X,Liu H Y,Lian X J,et al.J.Biomater.Appl.,2012, 28:12-19
[2]Gaasbeek R D,Rijnberg W J,van Loon C J,et al.Arch. Orthop.Traum.Su.,2005,125:42-45
[3]Hughes E,Yanni T,Jamshidi P,et al.Adv.Appl.Ceram., 2015,114:65-76
[4]Chen Z G,Kang L Z,Meng Q Y,et al.Mater.Sci.Eng.CMater.,2014,45:94-102
[5]Yang G Y,Liu J L,Li F,et al.Mater.Sci.Eng.C,2014,35 (1):70-76
[6]Borhan S,Hesaraki S,Ahmadzadeh-Asl S.J.Mater.Sci.-Mater.M,2010,21(12):3171-3181
[7]TIAN Xue-Zhong(田学忠),LIU Yue(刘越),CHEN Hua(陈华),et al.Sci.Technol.Eng.(科学技术与工程),2007,7(24): 6309-6312
[8]YAN Rui-Jian(颜瑞健),ZHANG Chun(张春),GUO Qiao-Feng(郭峭峰),et al.China J.Orthop.Trauma(中国骨伤), 2014,27(10):854-857
[9]WANG Peng(王鹏),PI Bing(皮斌),WANG Jin-Ning(王金宁),et al.Chinese J.Tissue Eng.Res.(中国组织工程研究), 2014,18(12):1831-1838
[10]ZHANG Yong-Li(张永莉),HUO Shu-Juan(霍书娟),GAO Jian-Ping(高建平),et al.Polym.Mater.Sci.Eng.(高分子材料科学与工程),2006,22(1):215-217
[11]He D W,Dong W,Tang S C,et al.J.Mater.Sci-Mater.M, 2014,25(6):1415-1424
[12]Wu Z Y,Tang T T,Guo H,et al.Colloids Surf.B,2014, 120:38-46
[13]Zhu Y F,Jian D L,Wang S L.IET Micro Nano Lett.,2011,6 (8):671-674
[14]Zhang Y F,Li S E,Wu C T.J.Biomed.Mater.Res.Part A, 2014,102:105-116
[15]El-Fiqi A,Kim J H,Perez R A,et al.J.Mater.Chem.B, 2015,3:1321-1334
[16]Tadashi K,Hiroaki T.Biomaterials,2006,27:2907-2915
[17]Jankeviciute A,Karoly Z,Tarakina N V,et al.J.Non-Cryst. Solids.,2013,359:9-14
[18]Chen Z G,Liu H Y,Liu X,et al.Mater.Sci.Eng.C,2013, 33:1048-1053
[19]CHU Xin-Hong(储新宏),ZHAO Ping(赵萍),SUN Kang-Ning(孙康宁),et al.J.Ceram.(陶瓷学报),2009,30(3):295-299
[20]Zeng H Z,Zheng X Q,Dian M J,et al.J.Mater.Sci.,2013, 48:2022-2029
[21]Tan Y N,Liu Y,Zhao Z W,et al.J.Biomed.Mater.Res.A, 2015,103(1):194-202
[22]Zhang J,Wang L,Zhang W,et al.J.Orthop.Res.,2015,33: 685-691
[23]Diba M,Goudouri O M,Tapia F,et al.Curr.Opin.Solid State Mater.Sci.,2014,18(3):147-167
[24]LI Xiao-Sheng(李晓生),LIU Chang-Sheng(刘昌胜),HONG Hua(洪华),et al.Chinese J.Inorg.Chem.(无机化学学报), 2008,24(12):1928-1936
[25]Tan Y N,Liu Y,Zhao Z W,et al.J.Biomed.Mater.Res.A, 2015,103:194-202
[26]Zhao Z H,Quan Z X,Jiang D M,et al.J.Mater.Sci.,2013, 48(5):2022-2029
[27]Steinmetz N J,Aisenbrey E A,Westbrook K K,et al.Acta Biomater.,2015,21:142-153
[28]Senthilguru K,Upasana M,Tarun A,et al.Ceram.Int., 2015,41(9):11323-11333
[29]Lin K L,Liu Y,Huang H,et al.J.Mater.Sci:Mater.Med., 2015,26(6):197
Degradability and Osteogenesis of Mesoporous Magnesium Silicate Modified Calcium Sulphate Bone Cement
CHEN Jie1DONG Xie-Ping*,2LIU Zheng-Hui1HU-Xing-Long1WEI Jie*,1
(1Key Laboratory for Ultrafine Materials of Ministry of Education,East China University of Science and Technology,Shanghai 200237,China)
(2Department of Orthopaedic Surgery,Jiangxi People′s Hospital,Nanchang 330006,China)
A novel bone cement of mesoporous magnesium silicate and calcium sulfate composite(m-MSC)was fabricated by introducing mesoporous magnesium silicate(m-MS)into calcium sulfate bone cement(CS).The results showed that the addition of m-MS into CS prolonged the setting time and promoted the degradability of the m-MSC,and neutralized acid substance produced by CS degradation.In cell culture experiments,the result showed that the m-MSC could promote the proliferation and differentiation of MC3T3-E1 cells.In addition,the results of m-MSC histological elevation from bone trauma model revealed that massive bony tissue and Col-Ⅰformed were better than CS after 12 weeks,indicating good osteogenesis of the m-MSC.
mesoporous magnesium silicate;calcium sulfate;composite bone cement;degradability;osteogenesis
TB383
A
1001-4861(2016)06-0935-10
10.11862/CJIC.2016.125
2016-01-18。收修改稿日期:2016-04-05。
国家自然科学基金(No.81271705,31271031)和国家科技支撑计划(No.2013BAI05B10)资助项目。
*通信联系人。E-mail:13576030901@163.com,jiewei7860@sina.com,Tel:+86 021 64251308;会员登记号:14M0101(董谢平)。

