粒毛盘菌多糖纯化、硫酸酯化修饰及抗氧化活性评价
杜湛湛,张 嫱,2,徐 平,王玉芬,叶 明(.合肥工业大学生物与食品工程学院,安徽合肥 230009;2.北方民族大学生物科学与工程学院,宁夏银川 75002)
粒毛盘菌多糖纯化、硫酸酯化修饰及抗氧化活性评价
杜湛湛1,张嫱1,2,徐平1,王玉芬1,叶明1
(1.合肥工业大学生物与食品工程学院,安徽合肥230009;2.北方民族大学生物科学与工程学院,宁夏银川750021)
摘要:文章以粒毛盘菌(Lachnum)为试验菌株,对其胞外多糖(LEP)进行纯化,并对获得的均一组分LEP-1进行硫酸酯化修饰,对修饰前多糖(LEP-1)和修饰后多糖(SLEP-1)进行了扫描电子显微镜、紫外和红外光谱表征,同时评价了两者的体外抗氧化活性。结果表明:LEP-1是由葡萄糖和甘露糖组成的杂多糖,分子量约为473 kDa;SLEP-1的硫酸根取代度(DS)为1.97;SEM图显示修饰前后多糖表面形态由片状变化为网状;LEP-1的红外光谱图中有多糖的特征吸收峰,SLEP-1的红外光谱图除多糖的特征吸收峰外,在1 220 cm-1和818 cm-1处出现硫酸基团的特征吸收峰;LEP-1和SLEP-1对·OH、DPPH·和O2-·有很强的清除作用,
SLEP-1的清除能力大于LEP-1,两者均呈现一定的剂量效应关系。因此,LEP-1和SLEP-1均有明显的抗氧化活性,且可作为天然抗氧化剂应用于食品和医药行业。
关键词:粒毛盘菌;胞外多糖;修饰;抗氧化活性
叶明(1959-),男,安徽怀宁人,博士,合肥工业大学教授,博士生导师.
真菌多糖具有抗氧化、降血糖及免疫调节等多种生物活性,多年来一直受到研究者的广泛关注[1]。不同来源的真菌多糖具有的生物活性强弱存在差别,这与多糖复杂的结构有关,即真菌多糖的一级结构和高级结构均可在不同程度上影响多糖的活性[2-4],并且选择合适的化学修饰方法可以改变多糖原有生物活性强弱或使多糖产生新的活性[5-6]。研究表明,黑灵芝(Ganoderma atrum)多糖进行硫酸酯化修饰后,不同取代度的硫酸酯化多糖的免疫调节和抗氧化活性大小不同,其中对DPPH·清除率比修饰前有所提高,还原力和总抗氧化力下降[7];香菇多糖经硫酸化修饰后,抗肿瘤、抗凝血和免疫调节作用得到很大提高,而且具有明显的抗艾滋病毒效果[5]。
粒毛盘菌属(Lachnum)是属于柔膜菌目(Helotiales)晶杯菌科(Hyaloscyphaceae)的一类腐生性真菌[8],其多糖有同多糖和杂多糖之分,具有多种不同的结构,有抗氧化、抗衰老和抗肿瘤等多种生物活性[1-2,9],进行磷酸化、羧甲基化和硫酸化等化学修饰后其抗肿瘤、抗慢性肾衰和抗氧化活性都有不同程度的提高[1-2,10-11]。
本文从一株粒毛盘菌的发酵液中提取纯化出一种胞外多糖(LEP-1),对其进行结构表征和硫酸酯化修饰,并研究其修饰前后结构的变化,初步评价两者的体外抗氧化活性。
1 材料与方法
1.1材料与仪器
菌种及其发酵培养基:粒毛盘菌YM268子实体采集于安徽黄山,由合肥工业大学微生物资源与应用研究所分离保藏。发酵培养基:无水葡萄糖30 g/L,酵母膏5 g/L,MgSO47H2O 1.0 g/L,KH2PO41.0 g/L,VB150 mg/L,pH自然。
试剂:无水葡萄糖,分析纯,天津市光复科技发展有限公司;酵母膏,生物试剂,北京奥博星生物技术有限责任公司;抗坏血酸(VC),分析纯,上海展云化工有限公司。
仪器:Sephadex G-100(法玛西亚公司)、GCMS分析仪(日本津岛公司)、Waters-1515 HPLC系统(Waters-1515型HPLC泵、Waters-2414视差遮光监测器,Waters公司)、SU8020场发射扫描电子显微镜(日本日立公司)。
1.2发酵与胞外多糖的提取
将粒毛盘菌YM268种子液接种于100 L的发酵罐中发酵,搅拌速度为160 r/min,发酵温度为26℃,发酵时间为8 d。将发酵液旋转蒸发浓缩,3倍体积的95%乙醇醇沉24 h,4 500 r/min离心8 min,蒸馏水复溶。将得到的粗多糖脱蛋白、脱色、透析(透析袋13 kDa)和冻干。将初级纯化后的多糖用双蒸水配成0.15 mg/mL的溶液[12]。采用Sephadex G-100色谱柱,进样量为1 mL,以双蒸水洗脱(收集器4 min 2 mL每管)。绘制洗脱曲线,收集主要组分并命名为LEP-1[11]。
1.3LEP-1的纯度和分子量测定
用高效液相凝胶渗透色谱(HPGPC)法测定LEP-1的纯度和分子量,以双蒸水为流动相,流速为0.5 mL/min,柱温为35℃。根据洗脱峰型分布判断样品纯度,并由葡聚糖标品的标准曲线计算分子量[11-12]。
1.4单糖组分分析
依据文献[12]的方法,将干燥的LEP-1水解、还原和乙酰化后,用GC-MS检测完全水解的LEP-1的乙酰化衍生物,然后用NIST 11 MS Database和MS Search Program v.2.0分析得出色谱数据。GC-MS条件[12]如下:HP-5型适应毛细血管柱(30 m×0.25 mm×0.25 μm);柱温采用程序升温,起始温度为50℃,以10℃/min速度升至250℃,进样口温度为260℃;离子源,EI,70 eV;He流速为1 mL/min;分子量范围为35~650 aum/s。
1.5.1SLEP-1的制备
将90 mL吡啶加入附有冷凝管和温度计的250 mL三颈瓶中,用电磁加热搅拌器搅拌,同时缓慢加入三氧化硫-吡啶的质量为7.5~9.0 g。加热至90℃,再加入LEP-1粉末1.5 g,恒温搅拌1 h,冷却至室温。反应液用3 mol/L的NaOH溶液调至中性,加入5倍体积的95%乙醇,静置24 h。离心,将沉淀物复溶于水,分别用自来水和蒸馏水透析2 d和1 d,过滤,冷冻干燥,得硫酸酯化多糖,命名为SLEP-1[13]。
1.5.2SLEP-1硫酸基质量分数的测定
精密称取105℃干燥至恒质量的108.75 mg K2SO4,以1 mol/L的HCl溶解,于100 mL容量瓶中定容,摇匀即得硫酸根标准贮备液(0.6 mg/mL)。分别准确吸取硫酸根标准贮备液0、0.04、0.08、0.12、0.16、0.20 mL,均以HCl溶液增加至0.20 mL,加入3%的三氯乙酸3.8 mL及氯化钡-明胶溶液(用0.5%明胶溶液配制BaCl2质量分数为1%的溶液)1.0 mL,摇匀,室温静置15 min后于360 nm测吸光度A1,以1.0 mL的0.5%明胶溶液代替氯化钡-明胶溶液重复上述操作,测吸光度A2,以硫酸根质量为横坐标,吸光度差值(A1-A2)为纵坐标,绘制标准曲线[14]。
将3 mg SLEP-1溶于3 mL 1 mol/L HCl溶液,100°C沸水浴1 h后吸取0.2 mL,按标准曲线的制作方法,测定A1和A2,根据标准曲线回归方程计算硫酸基质量分数。
多糖中取代基(substituent)的质量分数[9]w可表示为:

所以硫酸取代度DS为:

其中,162为一个单糖残基的相对分子质量;Msub为取代基的摩尔质量,Msub=81。
Paula Pérez Sobrino(2014:137-168)认为多模态隐喻理论需要进一步发展,需要建立概念相互作用模式赋予多模态信息更丰富的内涵。比如需要建立动态多模态概念整合模式(multi-modal conceptual integration patterns)以探究多模态表达结构。该模式下多模态输入的创造性融合在很大程度上受多模态隐喻和转喻的复合体的互相作用的制约和引导。
1.6扫描电子显微镜分析
利用场发射扫描电子显微镜观察LEP-1和SLEP-1的表面结构特征。取适量粉末,分别粘于实验台的导电胶上,用洗耳球吹去浮样,真空喷金,进行SEM观察。然后利用SEM系统在3.0 kV加速电压下测定,图像的放大倍率为500倍和2 000倍。
1.7紫外与红外光谱分析
采用安捷伦CARY 5000紫外可见近红外分光光度计对LEP-1和SLEP-1进行紫外光谱分析,扫描范围为190~2 500 nm;采用Nicolet 67型傅立叶红外光谱仪对LEP-1和SLEP-1进行红外光谱分析,扫描范围为4 000~400 cm-1。
1.8LEP-1和SLEP-1的抗氧化活性测定
1.8.1对·OH的清除作用
取5×l0-3mol/L邻二氮菲溶液1.5 mL,加pH值为7.4、0.05 mol/L的磷酸缓冲液2.0 mL混匀,加7.5×10-3mol/L FeSO4溶液1.0 mL,每加1管立即混匀,再加入1 mL H2O2(0.1%),最后以蒸馏水增加至总体积为10 mL。反应液在37℃保温1 h,在536 nm下测A损伤。测定LEP-1和SLEP-1溶液及Vc清除·OH的作用:依上述步骤分别加入不同质量浓度的LEP-1、SLEP-1和Vc溶液后再加H2O2,在37℃下保温1 h,测A加样。未损伤管不加H2O2及多糖溶液或Vc溶液,测A未损伤[15-16]。
清除率的计算公式为:

1.8.2对DPPH·的清除作用
配制0.1 mmol/L的DPPH·无水乙醇溶液,取1 mL DPPH·溶液,与3 mL不同质量浓度的LEP-1、SLEP-1和Vc溶液混匀,黑暗环境下静置30 min,517 nm处测混合液的吸光度A样品,测定无水乙醇溶液作为空白对照的吸光度A空白[17]。
清除率的计算公式为:。

1.8.3对O2-·的清除作用
每支试管加入3 mL 50 mmol/L Tirs-HCl(pH =8.2)缓冲液,1 mL不同质量浓度的LEP-1、SLEP-1和Vc溶液,混匀后于25℃下保温20 min,加入经25℃预热0.3 mL 7 mmol/L邻苯三酚溶液,准确反应4 min,加1 mL 10 mmol/L HCl终止反应,在318 nm处测吸光度A1、以水代替反应试剂的吸光度A1'、以水代替样品溶液的吸光度A0[17]。
清除率的计算公式为:

1.9数据分析
所有实验均重复3次,数据取平均值±标准差,采用DPS数据处理软件对实验数据进行分析处理。
2 结果与讨论
2.1LEP的分离纯化
从粒毛盘菌YM268的发酵液中提取得到胞外粗多糖(LEP),其得率约为0.15 g/L。
冷冻干燥的LEP粗品经Sephadex G-100分离后,得到2种多糖组分,分别命名为LEP-1和LEP-2,收集主要组分LEP-1进行以下实验,洗脱曲线如图1所示。

图1 LEP的Sephadex G-100柱层析图谱
LEP-1的高效液相凝胶渗透色谱图如图2所示,由图2可看出,LEP-1以一个单一对称峰在23.53 min时出现,这表明LEP-1均一性较好[11]。通过标准曲线log MW=595+93.50t - 11.45t2+0.68t3(t为洗脱时间)计算得出LEP-1的平均分子量约为473 kDa。
GC-MS软件分析LEP-1水解的乙酰化产物组成如图3所示,由图3可看出,保留时间为19.198 min和19.356 min时出现峰,说明LEP-1是由葡萄糖和甘露糖组成的杂多糖。

图2 LEP-1的高效液相凝胶渗透色谱图

图3 LEP-1水解的乙酰化产物的总离子流色谱图
2.2SLEP-1的硫酸取代度
硫酸根标准曲线如图4所示。

图4 硫酸根质量浓度标准曲线
回归方程为:
Y=0.018 47 X+1.999 4,R2=0.994 7。
据该方程计算得SLEP-1中—SO3H的质量分数为66.17%,从而得SLEP-1的硫酸基团取代度DS=1.97。
2.3LEP-1和SLEP-1的扫描电子显微镜分析
扫描电子显微镜图如图5所示,由图5可看出,LEP-1呈多层片状,表面较为平整,说明多糖分子间交联紧密,分子间相互作用强,且与LEP-1的高分子量的特性有关[18]。SLEP-1呈网状结构,且网孔大小不一,随着放大倍数的增加,可以看出SLEP-1也为片层状。与LEP-1相比,SLEP-1中网孔的出现可能是由于在化学修饰过程中多糖微观学的物理表象发生了变化。由此可知,用化学方法对多糖这种大分子物质进行修饰,可能使其微观学上的物理表象有一定的变化,而这种变化也可能成为对修饰结果做出判断的依据之一。

图5 LEP-1和SLEP-1的扫描电镜图
2.4LEP-1和SLEP-1的紫外和红外光谱
LEP-1和SLEP-1的紫外光谱图如图6所示。

图6 LEP-1和SLEP-1的紫外光谱图
由图6可看出,LEP-1在197 nm处有多糖的特征吸收峰,260 nm和280 nm之间无吸收峰出现,说明LEP-1中无蛋白质和核酸;SLEP-1在264 nm附近出现了一个新的宽吸收峰,是—S—O—/—SO3的特征吸收峰,即硫酸根基团的n→π*电子跃迁导致,说明硫酸酯化修饰成功[19]。
LEP-1红外光谱如图7所示,由图7可知,3 390 cm-1处的宽峰为O—H基团的振动峰[20];2 930 cm-1处的信号峰为—CH的伸缩振动峰;1 640 cm-1的信号峰说明结合水的存在[11];1 410 cm-1为C—H弯曲振动吸收峰;1 140 cm-1为—COOH的吸收峰。950~1 200 cm-1信号峰表明LEP-1中有吡喃糖[21];910 cm-1为吡喃葡萄糖环的不对称伸缩振动引起的[22];812 cm-1的特征吸收峰表明α构型多糖的存在,也可能是吡喃糖环引起的[23]。

图7 LEP-1和SLEP-1的红外光谱图
硫酸化修饰后,碳水化合物的特征峰呈现出了一定的变化。SLEP-1在2 930 cm-1的亚甲基中C—H伸缩振动峰(即单糖残基的C-6的特征吸收峰)和在1 410 cm-1的甲基和亚甲基的C—H变角振动吸收峰均比LEP-1显著减弱。这是因为C-6位上的羟基由于空间位阻较小且不参与形成稳定多糖高级结构的氢键,比较活泼[24],所以硫酸酯化通常易在C-6发生取代,从而对亚甲基的影响较大[25]。SLEP-1在1 220 cm-1处出现一个新的吸收峰,为—O—SO3H中S=O的伸缩振动峰,且在818 cm-1处有C—O—S伸缩振动吸收。
2.5LEP-1和SLEP-1的抗氧化活性
2.5.1LEP-1和SLEP-1对·OH的清除作用
邻二氮菲与Fe2+形成的络合物在536 nm处有最大吸收峰,是一种常用的氧化还原指示剂。Fenton反应产生的·OH能够氧化Fe2+-邻二氮菲络合物为Fe2+-邻二氮菲,使其最大吸收峰消失。
LEP-1和SLEP-1对·OH的清除作用如图8所示。由图8可知,LEP-1和SLEP-1对·OH均有一定的清除作用。当质量浓度小于250 mg/L时,LEP-1和SLEP-1对·OH的清除率随质量浓度的增大而升高;当质量浓度大于250 mg/L时,LEP-1 和SLEP-1对·OH的清除率升高趋势趋于平缓。但是,两者对·OH的清除率均小于对照组Vc。 LEP-1和SLEP-1对·OH的清除作用可能是通过糖醛酸与亚铁离子耦合,进而抑制·OH产生;也可能通过提供H原子,与·OH结合成水,达到清除自由基的效果[26];另有研究表明,多糖对·OH的清除作用与糖链上所携带的负电荷有关,这也解释了SLEP-1比LEP-1对·OH清除率高的原因[27]。但是,LEP-1和SLEP-1具体的抗氧化机制有待进一步验证。

图8 LEP-1和SLEP-1对·OH的清除作用
2.5.2LEP-1和SLEP-1对DPPH·的清除作用
DPPH·溶液具有特征的紫红色团吸收峰,自由基清除剂可使其单电子配对,从而使其吸收逐渐消失,其褪色程度与其所接受的电子数成定量关系。LEP-1和SLEP-1对DPPH·的清除作用如图9所示。
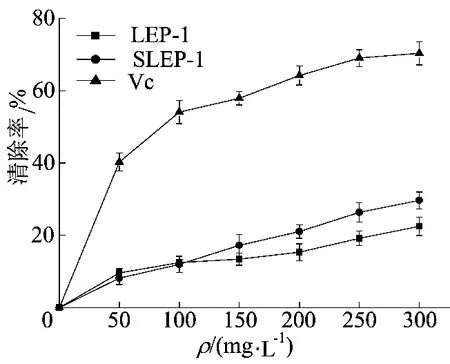
图9 LEP-1和SLEP-1对DPPH·的清除作用
由图9可知,LEP-1和SLEP-1对DPPH的清除作用逐渐增强。当质量浓度小于100 mg/L时,两者差别较小;当质量浓度大于100 mg/L时,SLEP-1对DPPH·的清除率大于LEP-1,并且差别逐渐增大。但是,两者对DPPH·的清除率均小于对照组Vc。SLEP-1具有较强的DPPH·清除能力,可能是—OSO3H基团激活了异头碳上的氢原子,且激活程度越高,供氢能力越强,抗氧化能力越强[28]。
2.5.3LEP-1和SLEP-1对O2-·的清除作用
邻苯三酚在碱性溶液中易发生自氧化反应,通过接受1个电子,生成超氧阴离子自由基和有色中间物质,随着时间的延长,有色产物得到积累,LEP-1可将O2-·歧化分解成H2O2和O2,进而抑制邻苯三酚的自氧化速率。LEP-1和SLEP-1对O2-·的清除作用如图10所示。

图10 LEP-1和SLEP-1对O2-·的清除作用
由图10可知,随着质量浓度的增加,LEP-1 和SLEP-1对O2-·的清除率均增加,并呈现一定的剂量效应关系。当质量浓度为250 mg/L时,LEP-1和SLEP-1对O2-·的清除率分别为53.85%和58.47%,且大于该质量浓度时趋于平缓。但是,SLEP-1对O2-·的清除率整体略高于LEP-1,明显低于对照组Vc。SLEP-1因为硫酸基团(吸电子基团)的存在,O—H的解离能较弱,从而为O2-·供氢,表现出较强的清除能力[29-30]。另有研究表明,硫酸酯化修饰可能打破了不舒展构象造成的羟基被包裹在分子内形成的分子内氢键,并使羟基释放出来[31],从而提高抗氧化活性。
3 结束语
本文对从粒毛盘菌YM268中分离纯化得到LEP-1,经GC-MS分析水解的乙酰化产物得出LEP-1是一种由葡萄糖和甘露糖组成的杂多糖;LEP-1的HPGPC图谱表明其分子量约为473 kDa;用三氧化硫-吡啶法测定硫酸酯化修饰后得到的SLEP-1的DS为1.97;SEM图显示硫酸酯化修饰后多糖的表面形态由多层片状变为多层网状结构。
SLEP-1对·OH、DPPH·和O2-·的清除作用比LEP-1强,且存在剂量效应关系,故LEP-1 和SLEP-1可以作为天然抗氧化剂应用到食品和医药中。LEP-1硫酸酯化修饰后抗氧化活性的增强可能是由—OSO3H的引入和原有构象的改变引起的。因此,本研究为进一步探究不同化学修饰方法对粒毛盘菌多糖的抗氧化活性的影响提供了理论依据。
[参考文献]
[1]Qiu T,Ma X,Ye M,et al.Purification,structure,lipid lowering and liver protecting effects of polysaccharide from Lachnum YM281[J].Carbohydrate Polymers,2013,98(1):922-930.
[2]Ye M,Yuan R,He Y,et al.Phosphorylation and anti-tumor activity of exopolysaccharide from Lachnum YM120[J].Carbohydrate Polymers,2013,97(2):690-694.
[3]胡顺珍,贾乐.食药用真菌多糖构效关系研究进展[J].生物技术通报,2007(4):42-44.
[4]邓超,邬敏辰.食用菌深层发酵及其多糖活性研究进展[J].安徽农业科学,2007,35(15):4622-4625.
[5]赵晓燕,王长云.分子修饰在多糖构效关系研究中的应用[J].海洋湖沼通报,2000(3):10-14.
[6]Ma L,Chen H,Zhang Y,et al.Chemical modification and antioxidant activities of polysaccharide from mushroom Inonotus obliquus[J].Carbohydrate Polymers,2012,89(2):371-378.
[7]Chen Y,Zhang H,Wang Y,et al.Sulfated modification of the polysaccharides from Ganoderma atrum and their antioxidant and immunomodulating activities[J].Food Chemistry,2015,186:231-238.
[8]孙柘,邱涛,袁如月,等.粒毛盘菌多糖脱蛋白方法及其条件优化[J].浙江大学学报:农业与生命科学版,2012,38(4):519-523.
[9]He Y L,Ye M,Jing L Y,et al.Preparation,characterization and bioactivities of derivatives of an exopolysaccharide from Lachnum[J].Carbohydrate Polymers,2015,117:788-796.
[10]Wu Y,Ye M,Du Z,et al.Carboxymethylation of an exopolysaccharide from Lachnum and effect of its derivatives on experimental chronic renal failure[J].Carbohydrate Polymers,2014,114(19):190-195.
[11]He Y,Ye M,Du Z,et al.Purification,characterization and promoting effect on wound healing of an exopolysaccharide from Lachnum YM405[J].Carbohydrate Polymers,2014,105 (25):169-176.
[12]Ye M,Qiu T,Peng W,et al.Purification,characterization and hypoglycemic activity of extracellular polysaccharides from Lachnum calyculiforme[J].Carbohydrate Polymers,2011,86 (1):285-290.
[13]田庚元,李寿桐,宋麦丽,等.牛膝多糖硫酸酯的合成及其抗病毒活性[J].药学学报,1995,30(2):107-111.
[14]李珺,钟耀广,刘长江.香菇多糖硫酸酯化修饰的研究[J].辽宁农业科学,2010(1):14-16.
[15]刘培勋,高小荣,徐文清,等.银耳碱提多糖抗氧化活性的研究[J].中药药理与临床,2005,21(4):35-37.
[16]陈吴西,蔡敬民,邱涛,等.Lachnum YM328多糖发酵条件优化及抗氧化性[J].合肥工业大学学报:自然科学版,2011,34(2):300-303,312.
[17]叶明,李世艳,杨柳,等.禾本科粒毛盘菌多糖提取及其抗氧化活性研究[J].浙江大学学报:农业与生命科学版,2009,35(2):153-157.
[18]刘阿娟,张静,张化朋,等.虎奶菇菌核多糖SHNP的分离纯化及形貌观测[J].农产品加工:学刊,2013(9):66-69.
[19]Racaud A,Allouche A R,Antoine R,et al.UV electronic excitations in acidic sugars[J].Journal of Molecular Structure:THEOCHEM,2010,960(1/2/3):51-56.
[20]Zhang T,Marchant R E.Novel polysaccharide surfactants:the effect of hydrophobic and hydrophilic chain length on surface active properties[J].Journal of Colloid and Interface Science,1996,177(2):419-426.
[21]Chen J,Yong Y,Xing M,et al.Characterization of polysaccharides with marked inhibitory effect on lipid accumulation in Pleurotus eryngii[J].Carbohydrate Polymers,2013,97(2):604-613.
[22]Chen Y,Mao W,Gao Y,et al.Structural elucidation of an extracellular polysaccharide produced by the marine fungus Aspergillus versicolor[J].Carbohydrate Polymers,2013,93(2):478-483.
[23]Wang X,Sun R,Zhang J,et al.Structure and antioxidant activity of polysaccharide POJ-U1a extracted by ultrasound from Ophiopogon japonicus[J].Fitoterapia,2012,83(8):1576 -1584.
[24]王顺春,方积年.香菇多糖硫酸化衍生物的制备及其结构分析[J].生物化学与生物物理学报,1999,31(5):594-597.
[25]Yang J,Du Y,Wen Y,et al.Sulfation of Chinese lacquer polysaccharides in different solvents[J].Carbohydrate Polymers,2003,52(4):397-403.
[26]Barahona T,Encinas M V,Mansilla A,et al.A sulfated galactan with antioxidant capacity from the green variant of tetrasporic Gigartina skottsbergii(Gigartinales,Rhodophyta)[J].Carbohydrate Research,2012,347(1):114-120.
[27]王元凤,金征宇,彭永华,等.硫酸酯化茶多糖的制备及清除羟自由基活性的研究[J].食品工业,2009(2):1-4.
[28]Wang J,Guo H,Zhang J,et al.Sulfated modification,characterization and structure-antioxidant relationships of Artemisia sphaerocephala polysaccharides[J].Carbohydrate Polymers,2010,81(4):897-905.
[29]Zhu X Y,Wu J M,Jia Z S.Superoxide anion radical scavenging ability of quaternary ammonium salt of chitosan[J].Chinese Chemical Letters,2004,15(7):808-810.
[30]Zhang Z,Wang F,Wang X,et al.Extraction of the polysaccharides from five algae and their potential antioxidant activity in vitro[J].Carbohydrate Polymers,2010,82(1):118-121.
[31]柳红.南瓜多糖的修饰、结构分析及抗氧化活性的研究[D].西安:陕西师范大学,2008.
(责任编辑闫杏丽)
Purification and sulfated modification of a Lachnum polysaccharide and evaluation of its antioxidant activity
DU Zhan-zhan1,ZHANG Qiang1,2,XU Ping1,WANG Yu-fen1,YE Ming1
(1.School of Biotechnology and Food Engineering,Hefei University of Technology,Hefei 230009,China;2.College of Biological Science and Engineering,Beifang University of Nationalities,Yinchuan 750021,China)
Abstract:A polysaccharide isolated from Lachnum(LEP)was purified,and one of its faction(LEP-1)separated with Sephadex G-100 was sulfated,named as SLEP-1.The LEP-1 and SLEP-1 were characterized by scanning electron microscope(SEM),UV and FT-IR spectra,and the antioxidant activities of them were also evaluated.The results showed that LEP-1 was a heteropolysaccharide,and consisted of glucose and mannose with the molecular weight of about 473 kDa.The degree of substitution(DS)of sulfated polysaccharide was 1.97.The SEM pictures showed that the surface morphology of LEP-1 was changed from laminar structure to reticulum after sulfation.The characteristic absorption peaks of polysaccharides appeared in the FT-IR spectrum of LEP-1,while the FT-IR spectrum of SLEP-1 also had the characteristic absorption peaks of polysaccharides,and the characteristic absorption peaks of sulfate groups of SLEP-1 appeared at 1 220 cm-1and 818 cm-1at the same time.The scavenging abilitie peaks of LEP-1 and SLEP-1 on·OH,DPPH·and O2-·were strong,the scavenging ability of SLEP-1 was stronger than LEP-1 and both of them showed a certain degree of dose-response relationship.Therefore,both of LEP-1 and SLEP-1 had obvious antioxidant activities,and they could be applied as natural antioxidant in food and pharmaceutical industries.
Key words:Lachnum;polysaccharide;modification;antioxidant activity
作者简介:杜湛湛(1990-),女,河南鹿邑人,合肥工业大学硕士生;
基金项目:国家自然科学基金资助项目(31470146)
收稿日期:2014-12-10;修回日期:2015-03-04
Doi:10.3969/j.issn.1003-5060.2016.01.025
中图分类号:Q949.32;TS201.23
文献标识码:A
文章编号:1003-5060(2016)01-0134-07

