不同剂量右美托咪定静脉泵注对切痂植皮术烧伤患者炎症反应的影响
何绮霞,卢燕,莫坚,陈翠平,庄海霞,颜振艺,张良清
(广东医学院附属医院,广东湛江524001)
不同剂量右美托咪定静脉泵注对切痂植皮术烧伤患者炎症反应的影响
何绮霞,卢燕,莫坚,陈翠平,庄海霞,颜振艺,张良清
(广东医学院附属医院,广东湛江524001)
摘要:目的探讨不同剂量右美托咪定静脉泵注对切痂植皮术烧伤患者炎症反应的影响。方法 80例ASAⅠ或Ⅱ级择期在全身麻醉下行切痂植皮术烧伤患者,随机均分为右美托咪定大剂量组(D1)、中剂量组(D2)、小剂量组(D3)(右美托咪定剂量分别为1.2、0.8、0.4 μg/kg)和对照组(C)(等量生理盐水)各20例。四组在全麻诱导前静脉分别泵注,D1组:右美托咪定1.2 μg/kg ;D2组:右美托咪定0.8 μg/kg ;D3组:右美托咪定0.4 μg/kg;C组:等量生理盐水,30 min泵注完。观察四组药物泵注开始前(T1)、手术开始(T2)、药物泵注结束后(T3)、手术结束(T4)时患者心率(HR)、平均动脉压(MAP),并留置T1~T4时静脉血,检测血浆IL-1、IL-6和TNF-α水平。结果与C组比较,T2、T3、T4时D1、D2、D3组MAP明显降低,HR明显减慢,IL-1、IL-6和TNF-α水平降低(P均<0.05);与D3组相比,D1组和D2组在T2、T3、T4时点的IL-1、IL-6和TNF-α水平降低(P均<0.05);与D2组相比,D1组在T2、T3、T4时的IL-1、IL-6和TNF-α水平降低(P均<0.05)。结论 不同剂量右美托咪定静脉泵注能抑制切痂植皮术烧伤患者炎症反应,并且其抑制作用具有剂量依赖性。
关键词:烧伤;右美托咪定;切痂植皮术;炎症反应
烧伤患者早期最显著的变化是血管收缩、血管内皮细胞缺氧受损、血管通透性改变、血浆外渗致血容量不足,严重者可导致多种脏器损伤,其中炎症反应是主要病理生理改变。右美托咪定是一种高选择性的ɑ2肾上腺素能受体激动剂,具有抗交感、镇静、遗忘和镇痛等作用,常用于围术期和重症监护室的镇静治疗。最近国外研究[1~5]报道,右美托咪定还具有保护脏器及抗炎作用。本研究拟探讨不同剂量右美托咪定对围术期切痂植皮术烧伤患者炎症反应的影响。
1资料与方法
1.1临床资料选择2014年1月~2015年6月在我院择期行切痂植皮术烧伤患者80例,烧伤时间5~10 d,年龄20~60岁,ASAⅠ或Ⅱ级,排除严重的心血管和呼吸系统疾病、术前有窦性心动过缓、房室传导阻滞者。随机均分为四组:右美托咪定大剂量组(D1)、中剂量组(D2)、小剂量组(D3)和对照组(C),每组20例。各组年龄、性别有可比性。
1.2手术方法将手术刀与基底创面呈30°~45°紧贴真皮切除烧伤坏死组织,保留肉眼可见的未栓塞的静脉及浅筋膜,取下患者正常头部的皮肤,种植到已去除痂皮的创口上,覆盖创口,并缝合固定,加压包扎。
1.3麻醉管理四组患者术前30 min肌注苯巴比妥钠2 mg/kg,进入手术室后监测BP、RR、ECG、SpO2、呼吸末二氧化碳分压,监测鼻温,建立静脉通道,局麻下行动脉穿刺测压,D1、D2、D3组分别静脉泵注右美托咪定1.2、0.8、0.4 μg/kg,C组静脉泵注生理盐水,30 min内泵注完。四组麻醉诱导均依次静注咪唑安定0.02 mg/kg、依托咪酯0.3 mg/kg、芬太尼4 μg/kg,后给予阿曲库铵0.6 mg/kg,达到气管插管条件后经口气管内插管,连接麻醉机控制呼吸,呼吸频率11~14次/min,潮气量8~10 mL/kg,吸呼比1∶2,四组均用微量泵持续静注丙泊酚150 μg/(kg·min)进行麻醉维持,由手术时间长短决定手术过程中是否追加芬太尼及阿曲库铵,术毕前5 min停药,术毕送麻醉恢复室,若患者术中的血压、心率高于或低于基础值的30%,给予麻黄素、阿托品等处理并从统计结果中排除。
1.4观察指标记录患者的一般情况,包括年龄、体质量、麻醉及手术时间,测定并记录药物泵注开始前(T1)、手术开始(T2)、药物泵注结束后(T3)、手术结束(T4)患者心率(HR)、平均动脉压(MAP),并留置T1~T4时静脉血,采用ELISA法检测血浆IL-1、IL-6和TNF-α水平。
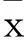
2结果
2.1四组年龄、体质量、手术时间及麻醉时间比较 四组年龄、体质量、手术时间及麻醉时间比较差异无统计学意义(P均>0.05)。见表1。

表1 四组年龄、体质重、手术时间及麻醉
2.2四组不同时点MAP及HR比较见表2。与C组比较,T2、T3、T4时D1、D2、D3组MAP明显降低、HR明显减慢(P均<0.05)。
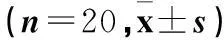
表2 四组不同时点MAP、HR比较
注:与C组同时间比较,*P<0.05。
2.3四组不同时点IL-1、IL-6和TNF-α水平比较见表3。与C组比较, T2、T3、T4时D1、D2、D3组IL-1、IL-6和TNF-α水平降低(P均<0.05)。与D3组相比,D1组和D2组T2、T3、T4的IL-1、IL-6和TNF-α水平降低(P均<0.05);与D2组相比,D1组T2、T3、T4的IL-1、IL-6和TNF-α水平降低 (P均<0.05)。
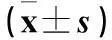
表3 四组不同时点IL-1、IL-6和TNF-α水平比较
注:与C组同时间比较,*P<0.05;与D3组同时间比较,△P<0.05;与D2组同时间比较,▲P<0.05。
3讨论
烧伤患者早期控制感染可提高创伤后生存率,烧伤后创面局部炎症细胞活化后释放大量细胞因子(IL-1、IL-6、TNF-α),激活周围巨噬细胞参与局部及全身的炎症反应[6];同时烧伤后机体神经内分泌反应增强,体内高水平儿茶酚胺进一步激化炎症反应,影响烧伤患者的生存和预后[7]。从创面局部来看,烧伤后创面周围的中性粒细胞被激活,炎症因子过度释放,导致局部组织水肿及缺血坏死。从全身炎症反应来看,体表局部的创伤通过炎症因子激惹远端的肠管,导致肠系膜淋巴结释放促炎因子,扩大炎症反应的范围[8,9]。在烧伤患者的治疗中,早期控制创面的炎症,阻断炎症信号转导,限制炎症向远端器官扩散,及时进行切痂植皮术有助于创面愈合。
Venn等[10]在对比右美托咪定和丙泊酚镇静治疗时发现,右美托咪定组患者血浆IL-6水平明显下降,从此学者们开始关注右美托咪定抑制炎症的作用。目前认为右美托咪定通过以下几种途径抑制炎症:①阻断内毒素活化的巨噬细胞中NF-κB核移位,抑制高迁移族蛋白mRNA的表达,降低脓血症患者的病死率[11];②激活α2-肾上腺素能受体,通过Erk和PI3K/Akt细胞信号转导通路,促使Erk1/2、Akt和eNOS磷酸化,在缺血-再灌注损伤中对受损部位起到保护作用[12];③激活α2-肾上腺素能受体,对去甲肾上腺素通路产生突触前抑制,减少去甲肾上腺素释放,调节局部血流分布,降低器官的缺血-再灌注损伤[13]。本研究选择经历过烧伤“一次打击”的患者作为研究对象,给予右美托咪定预处理后再切痂植皮术“二次打击”,观察不同剂量右美托咪定对围术期烧伤患者切痂植皮术炎症反应的影响,实验结果显示,与C组比较,在T2、T3、T4时D1、D2、D3组MAP明显降低,HR明显减慢,IL-1、IL-6和TNF-α水平降低,说明在T2、T3、T4时,三组不同剂量的右美托咪定均能抑制烧伤患者机体过强的神经内分泌反应,体内分泌儿茶酚胺较C组减少,临床表现为MAP明显降低,HR明显减慢,炎症反应因子也分泌减少;与D3组相比,D1组和D2组T2、T3、T4的IL-1、IL-6和TNF-α水平降低;与D2组相比,D1组T2、T3、T4的IL-1、IL-6和TNF-α水平降低,提示不同剂量的右美托咪定都有抗炎作用,并且随着右美托咪定用量增大,血浆炎症因子IL-1、IL-6和TNF-α水平越来越低,证明其抗炎作用具有剂量依赖性。
综上所述,不同剂量右美托咪定静脉泵注能抑制切痂植皮术烧伤患者炎症反应,使炎症因子IL-1、IL-6和TNF-α分泌减少,并且其抑制作用具有剂量依赖性。
参考文献:
[1] Ibacache M, Sanchez G, Pedrozo Z, et al. Dexmedetomidine preconditioning activates pro-survival kinases and attenuates regional ischemia/reperfusion injury in rat heart[J]. Biochim Biophys Acta, 2012,1822(4):537-545.
[2] Yan M, Dai H, Ding T, et al. Effects of dexmedetomidine on the release of glial cell line-derived neurotrophic factor from rat astrocyte cells[J]. Neurochem Int, 2011,58(5):549-557.
[3] Zhang XY, Liu ZM, Wen SH, et al. Dexmedetomidine administration before, but not after, ischemia attenuates intestinal injury induced by intestinal ischemia-reperfusion in rats[J]. Anesthesiology, 2012,116(5):1035-1046.
[4] Tasdogan M, Memis D, Sut N, et al. Results of a pilot study on the effects of propofol and dexmedetomidine on inflammatory responses and intraabdominal pressure in severe sepsis[J]. J Clin Anesth, 2009,21(6):394-400.
[5] Taniguchi T, Kurita A, Kobayashi K, et al. Dose- and time-related effects of dexmedetomidine on mortality and inflammatory responses to endotoxin-induced shock in rats[J]. J Anesth, 2008,22(3):221-228.
[6] Jeschke MG, Gauglitz GG, Kulp GA, et al. Long-term persistance of the pathophysiologic response to severe burn injury[J]. PLoS ONE, 2011,6(7):e21245.
[7] Kulp GA, Herndon DN, Lee JO, et al. Extent and magnitude of catecholamine surge in pediatric burned patients[J]. Shock, 2010,33(4):369-374.
[8] Munster BC, Aronica E, Zwinderman AH, et al. Neuroinflammation in delirium: a postmortem case-control study[J]. Rejuvenation Res, 2011,14(6):615-622.
[9] Gool WAV, Beek DVD, Eikelenboom P. Systemic infection and delirium:when cytokines and acetylcholine collide[J]. Lancet, 2010,375(9716):773-775.
[10] Venn RM, Grounds RM. Comparison between dexmedetomidine and propofol for sedation in the intensive care unit: patient and clinician perceptions[J]. Br J Anaesth, 2001,87(5):684-690.
[11] Chang Y, Huang X, Liu Z, et al. Dexmedetomidine inhibits the secretion of high mobility group box 1 from lipopolysaccharide-activated macrophages in vitro[J]. J Surg Res, 2013,181(2):308-314.
[12] Lantos J, Földi V, Idi V, et al. Burn trauma induces early HMGB1 release in patients: its correlation with cytokines[J]. Shock, 2010,33(6):562-567.
[13] Yoshitomi O, Cho S, Hara T, et al. Direct protective effects of dexmedetomidine against myocardial ischemia-reperfusion injury in anesthetized pigs[J]. Shock, 2012,38(1):92-97.
(收稿日期:2015-07-29)
中图分类号:R644
文献标志码:B
文章编号:1002-266X(2016)01-0089-03
doi:10.3969/j.issn.1002-266X.2016.01.035
通信作者:莫坚(E-mail:249110951@qq.com)
基金项目:广东省湛江市科技攻关计划项目(2015B01088);广东医学院科研基金项目(M2014040)。

