唑来膦酸联合培美曲塞对肺腺癌细胞的体外抗肿瘤作用
周洋,邹华伟
(中国医科大学附属盛京医院,沈阳110022)
唑来膦酸联合培美曲塞对肺腺癌细胞的体外抗肿瘤作用
周洋,邹华伟
(中国医科大学附属盛京医院,沈阳110022)
摘要:目的探讨唑来膦酸联合细胞毒性药物培美曲塞是否有协同抗肺肿瘤作用。方法 将不同浓度(0.1、0.5、1、5、10、50、100 μg/mL)唑来膦酸和不同浓度(0.001、0.01、0.1、1、10、100 μg/mL)培美曲塞以及两药联合(1、10 μg/mL唑来膦酸+0.01 μg/mL培美曲塞)作用于体外培养的A549肺腺癌细胞株24、48、72 h,采用MTT法检测细胞生长抑制率,流式细胞术检测细胞凋亡率。透射电子显微镜观察细胞形态学改变。结果唑来膦酸及培美曲塞单药对A549细胞株生长有抑制作用,呈剂量-时间依赖性(P均<0.05);唑来膦酸联合培美曲塞能够增强对细胞增殖的抑制作用(P<0.05)。两药联合用药时的细胞凋亡率高于单药(P均<0.05)。结论 唑来膦酸及培美曲塞对A549细胞株均具有生长抑制及诱导凋亡作用,二者联用有协同抗肺肿瘤作用。
关键词:肺肿瘤;唑来膦酸;培美曲塞;细胞凋亡
肺癌已经成为我国癌症相关死亡的首要病因,占所有癌症死亡的22.7%,到2025年可能会达到100万[1]。目前,针对肺癌的治疗手段主要包括化疗、放疗和外科手术治疗等。临床资料显示,肺癌骨转移占晚期肺癌患者的50%~70%[2]。肺癌发生骨转移后1年生存率为5.3%,2年生存率为2.1%,很少超过3年,是造成肺癌死亡的重要原因[3]。唑来膦酸是第三代含氮的杂环双膦酸盐药物,是第一个被证实对所有类型恶性肿瘤骨转移均有广谱疗效的双磷酸盐药物[4]。临床前研究[5]提示,唑来膦酸除了对骨吸收有抑制作用外,还具有直接的体内外抗肿瘤作用,可诱导肿瘤细胞凋亡,抑制其增殖和侵袭。研究[6]发现唑来膦酸可使癌症患者生存期受益,但其直接抗肿瘤作用及机制尚待进一步的研究阐明。2011年4月~2013年12月,我们进行了唑来膦酸对A549肺腺癌细胞株生长抑制和凋亡作用的体外实验,并观察其与培美曲塞联用是否具有协同抗肿瘤作用。
1材料与方法
1.1材料细胞系:人肺腺癌细胞株A549由中国医科大学肿瘤研究所惠赠。A549细胞株接种于含10%胎血清的RPMI1640培养基中,置5%CO2、饱和湿度、37 ℃培养箱中培养。细胞贴壁生长,以0.125%的胰蛋白酶消化传代,每1~2天换液1次。唑来膦酸(商品名择泰)由瑞士诺华公司馈赠,培美曲塞(商品名力比泰)由美国礼来公司馈赠,四甲基偶氮唑蓝(MTT)、二甲基亚砜(DMSO)购自美国Sigma公司,RPMI1640细胞培养液、胎牛血清(FBS)购自美国Hyclone公司,凋亡试剂盒(AnnexinV/PI)购自北京宝赛试剂公司,细胞培养箱购自日本SANYO公司,流式细胞仪购自美国Becton Dickson公司,酶联免疫测定仪购自美国BIORAD公司。
1.2细胞生长抑制率的检测取对数生长期的A549细胞,调节细胞浓度为每孔1×106/mL,接种于96孔培养板,每孔加液量200 μL。分别加入用去离子水溶解的不同浓度的唑来膦酸:0.1、0.5、1、5、10、50、100 μmol/L以及不同浓度的培美曲塞:0.001、0.01、0.1、1、10、100 μg/mL,不加药组为空白对照,各设3个复孔。分别继续培养24、48、72 h后加入MTT试剂(5 mg/mL)20 μL,空白调零组加入PBS液20 μL,继续培养4 h后吸出上清,每孔加DMSO溶液150 μL,置水平摇床上摇15 min。在酶联免疫测定仪上选择波长490 nm,空白孔调零,测定各孔波长490 mm处的吸光度(A)。计算细胞生长抑制率,抑制率=(1-实验组A平均值/对照组A平均值)×100%。根据实验结果取唑来膦酸IC50浓度及培美曲塞IC20浓度,用相同方法测定唑来膦酸联合培美曲塞作用72 h对肺癌A549细胞的生长抑制率。
1.3细胞凋亡率的测算 采用流式细胞术。取对数生长期的A549细胞,以1×106/mL细胞数接种于培养瓶中,24 h后换液。设对照组(不加药物,只加入等体积的溶剂)、唑来膦酸组(10 μmol/L)、培美曲塞组(0.01 μg/mL),以及唑来膦酸(10 μmol/L)+培美曲塞(0.01 μg/mL)组(联合组)。每组均重复3瓶。继续培养72 h后收集所有悬浮及贴壁细胞,药物作用72 h后,收集四组细胞,根据Annexin V-FITC试剂盒使用说明分离细胞,加入Annexin V-FITC 10 μL混匀,常温避光反应15 min,再加入300 μL结合缓冲液以及5 μL PI染料,各组细胞用流式细胞仪分别进行检测并计算凋亡率。
1.4细胞形态的观察取对数生长期的A549细胞,以1×106/mL细胞数接种于培养瓶中,24 h后换液。分组及处理同1.3。Hanks液清洗各处理组细胞1次,胰酶消化,用4 ℃离心机收集细胞,用0.1 mmol/L PBS液漂洗两次;细胞悬浮于2.5%戊二醛中固定30 min,PBS液漂洗两次;细胞悬浮于1%锇酸中固定1 h,再用0.1 mmol/L PBS液漂洗两次;4%醋酸铀水溶液染色30 min,50%、70%和90%乙醇依次脱水各15 min,100%乙醇脱水20 min,100%丙酮脱水20 min两次;将细胞置于无水丙酮包埋剂(1∶1)中置换30 min,并振荡2 h;包埋剂纯浸2 h,纯包埋剂包埋;并置烘箱内聚合,37 ℃中24 h,45 ℃中24 h,60 ℃中48 h。超薄切片(约120 nm),4%醋酸铀染色20 min,枸橼酸铅染色5 min。高压80 kV透射电子显微镜下观察和照相。
2结果
2.1不同浓度唑来膦酸对肺腺癌A549细胞系生长的抑制作用与空白对照比较,不同浓度的唑来膦酸能够抑制肿瘤细胞生长,且呈时间依赖性及剂量依赖性(P均<0.05)。唑来膦酸对A549细胞作用72 h的IC50值为12.092 μmol/L。见表1。
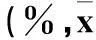
表1 不同浓度唑来磷酸不同时间对A549细胞
注:与空白对照比较,*P﹤0.05;其余不同时间、不同浓度唑来膦酸之间两两比较,P均﹤0.05。
2.2 不同浓度培美曲塞对肺腺癌A549细胞系生长的抑制作用随着药物浓度的增加及作用时间的延长,培美曲塞对A549细胞的生长抑制率逐渐增加(P均<0.05),培美曲塞对A549细胞作用72 h的IC20值为0.098 μg/mL。见表2。
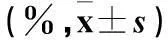
表2 不同浓度培美曲塞不同时间对A549细胞体外生长
注:与空白对照比较,*P﹤0.05;其余不同时间、不同浓度培美曲塞之间两两比较,P均﹤0.05。
2.3 唑来膦酸和(或)培美曲塞对A549细胞的生长抑制作用见表3。
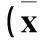
表3 唑来磷酸和(或)培美曲塞对A549细胞的
注:与空白对照比较,*P﹤0.05;与相应单药比较,#P﹤0.05。
2.4各组细胞凋亡率比较唑来膦酸组药物作用72 h后,细胞凋亡率为17.4%,培美曲塞组细胞凋亡率为29.3%,联合组细胞凋亡率为41.7%,联合组细胞凋亡率高于唑来膦酸和培美曲塞组(P均<0.05)。
2.5各组细胞形态学表现对照组细胞形态大小正常,核膜完整,染色质无浓缩、边聚,细胞器多,胞膜表面皱褶较多;唑来膦酸组、培美曲塞组、联合组均呈现凋亡期形态学改变:胞质浓缩、细胞器明显减少、胞质空泡化,胞膜表面皱褶减少、胞膜完整、核型不规则,染色质固缩成块、聚在核膜周边或散落在细胞核内。
3讨论
唑来膦酸治疗非小细胞肺癌骨转移可显著延迟骨相关事件出现、降低骨相关事件风险,是惟一被批准用作有效预防或延缓肺癌骨转移(包括溶骨和成骨)骨相关事件发生的药物。其主要作用机制是抑制破骨细胞活性、骨吸收、破骨细胞向肿瘤病变部位的募集和黏附,抑制焦磷酸盐合成酶,阻止破骨细胞分化、诱导其凋亡[7]。最近的动物实验与临床前实验研究表明,唑来膦酸不仅是一个治疗骨转移的药物,其对乳腺癌、肾癌、肺癌等肿瘤还有直接的抗肿瘤作用[8]。近年研究[9]发现,唑来膦酸既有影响肿瘤细胞的黏附与入侵、增殖、凋亡的直接作用,又有抗血管生成、对γδT细胞的免疫调节作用,抑制甲羟戊酸途径的间接作用,并能以协同作用方式增强细胞毒化疗药物的抗肿瘤作用。
本研究结果表明,唑来膦酸对肺癌A549细胞的生长具有抑制作用,且呈时间和剂量依赖性。流式细胞仪检测结果提示唑来膦酸具有诱导肺癌A549细胞凋亡的作用。这种作用在乳腺癌、肾癌、骨肉瘤等细胞株研究中已有报道[10]。就目前所知,唑来膦酸是通过抑制甲羟戊酸途径中的小GTP酶的异戊烯化,从而影响下游信号的传导。唑来膦酸抑制Ras基因的法尼基化,阻止其和细胞膜相互作用,下调Ras信号系统[11]。最近研究发现,含氮双磷酸盐还可以诱导一种独特的三磷酸腺苷类似物Apppi产生,其可以直接诱导细胞凋亡[12]。另外Mahtani等[13]报道,唑来膦酸对肾癌细胞株的凋亡是依赖Caspase途径引发凋亡,但诱导凋亡经常不总是伴随Caspase激活。Aoyagi等[14]在唑来膦酸治疗骨肉瘤细胞中发现了一种新的诱导凋亡机制,不依赖于Caspase的激活,细胞死亡伴随着Bax增多、Bcl-2表达减少、细胞凋亡诱导因子和核酸内切酶G移位 。Li等[15]研究证实,唑来膦酸对肺癌95D细胞的增殖抑制作用是通过细胞凋亡相关基因ERK、Bcl-2和survivin的表达水平下降,Bax的表达水平增高而实现的。国内外研究表明,唑来膦酸对肺癌也可能具有直接的抗肿瘤作用,但确切的机制还有待进一步探讨。
化疗在肺癌的治疗中占重要地位,是肺癌全身治疗中最为成熟的方法。有研究[16]结果提示,尽管新的化疗药物不断问世,第3代含铂方案仍不能明显改善晚期肺癌患者的生存期,中位生存时间为7.4~8.3个月,1年生存率为31%~36%。培美曲塞是一种具有多个作用靶点的新型抗叶酸代谢类药物,通过抑制嘧啶和嘌呤合成过程中的多种酶,发挥抑制肿瘤DNA合成的作用,特别是非鳞状细胞癌非小细胞肺癌(NSCLC)。2004年,培美曲塞被收入ESMO、ASCO、NCCN发表的NSCLC治疗指南,目前已被批准单药维持治疗非鳞状细胞癌NSCLC,与顺铂联用作为晚期非鳞状细胞癌NSCLC的一线化疗药。本实验研究结果显示,不同浓度的唑来膦酸及培美曲塞均对肺腺癌细胞A549具有明显的生长抑制作用和诱导凋亡作用,呈剂量和时间依赖性,且唑来膦酸与培美曲塞联合组上述作用明显增强。提示唑来膦酸联合细胞毒药物培美曲塞对A549细胞具有协同抗肿瘤作用。
参考文献:
[1] Msph LAT, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. Ca A Cancer, 2015,65(2):87-108.
[2] Brodowicz T, O'Byrne K, Manegold C. Bone matters in lung cancer[J]. Ann Oncol, 2012,23(9):2215-2222.
[3] Xue C, Hu Z, Jiang W, et al. National survey of the medical treatment status for non-small cell lung cancer (NSCLC) in China[J]. Lung Cancer, 2012,77(2):371-375.
[4] Xuan M, Yang J, Li Y, et al. Effects of Zoledronic acid and tibolone on bone mineral density, indexes of bone metabolism, and the risk of fracture in patients with postmenopausal osteoporosis[J]. Chin J Endocrinol Metab, 2013,29(6):504-508.
[5] 李丽,钱晓萍,刘宝瑞.双膦酸盐类药物直接与间接抗肿瘤作用研究进展[J].江苏医药,2012,38(1):82-85.
[6] Aft R, Naughton M, Trinkaus K, et al. Effect of zoledronic acid on disseminated tumour cells in women with locally advanced breast cancer:an open label, randomised, phase 2 trial[J]. Lancet Oncology, 2010,11(5):421-428.
[7] Scagliotti GV, Hirsh V, Siena S, et al. Overall survival improvement in patients with lung cancer and bone metastases treated with denosumab versus zoledronic acid: subgroup analysis from a randomized phase 3 study[J]. J Thorac Oncol, 2012,7(12):1823-1829.
[8] Lu S, Zhang J, Zhou Z, et al. Synergistic inhibitory activity of zoledronate and paclitaxel on bone metastasis in nude mice[J]. Oncol Rep, 2008,20(3):581-587.
[9] Yoh K, Kubota K, Ohmatsu H, et al. Feasibility study of zoledronic acid plus cisplatin-docetaxel as first-line treatment for advanced non-small cell lung cancer with bone metastases[J]. Anticancer Res, 2012,32(9):4131-4135.
[10] Zaghloul MS, Boutrus R, El-Hossieny H, et al. A prospective, randomized, placebo-controlled trial of zoledronic acid in bony metastatic bladder cancer[J]. Int J Clin Oncol, 2010,15(4):382-389.
[11] Neville-Webbe HL, Gnant M, Coleman RE. Potential anticancer properties of bisphosphonates[J]. Semin Oncol, 2010,37(Suppl 1):S53-S65.
[12] Hirsh V. Targeted treatments of bone metastases in patients with lung cancer[J]. Front Oncol, 2014,4:146.
[13] Mahtani R, Khan R, Jahanzeb M. The potential application of zoledronic acid as anticancer therapy in patients with non-small-cell lung cancer[J]. Clin Lung Cancer, 2011,12(1):26-32.
[14] Aoyagi T, Morii T, Ohtsuka K, et al. Lung cancer cell line sensitivity to Zoledronic acid is BAX-dependent[J]. Anticancer Res, 2013,33(12):5357-5363.
[15] Li M, Zhang W, Zong Z, et al. Inhibition of Zoledronic acid on cell proliferation and invasion of lung cancer cell Line 95D[J]. Zhongguo Fei Ai Za Zhi, 2009,12(3):198-202.
[16] Murakami H, Yamanaka T, Seto T, et al. Phase Ⅱ study of zoledronic acid combined with docetaxel for non-small-cell lung cancer: West Japan Oncology Group[J]. Cancer Sci, 2014,105(8):989-995.
(收稿日期:2015-08-04)
中图分类号:R734.2
文献标志码:A
文章编号:1002-266X(2016)01-0035-03
doi:10.3969/j.issn.1002-266X.2016.01.012
通信作者:邹华伟(E-mail:zouhw@sj-hospital.org)

