普伐他汀对人胰腺癌细胞SW1990增殖的抑制作用及其机制
张敏,孔雁,姜达
(1邢台市人民医院,河北邢台054001;2河北医科大学附属第四医院)
普伐他汀对人胰腺癌细胞SW1990增殖的抑制作用及其机制
张敏1,孔雁2,姜达2
(1邢台市人民医院,河北邢台054001;2河北医科大学附属第四医院)
摘要:目的探讨普伐他汀对人胰腺癌细胞SW1990增殖的抑制作用及其机制。方法 分别用含普伐他汀0、1、5、10、15、20、25、50 μmol/L的RPMI1640培养基培养人胰腺癌细胞SW1990,24、48、72、96 h后采用MTT比色法检测细胞抑制率,以观察普伐他汀对SW1990细胞增殖的影响。48 h后采用流式细胞仪测定细胞周期分布并测算细胞增殖指数(PI),以观察0、5、10、20 μmol/L普伐他汀对SW1990细胞周期分布和凋亡的影响,光学显微镜下观察细胞形态学改变,流式细胞仪及间接免疫荧光技术分析普伐他汀作用后SW1990细胞p21Ras、细胞周期蛋白激酶4(CDK4)、Bax蛋白表达的变化。结果普伐他汀(1、5、10、15、20、25、50 μmol/L)对SW1990细胞具有抑制增殖的作用,有明显的剂量-效应和时间-效应依赖关系(P均<0.05)。普伐他汀作用SW1990细胞后,有明显的细胞形态学改变。0、5、10、20 μmol/L普伐他汀作用SW1990细胞48 h后,随药物浓度增大, G0/G1期细胞逐渐增多; S期和G2/M期细胞则逐渐减少(P均<0.05)。0、5、10、20 μmol/L普伐他汀处理细胞48 h后,出现典型的亚二倍体凋亡峰,依普伐他汀浓度增大而逐渐升高;细胞凋亡率分别为1.06%、6.24%、12.46%、17.21%。0、5、10、20 μmol/L普伐他汀处理SW1990细胞48 h后,p21Ras、CDK4的荧光指数FI值随处理浓度增大而逐渐降低;Bax的FI值则随处理浓度增大而逐渐升高(P均<0.05)。结论 普伐他汀可通过下调p21Ras、CDK4蛋白的表达和上调Bax蛋白的表达而发挥其抑制胰腺癌细胞SW1990增殖、诱导该细胞凋亡的作用。
关键词:胰岛肿瘤;普伐他汀;细胞增殖;细胞凋亡;SW1990
胰腺癌是消化道常见的恶性肿瘤[1]。其起病隐袭,缺乏特异症状和体征,恶性度极高。他汀类药物是内源性胆固醇合成的限速酶-羟甲基戊二酸单酰辅酶A(HMG-CoA)还原酶的竞争性抑制剂,能有效抑制胆固醇合成及阻碍甲羟戊酸(MVA)途径,临床普遍用于治疗和预防高脂血症和其他心血管事件。近年研究发现,他汀类药物能抑制多种肿瘤细胞增殖、诱导肿瘤细胞凋亡。2011年12月~2013年12月,本实验通过研究普伐他汀对SW1990细胞的体外作用及其相关机制,旨在为临床治疗胰腺癌提供理论依据。
1材料与方法
1.1材料细胞系及细胞培养:人胰腺癌细胞株SW1990购自中国科学院上海细胞所。将SW1990细胞培养于含体积分数为10%胎牛血清的RPMI 1640培养基(含青霉素100 U/mL,链霉素100 U/mL)中,置于37 ℃、饱和湿度、5% CO2的培养箱内常规传代培养。取对数生长期细胞,经处理后调整适宜细胞浓度,以台酚蓝测定细胞活力在95%以上备用。普伐他汀为中国药品生物制品鉴定所产品,将普伐他汀标准品用无水乙醇溶解,加0.1 mol/L的NaOH激活,水浴滴定后,配制成1 mmol/L。MTT溶液用pH值7.4的0.1 mol/L的PBS配制成5 mg/mL,分装保存。鼠抗人单克隆抗体p21Ras、鼠抗人单克隆抗体细胞周期蛋白激酶4(CDK4)、鼠抗人单克隆抗体Bax均为美国Santa Cruz Biotechnology公司产品。

1.3SW1990细胞形态学观察将SW1990细胞以4×105/瓶接种于25 mL培养瓶中,待细胞贴壁后, 用含普伐他汀0、5、10、20 μmol/L的RPMI1640培养基换液,继续培养24~72 h,分别于不同时相点在倒置显微镜下观察细胞形态,并随机拍照。
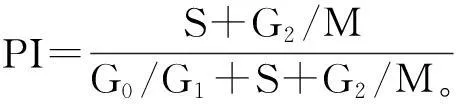


2结果
2.1不同浓度普伐他汀不同时间对SW1990细胞增殖的影响见表1。

表1 不同浓度普伐他汀不同时间对SW1990细胞增殖的影响±s)
注:与0 μmol/L普伐他汀比较,*P<0.05 ,**P<0.01。
2.2细胞形态学观察结果光学显微镜下可见,未加普伐他汀组细胞数目较多,形态规则,呈长条形贴壁生长。在普伐他汀作用下,SW1990细胞缩小呈纺锤状,两端各有一细长的伪足。随普伐他汀浓度增大和作用时间延长,这种变化逐渐明显,SW1990细胞渐变圆,贴壁细胞减少,脱落细胞增多。同时,可见到细胞凋亡的形态学改变:细胞皱缩、破裂呈不规则形,在细胞周围有放射状分布的点片状细胞碎片,有的细胞质中出现空泡。随药物浓度增加和作用时间延长,细胞破碎增多,培养基中可见到大量细胞碎片。
2.3不同浓度普伐他汀对SW1990细胞周期分布和凋亡的影响不同浓度普伐他汀对SW1990细胞周期分布的影响见表2。SW1990细胞经不同浓度普伐他汀处理48 h后,流式细胞仪测得典型的亚二倍体凋亡峰,随普伐他汀浓度增大而逐渐升高; 0、5、10、20 μmol/L普伐他汀处理SW1990细胞48 h后,凋亡率分别为1.06%、6.24%、12.46%、17.21%。

表2 不同浓度普伐他汀对SW1990细胞周期
注:与0 μmol/L普伐他汀比较,*P<0.05 ,**P<0.01。
2.4不同浓度普伐他汀对SW1990细胞p21Ras、CDK4、Bax蛋白表达的影响见表3。
表3 不同浓度普伐他汀对SW1990细胞p21Ras、
注:与0 μmol/L普伐他汀比较,*P<0.05 ,**P<0.01。
3讨论
近年研究发现,他汀类药物具有抑制肿瘤细胞增殖[2,3]、抑制VEGF表达从而具有抗肿瘤血管生成[4]、诱导肿瘤细胞分化和凋亡、降低肿瘤细胞侵袭与转移能力[5]及放化疗增敏、逆转耐药[6]等作用。他汀类药物在胰腺癌的作用日益受到重视,一些临床研究也证实他汀类药物能延长可切除胰腺癌患者的生存期[7]、降低胰腺癌的患病风险[8]、协同进展期胰腺癌化疗增敏作用。
Ras是20世纪80年代发现的第一个癌基因,广泛存在于动物和酵母细胞中。Bos等认为Ras和肿瘤的发生及肿瘤细胞的异常增殖相关。国外研究发现,应用他汀类药物后膜结合的Ras蛋白减少,而胞质中的Ras蛋白含量增加[9]。杨士杰等报道,辛伐他汀能阻滞p21Ras蛋白锚定于肝癌细胞SMMC-7721的细胞膜上,使膜表面的p21Ras蛋白水平下降。本实验中, 普伐他汀作用SW1990细胞后, 具有抑制SW1990细胞增殖及诱导该细胞凋亡的作用,此作用随药物浓度增加和处理时间延长而增强。流式细胞技术检测发现, 随普伐他汀抗增殖作用和诱导凋亡作用的增强,SW1990细胞膜表面p21Ras蛋白水平进行性下降。说明他汀类药物能通过靶向抑制HMG-CoA还原酶及MVA途径,干扰Ras蛋白的膜定位从而阻滞Ras功能的正常发挥,产生抑制肿瘤细胞增殖并诱导其凋亡的作用。
细胞周期调控机制涉及细胞周期蛋白(cyclins)、细胞周期蛋白依赖性激酶(CDKs)及细胞周期依赖性激酶抑制剂(CKIs)等。细胞周期调控的核心是cyclins和CDKs结合形成的丝/苏氨酸蛋白激酶复合体的激活。大量研究显示,他汀类药物能阻滞多种肿瘤细胞周期进程于G1期,同时伴有cyclins、CDKs的表达降低,CKIs p21和p27水平升高。在本实验中,我们发现普伐他汀可阻滞SW1990细胞于G1期,同时引起细胞内CDK4蛋白表达以一种剂量依赖性方式下降。推测普伐他汀作用SW1990细胞后,CDK4表达降低,某些p21家族和(或)p16家族的CDIs制剂水平升高,与CDK4-cyclinD结合增强,抑制其活性,阻止pRb蛋白磷酸化,从而阻滞细胞周期于G1期,介导了SW1990细胞的增殖受抑和凋亡发生。
近年来,细胞凋亡与肿瘤的关系逐渐得到人们的认识和重视。Bcl-2家族是目前最重要的调控细胞凋亡的基因家族,其成员可分为两大类:凋亡抑制基因(Bcl-2、Bcl-xL、Mcl-1等)和促凋亡基因(Bax、Bad、Bak等)。Bcl-2是重要的抑制肿瘤细胞凋亡的基因,而Bax和Bcl-2的作用相反。一般认为Bax基因和 Bcl-2基因两者表达水平之间的平衡与否,决定了细胞是否凋亡。许多研究者认为他汀类药物通过上调Bax基因表达和下调Bcl-2基因表达,介导了多种肿瘤细胞的线粒体凋亡通路。本实验结果发现,普伐他汀可诱导SW1990细胞发生凋亡, 该作用呈剂量依赖关系。0、5、10、20 μmol/L普伐他汀作用细胞48 h后,随着浓度增加,Bax表达上调, 推测Bax基因的过表达是普伐他汀诱发SW1990细胞凋亡的机制之一。
总之,普伐他汀可通过下调p21Ras、CDK4蛋白的表达和上调Bax蛋白的表达而发挥其抑制胰腺癌细胞SW1990增殖、诱导该细胞凋亡的作用。
参考文献:
[1] Siegel R, Naishadham D, Jemal A. Cancer statistics, 2012[J]. CA Cancer J Clin, 2012,62(1):10-29.
[2] Shen YY, Yuan Y, Du YY, et al. Molecular mechanism underlying the anticancer effect of simvastatin on MDA-MB-231 human breast cancer cells[J]. Mol Med Rep, 2015,12(1):623-630.
[3] Chen J, Liu B, Yuan J, et al. Atorvastatin reduces vascular endothelial growth factor (VEGF) expression in human non-small cell lung carcinomas (NSCLCs) via inhibition of reactive oxygen species (ROS) production[J]. Mol Oncol, 2012,6(1):62-72.
[4] Wood WG, Igbavboa U, Muller WE, et al. Statins, Bcl-2, and apoptosis: cell death or cell protection[J]. Mol Neurobiol, 2013,48(2):308-314.
[5] Al-Haidari AA, Syk I, Thorlacius H. HMG-CoA reductase regulates CCL17-induced colon cancer cell migration via geranylgeranylation and RhoA activation[J]. Biochem Biophys Res Commun, 2014,446(1):68-72.
[6] Fang Z, Tang Y, Fang J, et al. Simvastatin inhibits renal cancer cell growth and metastasis via AKT/mTOR, ERK and JAK2/STAT3 pathway[J]. PLoS ONE, 2013,8(5):e62823.
[7] Jeon CY, Pandol SJ, Wu B, et al. The association of statin use after cancer diagnosis with survival in pancreatic cancer patients: a SEER-medicare analysis[J]. PLoS ONE, 2015,10(4):e0121783.
[8] Walker EJ, Ko AH, Holly EA, et al. Statin use and risk of pancreatic cancer: results from a large, clinic-based case-control study[J]. Cancer, 2015,121(8):1287-1294.
[9] Carey FJ, Little MW, Pugh TF, et al. The differential effects of statins on the risk of developing pancreatic cancer: a case-control study in two centres in the United Kingdom[J]. Dig Dis Sci, 2013,58(11):3308-3312.
(收稿日期:2015-05-21)
中图分类号:R736.7
文献标志码:A
文章编号:1002-266X(2016)01-0030-03
doi:10.3969/j.issn.1002-266X.2016.01.010

