新疆吐鲁番、喀什葡萄树伤流液多糖分离纯化及其抗氧化活性比较研究
吕 乐,布热米古丽·买买提,艾尔肯·依不拉音*(.新疆医科大学药学院,乌鲁木齐 8300;.新疆喀什地区人民医院药剂科,喀什 844000)
新疆吐鲁番、喀什葡萄树伤流液多糖分离纯化及其抗氧化活性比较研究
吕乐1,布热米古丽·买买提2,艾尔肯·依不拉音1*(1.新疆医科大学药学院,乌鲁木齐830011;2.新疆喀什地区人民医院药剂科,喀什844000)
摘要:目的确定新疆葡萄树伤流液多糖含量,探究吐鲁番无核白和喀什木纳格萄萄树伤流液多糖及其纯化组分的抗氧化活性。方法采用蒽酮-硫酸法检测多糖含量,利用醇沉法和改进的Sevage法制备粗多糖,经过DEAE-52纤维素柱对粗多糖进行分离纯化,以羟自由基、超氧自由基、DPPH·自由基、亚硝基自由基、ABTS·自由基为指标检测多糖组分及原液的抗氧化能力。结果吐鲁番无核白和喀什木纳格葡萄树伤流液中多糖含量分别为114和193 μg·mL-1,经过DEAE-52纤维素柱分离分别得到8个多糖组分,其中两者4个含量较高的多糖组分和原液都具有不同程度的抗氧化活性,且对羟自由基的清除能力强于对其他4种自由基的清除能力,两地葡萄树伤流液的抗氧化活性存在差异。结论吐鲁番无核白和喀什木纳格葡萄树伤流液的多糖组分均具有一定的抗氧化活性,并且其抗氧化活性存在差异。
关键词:多糖;葡萄树伤流液;纯化;抗氧化活性
葡萄是新疆特色水果,产量居全国第一。在每年的3月下旬到4月上旬,从葡萄树树枝的伤口处会自然流出1种无色透明的微酸性液体,该液体就是葡萄树伤流液。葡萄树伤流液在民间被使用,将其直接饮之,可用于治疗气管炎、乏力、便秘;直接抹在头发上,可使头发变黑。维吾尔医认为其具有滋补强壮、软坚散结和补肝利胆的疗效,也有人将其作为化妆品的稳定剂[1]。每棵葡萄树每年可以流出几公斤甚至是十几公斤的伤流液,其资源很丰富,具有很强的抗羟自由基能力和热稳定性。无色透明液体不用化学处理直接可以使用,是较为理想的天然抗氧化剂[2]。研究表明,多糖不仅是生物体的重要组成部分,在向生命体提供能量和参与组织构成的同时,还具有许多重要的生理功能,如降血糖、降血脂、抗辐射、抗氧化、保肝、抗肿瘤、调节机体免疫力等作用[3-9]。其中抗氧化作用是多糖的重要生物活性,也是目前多糖研究的热点之一。
1仪器与材料
1.1仪器EYELA水浴锅SB-1000、UV-2550紫外-可见分光光度仪,AEL-160电子分析天平(日本,岛津);HH-S4数据恒温水浴锅(金坛市医疗仪器厂);EYELA旋转蒸发仪N-1001,EYELA冷却水循环装置CA-IIII (上海爱朗仪器有限公司);SHB-Ⅲ循环式真空泵(西安太康生物科技有限公司);DZF-6090真空干燥箱(上海一恒科学仪器有限公司);离心仪-Heraeus MultifugeX3R(美国,赛默飞世尔科技);GC-2010Plus气相色谱仪(Shimadzu,氢火焰离子化检测器)。
1.2试药D-无水葡萄糖对照品, 亚硝酸钠(天津市津北精细化工有限公司);蒽酮(上海工硕生物技术有限公司);浓硫酸(上海实验试剂有限公司,优级纯) ;甘露糖(Man)、鼠李糖(Rha)、半乳糖(Gal)、木糖(Xyl)、阿拉伯糖(Ara)(上海蓝季科技发展有限公司);DEAE-52纤维素柱(北京瑞达恒辉科技发展有限公司);·OH试剂盒(南京建成生物工程研究所);二苯代苦味肼基自由基DPPH·(Sigma公司);三羟甲基氨基甲烷 (Tris,上海源聚生物科技有限公司);对氨基苯磺酸(天津市光复精细化工研究所);盐酸萘乙二胺(天津市致远化学试剂有限公司);氢氧化钠、浓盐酸、氯化钠、乙酸乙酯、无水乙醇、丙酮、乙醚、磷酸、蒸馏水等试剂均为分析纯。
1.3材料葡萄树伤流液,2013年4月初采自新疆吐鲁番和喀什。样品采集方法:采用自然收集法,即在葡萄树枝自然伤口或人为伤口处收集靠根压溢出的伤流液,接入无菌保鲜袋,集中收集,冷冻保存,备用。
2实验方法
2.1标准曲线绘制精密称取105 ℃干燥至恒质量的D-无水葡萄糖对照品25 mg,置于100 mL量瓶中,加水稀释至刻度,摇匀,即得0.25 mg·mL-1的葡萄糖储备液。取上述储备溶液1 mL,加水稀释定容至10 mL量瓶中,即得0.025 mg·mL-1的葡萄糖对照品溶液。精密称取1.000 g蒽酮,置于50 mL棕色量瓶中,用乙酸乙酯溶解并定容至刻度,摇匀,即得0.020 g·mL-1的蒽酮乙酸乙酯溶液,待用。精密吸取葡萄糖对照品溶液0.2,0.4,0.6,0.8,1.0,1.5和2.0 mL,置于相应试管中,分别加蒸馏水至2.0 mL,各加入0.5 mL蒽酮乙酸乙酯溶液,摇匀,再各加入5.0 mL浓硫酸,摇匀,放置10 min至自然冷却到室温,以水为空白对照,在621 nm波长处测定吸光度。以吸光度(A)为纵坐标,无水葡萄糖的质量浓度(C)为横坐标进行线性回归[10-12]。
2.2葡萄树伤流液中多糖含量测定分别吸取已过滤的吐鲁番无核白和喀什木纳格萄萄树伤流液1.0 mL,按照2.1项下操作测定溶液的吸光度,根据样品溶液所产生的吸光度值,用回归方程计算葡萄树伤流液中的多糖含量。
2.3葡萄树伤流液粗多糖的制备葡萄树伤流液在60 ℃下减压浓缩,得浓缩倍数约为20倍的浓缩液。向浓缩液中加入适量的无水乙醇,至乙醇体积分数为20%(除去微水溶性杂质),4 ℃下静置12 h,离心(4 000 r·min-1,8 min),取上清液备用。上清液加无水乙醇至乙醇体积分数为80%,4 ℃下静置12 h,离心(4 000 r·min-1,8 min),取沉淀备用。沉淀经无水乙醇、丙酮、乙醚依次各洗涤3次,用改进的Sevage法除蛋白,真空干燥,得粗多糖。
2.4葡萄树伤流液多糖的分离纯化纤维素阴离子交换柱层析中最常见的交换剂为DEAE-52纤维素柱(硼酸型或碱型),洗脱剂可用不同浓度的碱溶液、硼砂溶液、盐溶液等。此方法目前最为常用。它一方面可纯化多糖,另一方面还适用于分离各种酸性多糖、中性多糖和黏多糖。
2.4.1DEAE-52纤维素柱的预处理称取100 g DEAE-52纤维素柱加入4~5倍的蒸馏水中,浸泡48 h,使纤维素颗粒充分膨胀,用倾倒法除去悬浮的细小颗粒,加入0.5 mol·L-1盐酸溶液浸泡2 h (1 g纤维素相当于加入15 mL 0.5 mol·L-1的盐酸溶液),抽滤法滤去酸液,纯水洗至中性,再加入0.5 mol·L-1氢氧化钠溶液浸泡搅拌2 h,滤去碱液,纯水洗至中性。酸碱反复洗涤,至洗出液为无色澄清为止。最后超声脱气,湿法装柱。
2.4.2上样和洗脱取处理好的粗多糖5 g,溶解于100 mL温水中,离心(4 000 r·min-1,5 min),取上清液,浓缩至40 mL,上样。以蒸馏水为洗脱液,分别用0.05,0.1,0.2,0.3,0.4,0.5和0.6 mol·L-1的氯化钠溶液进行梯度洗脱,流速调至1 mL·min-1,每管收集10 mL,用蒽酮-硫酸法跟踪检测,以蒸馏水为空白,置于621 nm的波长下测定吸光度,直到不再有糖检出。以管号为横坐标、吸光度为纵坐标,绘制洗脱曲线。合并各洗脱峰的洗脱液,浓缩至30~50 mL,透析除盐,以0.1 mol·L-1的硝酸银溶液检测盐是否除尽,除盐后样品减压浓缩。最后对填料DEAE-52纤维素柱进行再生处理。
2.5气相色谱法测定分离多糖组分的组成
2.5.1色谱条件 色谱柱:Rtx-5毛细管色谱柱(30 m×0.25 mm×0.25 μm);检测器:FID(氢火焰检测器);载气:氮气;检测器温度:280 ℃;进样温度:235 ℃。柱温为程序升温,初始柱温155 ℃,维持1 min,以0.4 ℃·min-1的速率升高到160 ℃,维持2 min,以0.5 ℃·min-1的速率升高到169 ℃,以0.2 ℃·min-1的速率升高到172 ℃。分流比为10∶1;H2流速:40 mL·min-1;尾吹:250 mL·min-1;进样量:1.0 μL。
2.5.2单糖对照品的乙酰化分别精确称取10 mg干燥至恒质量的甘露糖、鼠李糖、葡萄糖、半乳糖、木糖和阿拉伯糖标准单糖置于试管中,分别加入10 mg盐酸羟胺和0.5 mL吡啶,混匀,封管,置于90 ℃水浴中反应30 min,取出后冷却至室温,加入0.5 mL醋酸酐,混匀,封管,置于90 ℃水浴中反应30 min,进行乙酰化反应,在60 ℃水浴中将反应物用氮气吹干,用1 mL氯仿将其溶解,进行气相色谱分析。按照以上方法,将6种标准单糖分别进行乙酰化反应。
2.5.3样品的乙酰化取经DEAE-52纤维素柱分离纯化的葡萄树伤流液进行多糖组分干燥,取5 mg放入试管中,加入4 mol·L-1的三氟乙酸2 mL,混匀,充氮气,封闭,在沸水浴中水解12 h,水解后用氮气在60 ℃水浴中将反应产物吹干,加入乙醇,反复吹干,除尽三氟乙酸,水解后的多糖按照2.5.2项下标准单糖乙酰化的方法将多糖进行乙酰化,进行气相色谱分析。
2.6葡萄树伤流液及其多糖组分的抗氧化能力测定
2.6.1对·OH 的清除能力按照南京建成生物工程研究所提供的·OH试剂盒说明书进行。在反应体系中分别加入质量浓度为1 mg·mL-1的纯化后的各多糖组分水溶液及过滤好的原液0.2 mL,检测体系中·OH的剩余量。平行做3次取平均值,按照以下·OH抑制率计算公式计算清除率[13]。
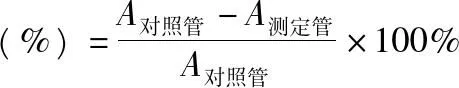
2.6.2对超氧阴离子自由基的清除能力取0.05 mol·L-1pH值为8.2的Tris-HCl缓冲液4.5 mL,置于试管中,在25 ℃水浴中预热20 min。分别加入质量浓度为1 mg·mL-1的各多糖组分0.1 mL后,各加入2.5mmol·L-1的邻苯三酚(由10 mmol·L-1盐酸溶液配制)0.4 mL,混匀,在25 ℃水浴中反应4 min,立即加入8 mol·L-1的盐酸溶液2滴终止反应,用蒸馏水调零,在300 nm处测定吸光度。空白组以0.1 mL蒸馏水代替样品试液。平行做3次取平均值,按照以下公式计算清除率:

2.6.3对亚硝基自由基的清除能力取3支5 mL比色管a、b、c,准确吸取0.5 mL质量浓度为 5μg·mL-1的硝酸钠溶液2份,分别加入到a和c管中,吸取1 mL葡萄树伤流液原液2份,分别加入到a和b管中,反应10 min后,a、b、c管中分别加入4 g·L-1的对氨基苯磺酸溶液1.0 mL,摇匀反应5 min后,再加入2 g·L-1的N-1-苯基乙二胺盐酸盐溶液1.0 mL,摇匀,15 min后,在最大吸收波长540 nm处测定吸光度。平行做3次取平均值,按照下式计算对NO2-·的清除率。
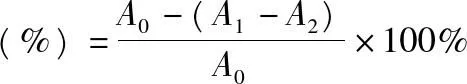
式中,A0为不加样品溶液的吸光度;A1为加入样品溶液后的吸光度;A2为不加硝酸钠时的吸光度。
2.6.4对DPPH·自由基的清除能力分别吸取2 mL质量浓度为1 mg·mL-1的葡萄树伤流液多糖组分及过滤好的原液,置于5 mL量瓶中,加入2 mL所配制的2×10-4DPPH·乙醇溶液,混匀,密闭静置30 min,倒入光径为1 cm的比色皿,在517 nm处测定其吸光度为Ai;测定2 mL质量浓度为 1 mg·mL-1多糖组分,加 2 mL乙醇的吸光度为Aj;测定2 mL DPPH·溶液加2 mL二次蒸馏水的吸光度为A0。平行做3次取平均值,按照以下公式计算清除率[14]。
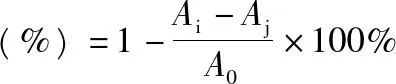
2.6.5对ABTS·自由基的清除能力分别吸取5 mL和88 μL 7 mmol·L-1的ABTS·和140 mmol·L-1的过硫酸钾溶液,在室温、避光条件下静置过夜。配置ABTS·自由基储备液,按照1∶50的比例用蒸馏水稀释成工作液。样品管中加入200 μL质量浓度为1 mg·mL-1的葡萄树伤流液多糖样品和3 mL ABTS·溶液;空白管用二次蒸馏水代替多糖溶液;对照管用二次蒸馏水代替ABTS·溶液;在室温条件下避光放置1 h,在730 nm 处测定其吸光度。平行做3次取平均值,按照以下公式计算清除率。

3实验结果
3.1葡萄糖标准曲线及葡萄树伤流液多糖含量测定结果葡萄糖线性回归方程如下:A=0.037 8C+0.083,r=0.999 6,表明葡萄糖质量浓度在50~250μg·mL-1范围内呈良好的线性关系。得出吐鲁番无核白和喀什木纳格伤流液原液中多糖质量浓度分别为114和193 μg·mL-1。
3.2DEAE-52纤维素柱分离葡萄树伤流液多糖洗脱曲线见图1~2。
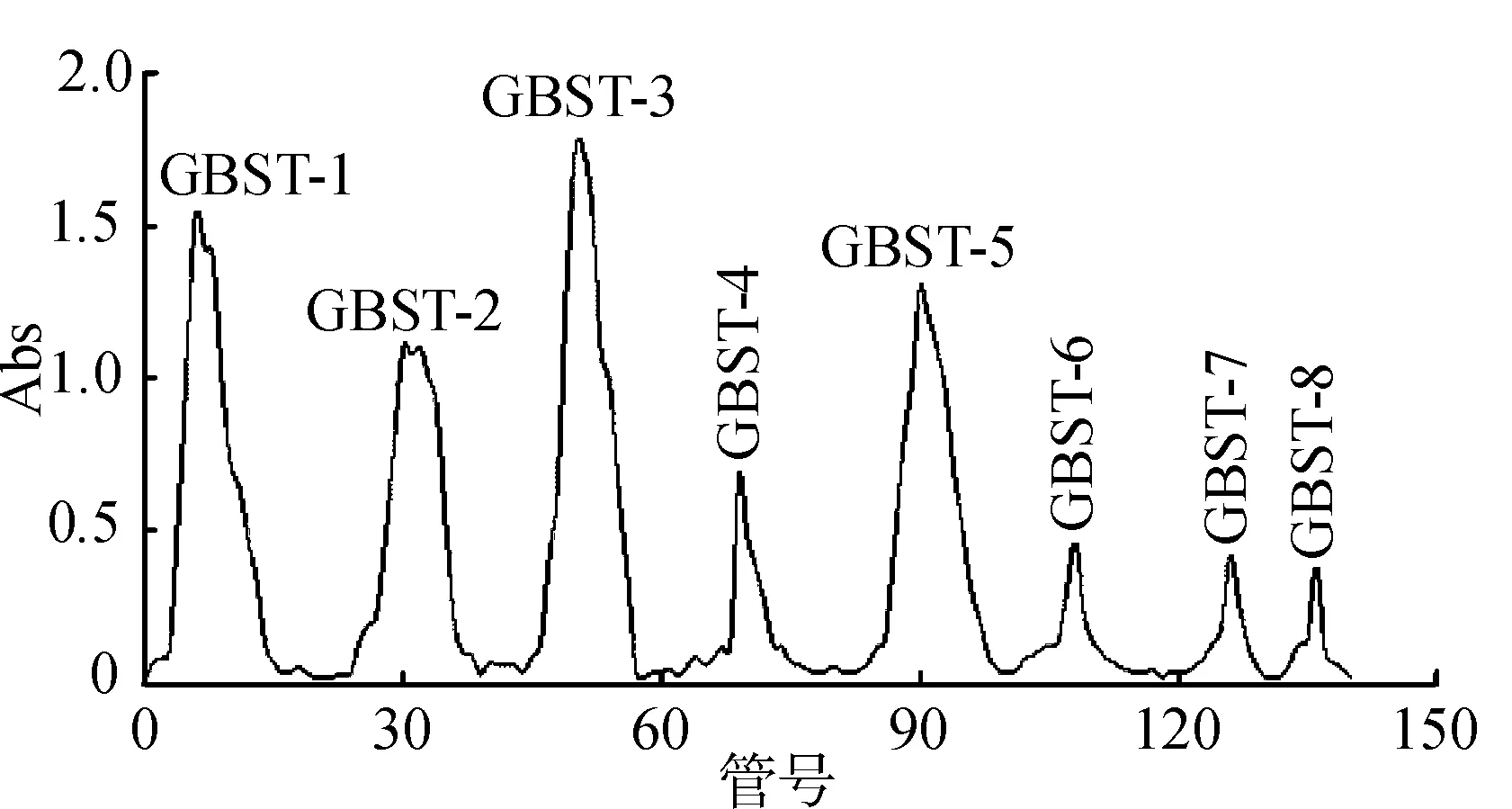
图1吐鲁番葡萄树伤流液(GBST)多糖DEAE-52纤维素柱洗脱曲线
Fig.1 Elution curve of GBST polysaccharide on DEAE-52 column
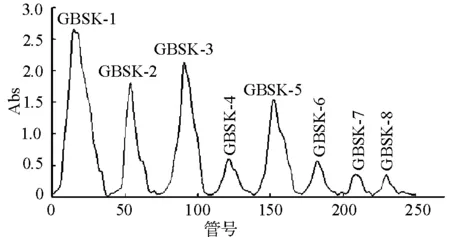
图2喀什葡萄树伤流液(GBSK)多糖 DEAE-52纤维素柱洗脱曲线
Fig.2 Elution curve of GBSK polysaccharide on DEAE-52 column
由DEAE-52纤维素柱洗脱曲线可知,DEAE-52纤维素柱对葡萄树伤流液多糖的分离效果好,吐鲁番无核白和喀什木纳格葡萄树伤流液多糖各分离得到8个多糖组分,各组分的峰形比较对称。葡萄树伤流液的8个多糖组分分别为:水洗组分GBST-1、GBSK-1,0.05 mol·L-1氯化钠溶液洗脱组分GBST-2、GBSK-2,0.1 mol·L-1氯化钠溶液洗脱组分GBST-3、GBSK-3,0.2 mol·mL-1氯化钠溶液洗脱组分GBST-4、GBSK-4,0.3 mol·L-1氯化钠溶液洗脱组分GBST-5、GBSK-5,0.4 mol·mL-1氯化钠溶液洗脱组分GBST-6、GBSK-6,0.5 mol·mL-1氯化钠溶液洗脱组分GBST-7、GBSK-7和0.6 mol·mL-1氯化钠溶液洗脱组分GBST-8、GBSK-8。由于0.2,0.4,0.5和0.6 mol·L-1氯化钠溶液洗脱组分含量较低,所以仅对多糖组分含量较高的洗脱部分减压浓缩到30~50 mL,透析除盐,做抗氧化活性测定。
3.3气相色谱分析洗脱多糖组分通过气相色谱数据,定量分析分离纯化所得喀什木纳格葡萄树伤流液多糖GBSK-1、GBSK-2 、GBSK-3 、GBSK-5和吐鲁番无核白GBST-1 、GBST-2 、GBST-3 、GBST-5 的组成摩尔比,见表1。多糖中含量最低的单糖摩尔比为1.00。可以看出,8个组分多糖的单糖含量和组成有很大差异。
表1葡萄树伤流液多糖的单糖组分气相色谱分析结果
Tab.1 Monosaccharide composition of different GBS polysaccharides
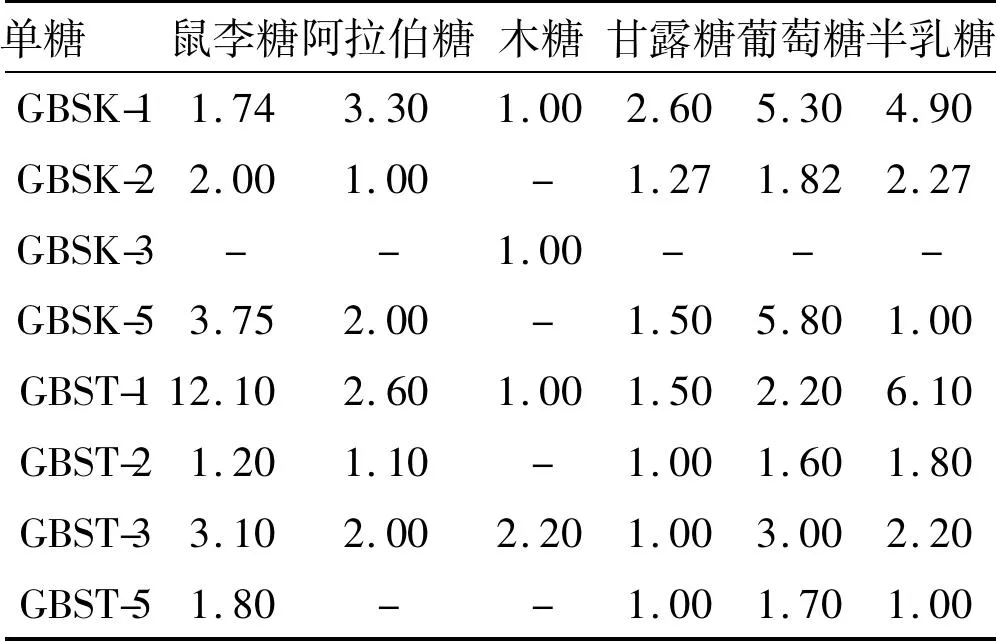
单糖鼠李糖阿拉伯糖木糖甘露糖葡萄糖半乳糖GBSK-11.743.301.002.605.304.90GBSK-22.001.00-1.271.822.27GBSK-3--1.00---GBSK-53.752.00-1.505.801.00GBST-112.102.601.001.502.206.10GBST-21.201.10-1.001.601.80GBST-33.102.002.201.003.002.20GBST-51.80--1.001.701.00
3.4抗氧化能力
3.4.1清除羟自由基能力见图3。由图3可知,吐鲁番无核白和喀什木纳格葡萄树伤流液原液及其多糖分离组分(质量浓度1 mg·mL-1)都具有一定的清除羟自由基能力,且喀什木纳格葡萄树伤流液原液及多糖组分GBSK-1、GBSK-3和GBSK-5的羟自由基清除率高于相应的吐鲁番无核白葡萄树伤流液。分离纯化后的多糖组分相对弱于原液清除羟自由基的能力。用氯化钠溶液梯度洗脱, 洗脱液的极性增加,洗脱液羟自由基清除率下降。说明多糖组分的极性也是影响其抗氧化活性的一个因素。
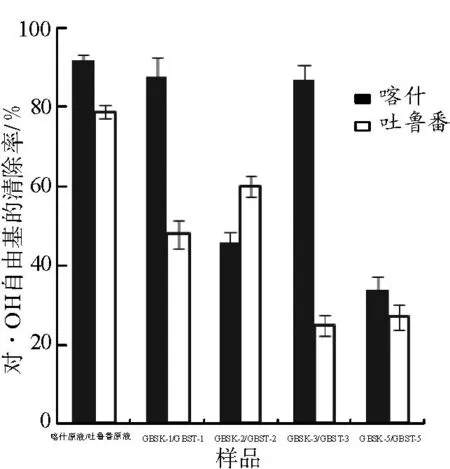
图3葡萄树伤流液多糖组分对羟自由基的清除能力
Fig.3 Hydroxyl radicals scavenging ability of GBS polysaccharides
3.4.2清除超氧阴离子自由基的能力见图4。由图4可知,葡萄树伤流液和其多糖组分对超氧阴离子自由基均具有一定的清除作用,比清除羟自由基能力弱。且吐鲁番无核白葡萄树伤流液原液及多糖组分GBST-2和GBST-3的羟自由基清除率高于相应的喀什木纳格葡萄树伤流液。
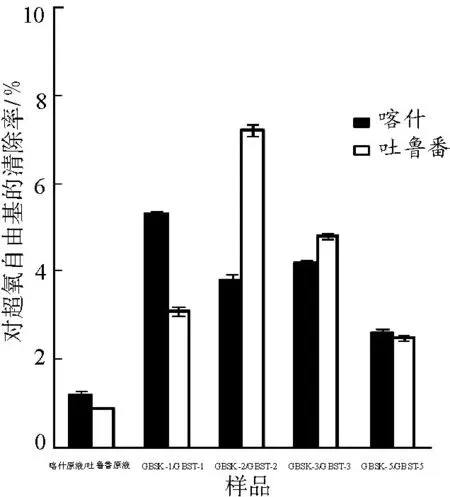
图4葡萄树伤流液多糖组分对超氧阴离子自由基的清除能力
Fig.4 Oxygen free radicals scavenging ability of GBS polysaccharides
3.4.3清除亚硝基自由基的能力见图5。由图5可知,葡萄树伤流液及葡萄树伤流液中提取分离的多糖组分均具有清除亚硝基自由基的能力。蒸馏水洗脱组分GBST-1要高于GBSK-1的亚硝基自由基清除率。GBST-2和GBSK-2的亚硝基清除率相差不大。
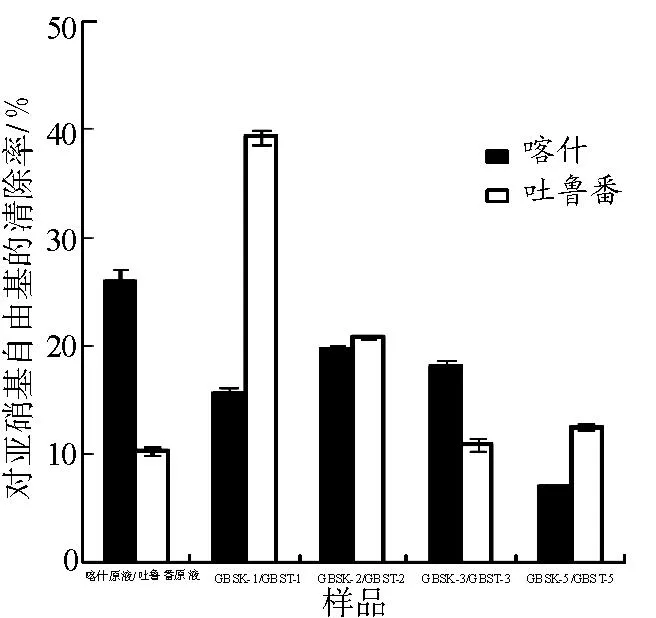
图5葡萄树伤流液多糖组分对亚硝基自由基的清除能力
Fig.5 Nitroso free radicals scavenging ability of GBS polysaccharides
3.4.4清除DPPH·自由基的能力见图6。
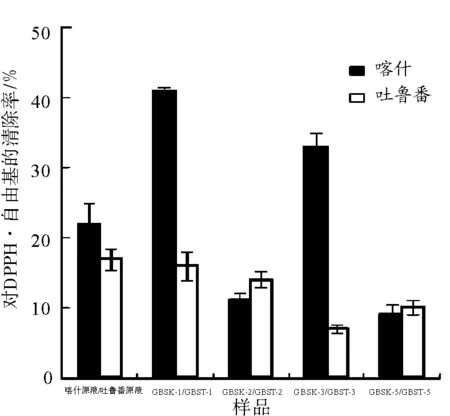
图6葡萄树伤流液多糖组分对DPPH·自由基的清除能力
Fig.6 DPPH·free radicals scavenging ability of GBS polysaccharides
由图6可知,葡萄树伤流液原液和其多糖组分均具有清除DPPH·自由基能力。蒸馏水洗脱组分GBSK-1和GBSK-3要高于GBST-1和GBST-3的DPPH·自由基清除率。GBSK-2和GBST-2,GBSK-5和GBST-5的DPPH·自由基清除率相差不大。
3.4.5ABTS法测总抗氧化能力本实验以ABTS·自由基为指标检测其总抗氧化能力。见图7。由图7可知,葡萄树伤流液及其多糖组分均具有清除ABTS·自由基的能力,吐鲁番葡萄树伤流液原液对ABTS·自由基清除率为8.0%。组分GBST-2在吐鲁番无核白多糖分离组分中清除ABTS·自由基的能力最强,清除率达到了77%,喀什木纳格多糖分离组分GBSK-3是其分离组分中活性最高的。
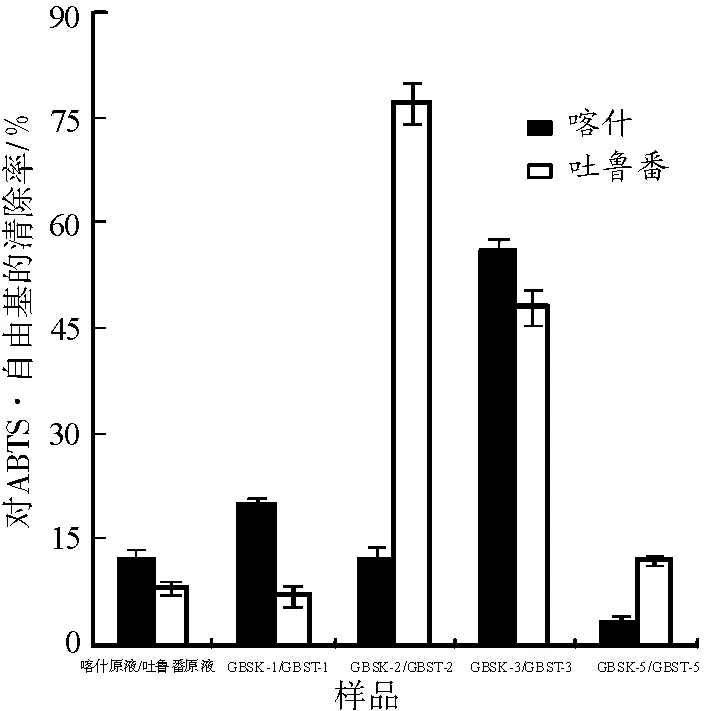
图7葡萄树伤流液多糖组分对ABTS·自由基的清除能力
Fig.7 ABTS radicals scavenging ability of GBS polysaccharides
由图3~7可知,葡萄树伤流液及其多糖组分均具有不同程度的抗氧化活性。不同的自由基,其抗氧化能力有差别。可得出葡萄树伤流液多糖组分及原液对羟自由基清除能力均大于对超氧阴离子自由基、氧自由基、DPPH·自由基、亚硝基自由基、ABTS·自由基的清除能力。各多糖组分抗氧化能力比较见表2。
表2不同多糖的抗氧化能力的比较
Tab.2 Comparison of polysaccharides antioxidant activities
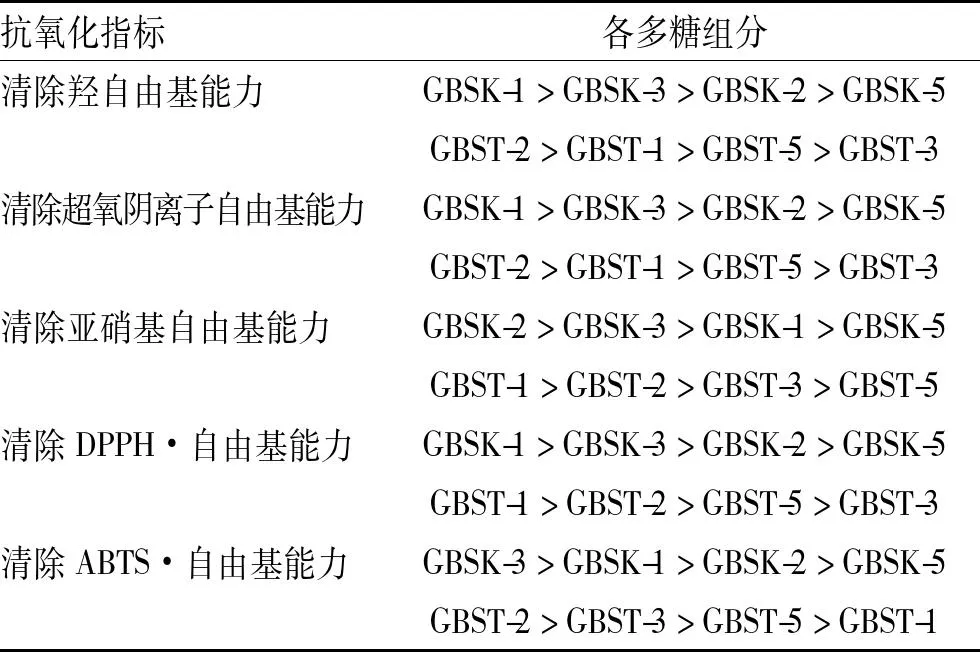
抗氧化指标各多糖组分清除羟自由基能力GBSK-1>GBSK-3>GBSK-2>GBSK-5GBST-2>GBST-1>GBST-5>GBST-3清除超氧阴离子自由基能力GBSK-1>GBSK-3>GBSK-2>GBSK-5GBST-2>GBST-1>GBST-5>GBST-3清除亚硝基自由基能力GBSK-2>GBSK-3>GBSK-1>GBSK-5GBST-1>GBST-2>GBST-3>GBST-5清除DPPH·自由基能力GBSK-1>GBSK-3>GBSK-2>GBSK-5GBST-1>GBST-2>GBST-5>GBST-3清除ABTS·自由基能力GBSK-3>GBSK-1>GBSK-2>GBSK-5GBST-2>GBST-3>GBST-5>GBST-1
葡萄树伤流液多糖组分对不同的自由基,其抗氧化能力有差别,可能与其结构或组成成分有关,也可能与其产地品种有关。葡萄树伤流液多糖组分对羟自由基的清除能力均高于其他超氧阴离子自由基、亚硝基自由基、DPPH·自由基、ABTS·自由基的清除能力,此性质与葡萄树伤流液原液性质相似。由此得出,葡萄树伤流液多糖可能是葡萄树伤流液抗氧化活性物质之一。可能是因为地域和品种的差异,分离所得多糖的极性和组成成分也是影响因素之一。
4讨论
在葡萄树伤流液多糖的分离纯化过程中,只对含量较高的组分进行了抗氧化活性研究。因此,对葡萄树伤流液多糖的研究还有待进一步深入研究。研究表明,伤流液的抗氧化活性与其产地和品种都有关系[15]。而本文只针对吐鲁番无核白伤流液的多糖组分进行了研究,还有其他地区和品种的样品需要探索。此外,多糖具有多种生物活性,所以其他方面的活性研究也至关重要。
参考文献:
[1]刘勇民,沙吾提·伊克木.维吾尔药志[M].乌鲁木齐:新疆科技卫生出版社,1999 :365.
[2]伊力哈木·托合迪,买吐孙·买提肉孜,艾力·阿巴白克力.沙枣树胶恢复变质葡萄树伤流液抗氧化能力的生物活性作用研究[J].现代农业科学,2009,16(3):32-34.
[3]赵婧,袁驰,周春丽,等.南瓜多糖降血糖作用研究进展[J].食品研究与开发,2014,35(7):108-110.
[4]杨强,李新华,张振,等.银杏果精多糖的降血脂作用[J].食品与发酵工业 ,2013,39(5):62-65.
[5]刘宏.荞麦多糖研究进展[J].北方药学,2015,12(1):89-91.
[6]Chen H X,Zhang M,Xie B J. Components and antioxidant activity of polysaccharide conjugate from green tea[J].Food Chem,2009,57(13):5795-5798.
[7]刘丽花.当归多糖抗氧化作用的研究[J].当代医药论丛,2014,12(3):284-285.
[8]李立华,张国升.芦根多糖保肝作用及抗肝纤维化的研究[J].安徽中医学院学报,2007,26(5):32-34.
[9]梁语丝,邹华伟,谭永刚.云芝多糖的抗肿瘤作用研究进展[J].中国实用医药,2014,9(13):259-262.
[10]Rinrampai Puttipan,Siriporn Okonogi.Antioxidant activity ofRafflesiakerriiflower extract[J].Drug Discove & Therapeutics,2014,8(1):18-24.
[11]布米热古丽·买买提,艾尔肯·依不拉音,朱富荣,等.新疆葡萄树伤流液中总糖含量的比较研究[J].西北药学杂志,2013,28(3):224-226.
[12]朱良,王一飞,朱艳梅.裙带菜孢子叶多糖含量的测[J].食品科学,2005,26(10):184-186.
[13]葛明明,缪月英,孙丽娜,等.蒲公英根多糖的抗氧化活性研究[J].黑龙江医药科学.2014,37(2):39-41.
[14]高阳,姜会敏,霍雅玉,等.刺玫果的体外抗氧化活性研究[J].西北药学杂志,2014,29(3):226-230.
[15]艾尔肯·依不拉音,阿吉姑·阿布都热西提,李建光,等.新疆葡萄树伤流液抗氧化活性及热稳定性的研究[J].食品与发酵工业,2009,35(1):14-16.
Study on the antioxidant activity of polysaccharides from Xinjiang grapevine bleeding sap of Turpan and Kashgar
LÜ Le1,Buremiguli MAIMAITI2,Arkin IBURAIM1*(1.College of Pharmacy,Xinjiang Medical University,Urumqi 830011,China;2.Department of Pharmacy, Kashgar People′s Hospital in Xinjiang ,Kashgar 844000,China)
Abstract:Objective To study the extraction and purification of polysaccharides in Turpan seedless white and Kashgar munage grapevine bleeding sap, and to study the antioxidant activities. Methods Polysaccharide content was determined by anthrone-sulfuric acid method.Crude polysaccharide was prepared by alcohol precipitation, the improved Sevage method,and DEAE-52 column. The antioxidant activity of polysaccharides in vitro was determined and evaluated by the scavenging ratio of hydroxyl free radicals,oxygen free radicals,DPPH·radicals,nitroso radicals and ABTS·radicals. Results Polysaccharides content in Kashgar munage and Turpan seedless grapevine bleeding sap was 193 and 114 μg·mL-1. Eight relatively pure polysaccharides were obtained,four of which were higher than the others. They all showed antioxidant activity to some extend and this might relate to their origins and types. Conclusion Polysaccharides in Kashgar munage and Turpan seedless grapevine bleeding sap had antioxidant activity.
Key words:polysaccharides;grapevine bleeding sap;purify; antioxidant activity
(收稿日期:2015-06-17)
*通信作者:艾尔肯·依不拉音,男,教授,博士生导师
作者简介:吕乐,女,博士研究生
基金项目:国家自然科学基金项目(编号:21162030)
中图分类号:R284
文献标志码:A
文章编号:1004-2407(2016)02-0124-07
doi:10.3969/j.issn.1004-2407.2016.02.005

